量子点免疫荧光技术在病理诊断中的初步应用
2011-11-02朱小波黄燕华彭俊高俊李蓓芸陈洪雷
朱小波黄燕华彭 俊高 俊李蓓芸陈洪雷
(1武汉市肿瘤纳米诊断工程技术研究中心;2武汉大学基础医学院病理学教研室 ;
3武汉珈源量子点技术开发有限公司,武汉 430072)
量子点免疫荧光技术在病理诊断中的初步应用
朱小波1,3黄燕华3彭 俊1,3高 俊3李蓓芸3陈洪雷2*
(1武汉市肿瘤纳米诊断工程技术研究中心;2武汉大学基础医学院病理学教研室 ;
3武汉珈源量子点技术开发有限公司,武汉 430072)
目的 利用量子点(quantum dots,QDs)免疫荧光技术检测石蜡包埋组织中不同蛋白的定位与免疫酶法进行比较,以及两种蛋白的共表达,并探讨其初步应用价值。方法 利用QDs免疫荧光和免疫酶组织化学方法分别检测正常阑尾组织LCA、乳腺肌上皮组织Calponin、肺癌组织p53蛋白的表达,并利用QDs免疫荧光双标法同时检测了宫颈上皮内瘤变组织内CK和PCNA蛋白、乳腺癌组织内 Her-2和CK蛋白的共表达。结果 QDs免疫荧光和免疫酶组织化学技术分别检测LCA、Calponin和p53蛋白的定位完全一致。QDs免疫荧光双标法结合多光谱成像可同时观察到宫颈上皮内瘤变组织内CK和PCNA蛋白、乳腺癌组织内 Her-2和CK蛋白的共表达。结论 QDs免疫荧光组织化学法具有与免疫酶法等同的应用价值。QDs免疫荧光双标法可同时检测不同蛋白的共定位。
量子点; 免疫荧光; 多重标记; 多光谱成像
量子点(Quantum dots,QDs)或半导体纳米微晶体,作为一种新型的荧光染料用于生物医学领域的研究始于20世纪70年代末。与传统荧光染料相比,QDs具有许多独特的性质如激发光谱宽而连续、荧光强度高,发光时间长,光化学稳定性好等特性,还能够对亚细胞分子进行多种标记,使之成为近乎完美的荧光标志物,故量子点点亮了病理学[1]。本研究利用不同发射波长的量子点(605nm,545nm)标记的生物分子如链霉亲和素、二抗IgG为基础,采用量子点免疫荧光组织化学方法(QDs immunofluorescence histochemistry,QDs-IHC)在石蜡包埋的不同组织切片上检测不同蛋白的定位以及两种蛋白的共表达,并与传统的免疫酶法进行比较,评价其初步应用价值。
材料和方法
1.材料
1.1 组织标本 随机选取我院归档的病理石蜡标本包括肺癌、乳腺癌和宫颈上皮内瘤变组织以及正常阑尾组织各5例。
1.2 主要试剂和仪器 鼠抗人p53、CK、Calponin、LCA(CD45)单克隆抗体(浓缩型,工作浓度均为1:150)、兔抗人 Her-2、PCNA多克隆抗体(浓缩型,工作浓度分别为1:150,1:200)、生物素化羊抗鼠和羊抗兔IgG(浓缩型,工作浓度1:400);免疫组化PV-9000通用型试剂盒(即用型);量子点超敏试剂盒(605nm QDs-SA)、量子点双染荧光试剂盒(605nm QDs-SA和545nm QDs-IgG(羊抗兔));荧光图像采集和分析采用日本Olympus BX51(CCD DP72)和美国剑桥NuanceTM多光谱显微成像系统;以上试剂和仪器均由武汉珈源量子点技术开发有限公司提供。
2.方法
2.1 量子点免疫荧光组织化学法检测不同蛋白的定位
实验方法参照文献[2],采用605nm发射波长的量子点标记的链霉亲和素为基础检测不同组织中蛋白的定位。如正常阑尾组织LCA、乳腺肌上皮组织Calponin、肺癌组织p53蛋白的定位。上荧光显微镜蓝光激发,605nm QDs-SA以细胞内出现红色的荧光信号为阳性。用 TBS代替一抗作阴性对照,以已知阳性片作阳性对照。
2.2 免疫组化PV-9000法检测不同蛋白的定位
为了验证量子点免疫荧光法检测不同蛋白的定位是否准确,在连续切片上也分别检测了正常阑尾组织LCA、乳腺肌上皮组织Calponin、肺癌组织p53蛋白的表达。详细实验步骤,严格按照说明书进行。采用DAB显色,苏木精复染,封片后在 Olympus BX51(CCD DP72)成像系统进行与量子点免疫荧光法相同视野成像分析。
2.3 量子点免疫荧光双标法检测两种蛋白的共表达
详细实验步骤参照文献[3],简述如下:在宫颈上皮内瘤变组织内检测CK和PCNA蛋白的共表达,乳腺癌组织内检测Her-2和CK的共表达。分别滴加用抗体稀释液稀释的QDs-SA(605nm)和QDs-IgG(545nm),37℃湿盒孵育 45 min;TBS洗(2×3min),90%缓冲甘油封片,荧光显微镜下观察成像,QDs-IgG(545nm)标记的 Her-2蛋白以细胞胞膜内出现绿色的荧光信号为阳性,而PCNA则定位于胞核;QDs-SA(605nm)标记的CK蛋白以细胞质内出现红色的荧光信号为阳性。CK和PCNA蛋白的共表达采用紫外和蓝光激发,荧光显微镜下直接观察成像;而Her-2和CK蛋白的共表达则在紫外激发下利用多光谱显微成像系统进行处理。
结 果
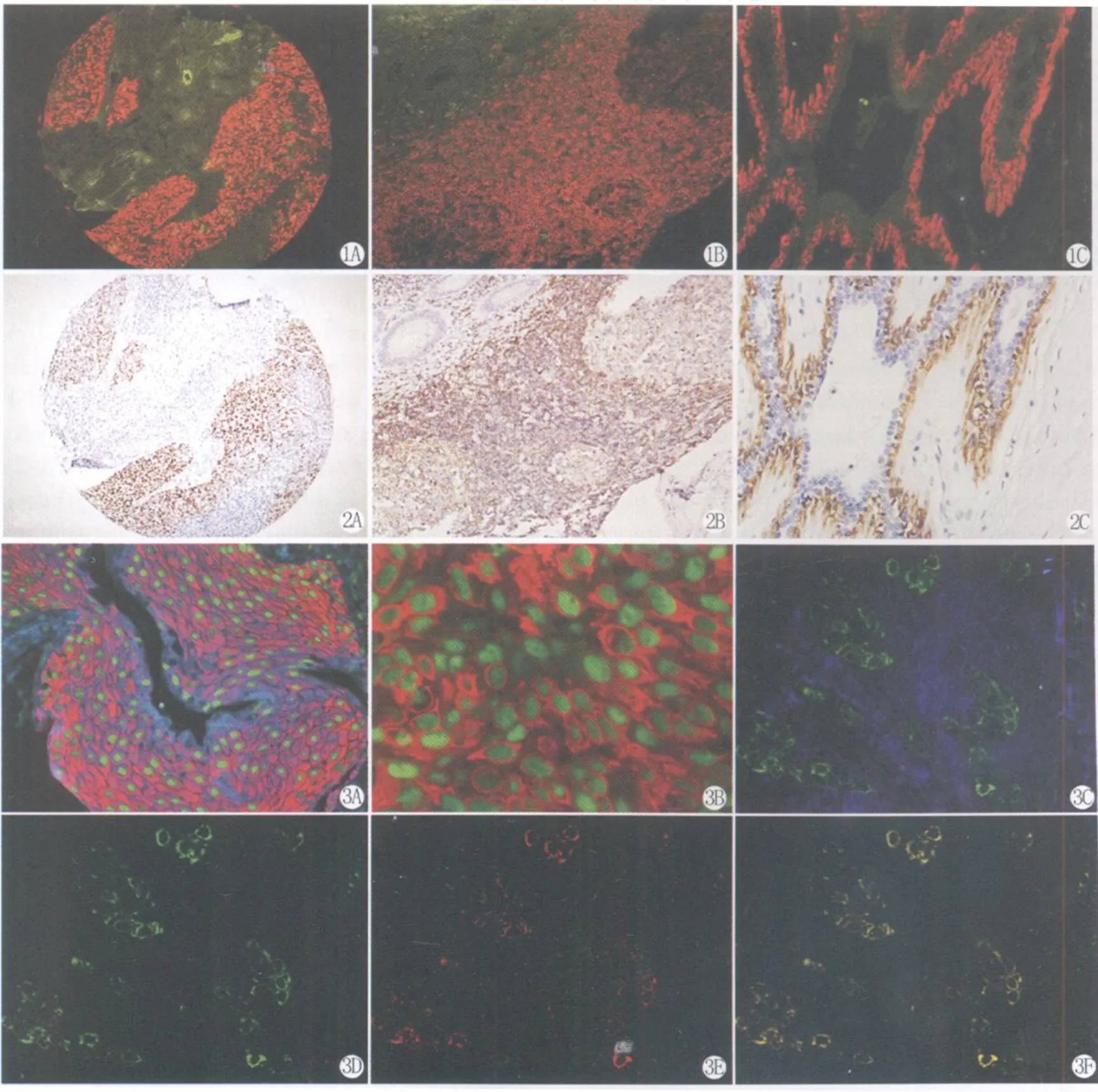
荧光显微镜下蓝光激发观察到p53蛋白定位于肺癌细胞的胞核(图1a),LCA定位于正常阑尾组织里淋巴细胞的胞膜(图1b),Calponin则定位于乳腺肌上皮细胞的胞质(图1c)。以上3种不同蛋白的定位与免疫组化 PV-9000法检测的完全一致(图2a-c),但量子点免疫荧光的信号更强。
量子点免疫荧光双标法检测到宫颈上皮内瘤变组织内CK和PCNA蛋白的共表达,荧光显微镜下紫外和蓝光激发均显示CK定位于胞质,呈红色信号,而PCNA定位于胞核,呈绿色信号,定位准确,背景清晰(图3a-b)。Her-2主要定位于胞膜而CK定位于胞质,二者定位很接近,不可避免会有信号的重叠,图3c显示乳腺癌组织内 Her-2和CK蛋白共表达的RGB原始图像。当两种以上的蛋白定位完全相同或相近时,能借助多光谱成像系统进行解混,会得到每一种蛋白的单独信号,还可去除组织的自发荧光,可提高图像的信噪比。图3d显示多光谱解混后 Her-2蛋白表达的信号,图3e显示多光谱解混后CK蛋白表达的信号。图3f显示多光谱解混后Her-2和CK蛋白共表达的信号,96.8%的肿瘤细胞呈现共定位,与图3c相比,去除了组织的自发荧光,显著提高了图像的信噪比,并且可得到两种蛋白共定位的准确数值。
讨 论
1.量子点的光学特性
量子点是一种由 Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成的,粒径约为2-6nm,能够接受激发光产生荧光的半导体纳米微晶体,生物标记中最常用的是CdSe系列量子点。由于量子点具有激发光谱宽而连续、发射光谱窄而对称、荧光强度高(是罗丹明6G的20倍)、光化学稳定性好(是罗丹明 6G的 100倍以上)、耐光漂白、发射光颜色与粒径大小关联等优点,使量子点成为一种最佳的荧光标记物被广泛应用于蛋白质及DNA、RNA检测、细胞标记成像、药物筛选、病原体检测、活细胞生命动态过程示踪、活体动物体内肿瘤细胞靶向示踪、荧光共振能量转移等生物医学领域[1-4]。
2.量子点在免疫荧光组织化学中的应用
本研究利用量子点与链霉亲合素偶联的复合物作为特异性探针,能与生物素化的抗体结合,这样形成的QDs复合物即可用于免疫荧光分析。本研究利用QDs免疫荧光和免疫酶组织化学技术分别检测定位于胞膜、胞质和胞核的不同蛋白的表达如:正常阑尾组织LCA、乳腺肌上皮组织 Calponin、肺癌组织p53蛋白的表达,结果表明QDs免疫荧光和免疫酶组织化学技术分别检测LCA、Calponin和p53蛋白的定位完全一致,而且前者的信号更强。量子点荧光信号的结果既可水性封片也可脱水封片,并且可长时间室温保存并保持和初次分析时相同水平的敏感度,本研究最长跟踪了3个月,而文献报道最长的是18个月[1]。我们以往研究还发现即使在荧光信号减弱后,再加入QDs-SA,可以重新恢复淬灭的荧光信号,而且,很有趣的发现是并不影响利用免疫酶法进行相关抗原的检测[2]。以上提示QDs免疫荧光组织化学法具有和免疫酶法等同的应用价值。我们以往的报道表明,在肺癌组织芯片上采用QDs免疫荧光技术高通量检测了caveolin-1和PCNA的蛋白表达,效果优于传统的免疫酶法[5]。
量子点直径的可调性以及同一激发光可激发不同量子点,这些独特特征能够同时分析多种抗原,特别对于复杂的标本需要分析大量参数时很有价值。本研究利用量子点免疫荧光双标法同时检测了宫颈上皮内瘤变组织内CK和 PCNA蛋白的共表达,结果观察到在不同波长(紫外光或蓝光)的激发下均能清晰显示这两种蛋白在同一细胞内的定位,效果很好,表明不同激发光也能激发同一量子点,量子点免疫荧光双标法可同时检测不同蛋白的共定位。这种不必转换滤光片可同时显示两种颜色的量子点和很耐光的发射波峰,使量子点很方便和简单地应用于免疫荧光多指标的检测[6]。当两种以上的蛋白定位完全相同或相近时,不可避免会有不同信号的重叠,这挑战了人类眼睛的检出极限。多光谱成像系统是基于液晶可调谐滤光技术,可以在不同波长处(420nm-720nm)检测荧光探针或染料在细胞或组织中的分布,可获取不同波长范围内的所有信号,通过光谱学的原理,把每一种色原或染料分离成自己单独的图像,完全去除样本的自发荧光,可显著提高组织切片成像的信噪比,在生物医学中可能有着广泛的应用[7]。本研究利用量子点免疫荧光双标法结合多光谱成像系统分析了乳腺癌组织内 Her-2和CK蛋白的共表达,通过多光谱成像系统解混后,能得到每一种蛋白的单独信号,与传统成像方法相比,去除了组织的自发荧光,提高了图像的信噪比,并能完成单指标的定量分析以及多指标之间共定位的定量数据。Chen等[8]在乳腺癌组织芯片中同时检测了70例乳腺癌 Her-2和 ER的共表达,有助于理解乳腺癌异质性进展中的相互作用,并有利于临床指导个体化治疗。文献报道在石蜡包埋组织中的同一标本上最多实现了4个不同蛋白共表达的检测[9]。以上均提示在病理诊断中,量子点可实现多指标的同时检测。
[1]Tholouli E,Sweeney E,Barrow E,et al.Quantum dots light up pathology.J Pathol,2008,216(3):275-285
[2]陈洪雷,张玉霞,夏东,等.在组织芯片上利用量子点技术进行抗原的检测.中华病理学杂志,2008,37(6):416-417
[3]陈福春,潘琦,张玉霞,等.CDl47和 PCNA蛋白在人肺癌组织中的表达意义.中国病理生理杂志,2010,26(7):1450-1452
[4]Frasco MF,Chaniotakis N.Bioconjugated quantum dots as fluorescent probes for bioanalytical applications.Anal Bioanal Chem,2010,396(1):229-240
[5]Chen H,Xue J,Zhang Y,et al.Comparison of quantum dots immunofluorescence histochemistry and conventional immunohistochemistry for the detection of caveolin-1 and PCNA in the lung cancer tissue microarray.J Mol Histol,2009,40(4):261-268
[6]陈洪雷,朱小波,李蓓芸,等.在石蜡包埋组织中利用量子点免疫双标法进行蛋白的检测.中华病理学杂志,2009,38(6):420-422
[7]Levenson RM,Mansfield JR.Multispectral imaging in biology and medicine:slices of life.Cytometry A,2006,69(8):748-758
[8]Chen C,Peng J,Xia H,et al.Quantum-dot-based immunofluorescent imaging of HER2 and ER provides new insights into breast cancer heterogeneity.Nanotechnology,2010,21(9):95-101
[9]Sweeney E,Ward TH,Gray N,et al.Quantitative multiplexed quantum dot immunohistochemistry.Biochem Biophys Res Commun,2008,374(2):181-186
图 版 说 明
图1a p53蛋白在肺癌组织中的胞核表达,阳性信号呈红色,蓝光激发,QDs-IHC法 ×100
图1b LCA蛋白在正常阑尾组织的淋巴细胞的胞膜呈阳性表达,蓝光激发,QDs-IHC法 ×100
图1c Calponin蛋白在乳腺肌上皮细胞的胞质呈阳性表达,蓝光激发,QDs-IHC法 ×200
图2a p53蛋白在肺癌组织中的胞核表达,阳性信号呈棕黄色,PV法 ×100
图2b LCA蛋白在正常阑尾组织的淋巴细胞的胞膜呈阳性表达,PV法 ×100
图2c Calponin蛋白在乳腺肌上皮细胞的胞质呈阳性表达,PV法 ×200
图3a 宫颈上皮内瘤变组织内CK和 PCNA蛋白的共表达,CK定位于胞质,呈红色信号,而PCNA定位于胞核,呈绿色信号,紫外光激发,QDs-IHC法 ×200
图3b 宫颈上皮内瘤变组织内CK和 PCNA蛋白的共表达,蓝光激发,QDs-IHC法 ×1000
图3c 乳腺癌组织 Her-2和CK蛋白共表达的RGB原始图像,紫外光激发,QDs-IHC法 ×400
图3d 多光谱解混后 Her-2蛋白表达的信号呈绿色
图3e 多光谱解混后CK蛋白表达的信号呈红色
图3f 多光谱解混后 Her-2和CK蛋白共表达的信号
EXPLANATION OF FIGURES
Fig.1a p53 protein expression in the lung cancer tissues,which was located in the nuclei,positive signals showed red,blue light excitation,QDs-IHC method×100
Fig.1b Positive expression of LCA protein was located in the membrane of lymphocytes in the normal appendix tissues,blue light excitation,QDs-IHC method×100
Fig.1c Calponin protein expression in the myoepithelial cell of breast tissues,which was located in the cytoplasm,blue light excitation,QDs-IHC method×200
Fig.2a p53 protein expression in the lung cancer tissues,which was located in the nuclei,positive signals showed brown-yellow,PV method×100
Fig.2b Positive expression of LCA protein was located in the membrane of lymphocytes in the normal appendix tissues,PV method×100
Fig.2c Calponin protein expression in the myoepithelial cell of breast tissues,which was located in the cytoplasm,PV method×200
Fig.3a Co-expression of CK and PCNA proteins in the cervical intraepithelial neoplasia,CK protein located in the cytoplasm,manifested red signals,PCNA protein located in the nuceli,manifested green signals,ultraviolet light excitation,QDs-IHC method×200
Fig.3b Co-expression of CK and PCNA proteins in the cervical intraepithelial neoplasia,blue light excitation,QDs-IHC method×1000
Fig.3c RGB primary image of Her-2 and CK proteins co-expression in the breast cancer tissues,ultraviolet light excitation,QDs-IHC method×400
Fig.3d Green signal of Her-2 protein expression was observed by multispectral unmixing
Fig.3e Red signal of CK protein expression was observed by multispectral unmixing
Fig.3f Signal of Her-2 and CKprotein expression was detected by multispectral unmixing
Initialapplication of quantum dots immunofluorescence technology in pathological diagnosis
Zhu Xiaobo1,3,Huang Yanhua3,Peng Jun1,3,Gao Jun3,Li Beiyun3,Chen Honglei2*
(1W uhan Tumor N anometer Diagnosis Engineering Research Center;2Department.of Pathology,B asic Medical School of W uhan University,W uhan;3W uhan J iayuan Quantum dots Co.,L TD,W uhan430072,China)
Objective Quantum dots(QDs)immunofluorescence was compared with the immunoenzyme method in uccurately locating different proteins in paraffin embedded tissues,to detect co-expression of two different proteins.The initial application value of QDS was investigated by using it.Methods QDs immunofluorescence histochemistry(QDs-IHC)and immunoenzyme histochemistry were used to detect the expression of p53 protein in the lung cancer tissues,calponin protein in the myoepithelial cells of breast tissues,and LCA protein in the normal appendix tissues.Co-expression of CK and PCNA proteins in the human cervical intraepithelial neoplasia,Her-2 and CK proteins in the breast cancer tissues were simultaneously detected by QDs double-labeling immunofluorescence.Results Location of p53,LCA and calponin proteins was completely concordant through QDs-IHC and immunoenzyme histochemistry.Co-expression of CK and PCNA proteins in the cervical intraepithelial neoplasia,Her-2 and CK proteins in the breast cancer tissues were simultaneously observed by QDs double-labeling immunofluorescence combined with multispectral imaging.Conclusion The same application value was found between QDs-IHC and immunoenzyme histochemistry.Co-location of different proteins were simultaneously detected by QDs double-labeling immunofluorescence.
Quantum Dots; Immunofluorescence; Multiple labeling; Multispectral imaging
R392-3
A
10.3870/zgzzhx.2011.02.003
2010-07-10
2011-03-01
国家自然科学基金资助(30900652)
朱小波,男(1972年),汉族,工程师。
*通讯作者(To whom correspondence should be addressed)
