Rho GDI2与PI3K/Akt/mTOR信号通路在肺癌细胞中的相关性研究
2011-11-02牛慧彦王佳贺
牛慧彦 李 慧 王佳贺 张 萌 张 毅 何 平
(中国医科大学附属盛京医院老年病科,沈阳 110004)
Rho GDI2与PI3K/Akt/mTOR信号通路在肺癌细胞中的相关性研究
牛慧彦 李 慧 王佳贺 张 萌 张 毅 何 平*
(中国医科大学附属盛京医院老年病科,沈阳 110004)
目的 探讨肿瘤转移相关因子Rho GDI2与 PI3K/Akt/mTOR信号通路在肺癌侵袭转移过程中的作用及相关机制。方法 利用PI3K/Akt/mTOR信号通路上特异性的抑制剂,采用MTT法,伤口愈合实验及侵袭实验观察不同浓度药物对肺癌95D细胞生长侵袭转移能力的影响,通过Western Blot方法观察RhoGDI2蛋白水平的变化。结果 PI3K抑制剂L Y294002及mTOR抑制剂Rapamycin都能抑制肺癌细胞95D的侵袭转移能力,联合应用抑制作用更强。PI3K抑制剂L Y294002处理组RhoGDI2蛋白的表达量增加,且随浓度增加RhoGDI2蛋白表达也增加。mTOR抑制剂Rapamycin组,在低浓度时增加RhoGDI2蛋白的表达,但增大Rapamycin的浓度,RhoGDI2蛋白的表达反而降低。低浓度L Y294002组和Rapamycin组联合应用可以明显增加Rho GDI2蛋白的表达。结论 PI3K/Akt/mTOR信号通路中Akt的活化与RhoGDI2密切相关,RhoGDI2可能直接或间接通过与Akt的相互作用参与调节肺癌的侵袭转移的过程。
肺癌; RhoGDI2; PI3K/Akt/mTOR信号通路; 侵袭; 转移
肺癌是当今世界上严重威胁人类健康与生命的恶性肿瘤,每年有超过一百万的人死于肺癌。现在的治疗包括手术、放化疗等。化疗虽然改善非小细胞肺癌(NSCLC)病人的生存率,然而5年存活率仍较低。最近几年,已经有大量文献报道了磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号传导通路的异常与肿瘤生长,维持和化疗耐药等方面有关[1]。
Rho GDI2是最初在膀胱癌上确定的肿瘤转移抑制因子,其在肺癌侵袭转移中的作用及调控机制目前尚不明确。目前对Rho GDI2转移相关功能的研究主要聚焦在Rho/Rac在胞浆与浆膜的活性调节上。基于 PI3K/Akt/mTOR信号通路在肺癌侵袭转移中的作用,我们设想 RhoGDI2蛋白是否与PI3K/Akt/mTOR信号传导通路有关?因此我们利用PI3K/Akt/mTOR信号传导通路上特异性的抑制剂,通过Western Blot等方法来观察RhoGDI2蛋白水平的变化。
材料和方法
1.细胞系和主要试剂
人高转移大细胞肺癌细胞系95D购于中科院上海细胞研究所。兔抗人Rho GDI2抗体购自ABCAM公司,兔抗人 GAPDH抗体购自 Santa Cruz生物技术公司;蛋白 Marker购自 Promega公司;ECL试剂盒购自Amershma公司。PRMI-1640培养基、胎牛血清购于 Hyclone公司,胰蛋白酶购自Gibco公司;MTT液和二甲基亚砜(DMSO)购于Sigma公司。Rapamycin和 L Y294002购自 Sigma公司。Transwell趋化小室 (孔径 8.0μm)购于Costar公司;基质胶 Matrigel购于BD Biosciences公司。
2.实验方法
2.1 细胞培养和分组
人肺癌细胞系95D生长于含10%胎牛血清的RMPI-1640培养基中,内加 100U/ml青霉素、100μg/ml链霉素 ,置于 37 ℃、5%CO2、饱和湿度条件下培养,2-3 d传代一次。细胞呈贴壁生长。
L Y294002处理组:5μmol/L 组;20μmol/L 组;50μmol/L 组。
Rapamycin处理组:10nmol/L组;20 nmol/L组;40 nmol/L组
联合处理组:L Y 5μmol/L +R 10nmol/L组;L Y 10μmol/L+R 10nmol/L组
2.2 细胞增殖测定实验(MTT法)
采用MTT法,取对数生长期的95D细胞,调整悬液浓度为1×105/ml,每孔200μl接种于无菌的96孔培养板。实验组分别加入不同的处理因素,对照组不加药,另设空白对照孔。每组设3个平行孔。继续培养,48h后加入MTT(5g/L)20μl,放置孵箱内4h后弃上清加入150μl的二甲基亚砜(DMSO),震荡15min,用全自动酶标仪检测490nm处的各孔吸光光度值(OD值)。
经过四五年探索,检查预约中心涉及的检查项目涉及10个科室35个检查项目,包括胃镜、肠镜、支气管镜、CT、核磁共振、超声、PET/CT、ECT、动态心电图、动态血压等。
2.3 伤口愈合实验
生长旺盛的95D细胞以0.25%胰酶消化、培养液洗涤终止消化后,用含10%胎牛血清培养液配制1×106/ml的95D细胞悬液,按每孔2 ml加入6孔板,37℃、5%CO2培养24h,使细胞贴壁。吸弃孔中液体,PBS液冲洗1遍;用10μl枪头在孔中划一直线后,用PBS液再冲洗2次;加入含不同浓度处理组的含10%小牛血清培养液(2ml/孔),以等量无药培养液为对照,37℃、5%CO2继续培养每2h观察1次,直至划痕被细胞填满。同样的实验重复3次。
2.4 侵袭实验(Boyden小室法)
在24孔细胞培养板放入 Transwell小室,将10.4mg/ml的 Matrigel胶用 4℃培养液稀释(1∶3),在上室的聚碳酸酯膜上加入稀释后的Matrigel 60μl,置于37℃30min使Matrigel聚合成凝胶。制备单细胞悬液,在上室中每室加入4×105个细胞(200μl),下室中加入500μl含20%FBS的细胞培养液;每实验组设3个复孔,37 ℃、5%CO2恒温培养24h后,用棉签擦去基质胶和上层膜面细胞,穿过基底膜的细胞黏附于膜下层,无水乙醇固定30min,结晶紫染色5min,用蘸水棉签擦净上室,手术刀片小心裁下膜,以附有细胞的一面贴附于载玻片,膜干燥后滴加中性树胶封片镜检。200倍光镜下计数穿膜细胞,每膜计算5个视野,取均值。实验重复3次。
2.5 Western Blot
取2×105个细胞,加300μ1蛋白裂解缓冲液,反复吹吸,4℃静置 1h,低温高速离心 (4℃,13000r/m,30min),取上清。考马斯亮蓝法进行蛋白定量,每管 50μg蛋白分装。将裂解产物进行SDS-PAGE电泳后,转印至 PVDF膜,配制一抗稀释液 Rho GDI2(1∶200),GAPDH(1∶15000),将条带用 TTBS略加清洗后分别放入一抗稀释液中,摇床上室温杂交2h,辣根过氧化物酶(HRP)标记的二抗(1∶5000)摇床上室温杂交1h后,ECL法显色。实验结果用BIO-RAD凝胶电泳图像分析仪进行采图,Quantity One软件包分析。
3.统计学分析
用SPSS13.0统计包进行统计学分析,数据以均数±标准差表示,采用t检验;组间比较采用单因素方差分析;当 P<0.05时认为有统计学意义。
结 果
1.MTT法检测PI3K/Akt/mTOR信号通路上的抑制剂对肺癌细胞系95D生长的影响
PI3K抑制剂L Y294002抑制95D细胞的生长,随着浓度增加,抑制作用逐渐增加;mTOR抑制剂Rapamycin抑制95D细胞的生长,随着浓度增加,细胞破坏及细胞碎片增加,抑制作用也逐渐增加(见图1)。

图1 不同药物处理组对肺癌95D细胞增殖的影响Fig.1 MTT assays were performed on 95D cells in the presence of different PI3K/Akt/mTOR antagonists.
2.伤口愈合实验检测PI3K/Akt/mTOR信号通路上的抑制剂对肺癌细胞系95D迁移运动能力的影响
因为考虑到高浓度的 PI3K抑制剂L Y294002和mTOR抑制剂Rapamycin对细胞的生长有抑制作用,细胞增殖数量的减少必然延长细胞划痕愈合时间,所以我们仅选取了低浓度的 5μmol/L L Y294002组,与对照组相比,5μmol/L Y294002组可明显抑制95D细胞的迁移运动能力;10nmol/L组Rapamycin组与对照组相比,也可以明显抑制95D细胞的迁移运动能力。联合应用L Y294002和Rapamycin可以增强对95D细胞的迁移运动的抑制作用(见图2)。
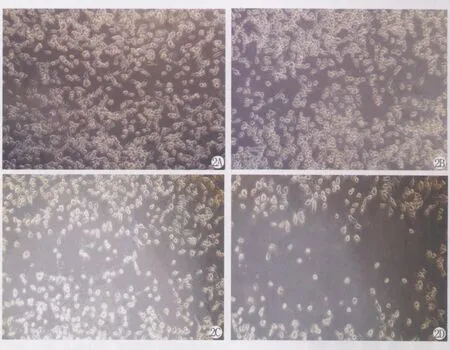
图2 倒置显微镜下观察不同处理组培养24h后95D细胞伤口愈合情况Fig.2 Wound healing assay was carried out with A. Untreated 95D cells;B.in the presence of 10nmol/L Rapamycin;C. in the presence of 5μmol/L L Y294002;and D. in the presence of 5μmol/L L Y294002+10nmol/L Rapamycin.
3.Boyden小室法检测 PI3K/Akt/mTOR信号通路上的抑制剂对肺癌细胞系95D侵袭能力的影响
与对照组比较,PI3K抑制剂L Y294002 5μmol/L组和mTOR抑制剂Rapamycin 10nmol/L组明显减弱肺癌细胞95D的侵袭能力,联合应用明显增强对侵袭能力的抑制。差异具有显著性意义(P<0.05)(见图 3)。
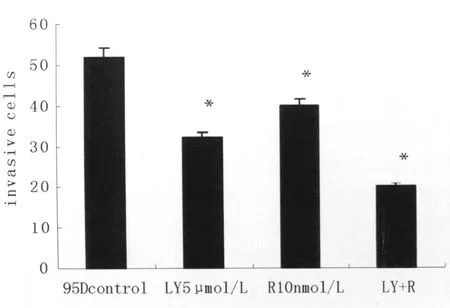
图3 不同处理组培养24h后侵袭细胞数Fig.3 Cell invasion assays were performed on 95D cells in the presence of different PI3K/Akt/mTOR antagonists.
4.不同干预因素对Rho GDI2蛋白表达的影响
PI3K抑制剂L Y294002增加Rho GDI2蛋白的表达,且随浓度增加 Rho GDI2蛋白表达增加。mTOR抑制剂Rapamycin,在低浓度时增加Rho GDI2蛋白的表达,但增大 Rapamycin的浓度,Rho GDI2蛋白的表达反而降低。低浓度L Y294002和Rapamycin联合应用可以明显增加Rho GDI2蛋白的表达(见图4)。
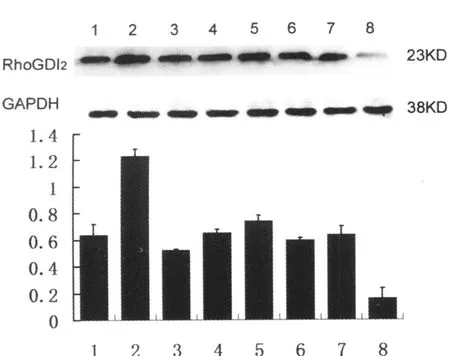
图4 PI3K/Akt/mTOR信号通路上抑制剂对RhoGDI2蛋白表达的影响1.L Y 5μmol/L+R 10nmol/L 组 ;2.L Y 10μmol/L+R 10nmol/L 组;3.L Y294002 5μmol/L 组 ;4.L Y294002 20μmol/L 组 ;5.L Y294002 50μmol/L 组;6.Rapamycin 10nmol/L 组;7.Rapamycin20nmol/L 组;8.Rapamycin 40nmol/L组Fig.4 Effects on RhoGDI2 expression in 95D treated with PI3K/Akt/mTOR antagonist. A. The expression levels of Rho GDI2 as examined via Western blot and B.charted results from A. 1. L Y294002(L Y)5μmol/L+Rapamycin(R)10 nmol/L;2. L Y 10μmol/L+R 10 nmol/L;3. L Y 5μmol/L;4. L Y 20μmol/L;5. L Y 50μmol/L;6. R 10 nmol/L;7. R 20 nmol/L;8. R 40 nmol/L.
讨 论
Rho GDI2作为与肿瘤转移相关因子,最初被认为是膀胱癌的[2,3]转移抑制基因。但是具体的调节机制和信号通路尚不清楚。随后的进一步研究又发现,Src蛋白可能与Rho GDI2蛋白相互作用以行使其调节膀胱癌细胞的转移抑制的功能[4-6]。但也有学者认为RhoGDI2不是转移抑制基因,而可能是癌基因,其表达促进肿瘤的生长,侵袭及转移。虽然Rho GDI2在肿瘤中的作用存在争议,但是在研究过程中得出的很多结果却很相似,如学者都提出Rho GDI2与 RacGTPase相结合而起作用,而 Rac作为分子开关在不同细胞类型和不同肿瘤环境中也起着双重作用,可以促进肿瘤生长或是起到抑制作用[7],一些学者认为这也许也是研究结论不同的原因之一,但是之间的确切关系仍然很不清楚。
Rho GDI2作为与肿瘤转移相关的因子,在肺癌细胞系,肺癌组织的具体作用机制,国内外研究较少。那么在肺癌中是否存在Rho GDI2的表达?它对肺癌细胞又会起到怎样的调节作用呢?我们在前期的工作中[8],结果表明Rho GDI2蛋白在大多数非小细胞肺癌组织中表达降低,且与组织分化和淋巴结转移有关;但是在肺癌细胞系中都有表达,表达水平不尽相一致。Rho GDI2在肺癌组织中表达量存在差异,在选用的肺癌细胞系中都有一定程度的表达,由此我们推想与Rho GDI2相关的下游信号通路,在肺癌侵袭转移过程中,可能被某种未知的可逆转的机制所阻断。因此在进一步研究中我们聚焦可能与 Rho GDI2进行“Cross Talk”并参与肺癌进程的信号通路。
Akt活化程度的增加见于恶变前和恶变的人类支气管上皮细胞,在正常细胞中没有表达,而且药物诱导凋亡的能力与 Akt活化水平的增加相关[9]。此外,在非小细胞肺癌(NSCLC)患者切除的肿瘤组织中,通过免疫组织化学方法可以分析检测到高水平Akt磷酸化表达,并可提示Akt的活化与疾病进展有关。我们利用 PI3K/Akt/mTOR信号传导通路上特异性的抑制剂,来观察Rho GDI2蛋白水平的变化。我们的研究发现PI3K抑制剂L Y294002增加Rho GDI2蛋白的表达,且随浓度增加 RhoGDI2蛋白表达增加;mTOR抑制剂 Rapamycin,在低浓度时增加Rho GDI2蛋白的表达,但增大Rapamycin的浓度,Rho GDI2蛋白的表达反而降低;低浓度L Y294002和 Rapamycin联合应用可以明显增加Rho GDI2蛋白的表达。
基于以上的研究,我们可以推论 PI3K/Akt/mTOR信号通路与Rho GDI2之间有潜在的相互作用。PI3K抑制剂L Y294002可以抑制Akt的磷酸化和活化,诱导肿瘤细胞凋亡,从而抑制肿瘤的生长和侵袭转移;对于 mTOR抑制剂 Rapamycin,其抑制下游S6K的活化从而抑制肿瘤的侵袭和转移。但是近年学者发现Rapamycin可以反馈性的活化Akt,其机制可能是 Rapamycin和它的具有相似作用的药物,仅能够抑制 mTOR-raptor复合体(TORC1)的活性,而对 mTOR-rictor复合体(TORC2)没有作用[10-12],TORC2能够使 Akt 473位丝氨酸磷酸化活化Akt[13]。因此,Rapamycin可能改变细胞内mTOR复合体的平衡状态,并且通过mTOR-rictor复合体的作用促进Akt的磷酸化;O’Reilly等人[14]的研究表明mTOR抑制剂诱导上游受体酪氨酸激酶信号通路,从而活化Akt。这也许就是 mTOR抑制剂 Rapamycin,在低浓度时增加Rho GDI2蛋白的表达,但增大 Rapamycin的浓度,Rho GDI2蛋白的表达反而降低的原因。
在研究中,我们利用PI3K/Akt/mTOR信号传导通路抑制剂,发现明显抑制Akt活化的因素则增强Rho GDI2蛋白的表达。PI3K/Akt/mTOR信号通路中Akt的活化与 Rho GDI2密切相关,Akt的活化与RhoGDI2蛋白的表达成负相关。Rho GDI2可能直接或间接通过与Akt的相互作用参与调节肺癌的侵袭转移的过程。
[1]Shaw RJ,Cantley LC.Ras,PI(3)K and mTOR signalling controls tumour cell growth.Nature,2006,441(70921):424-430
[2]Gildea JJ,Seraj MJ,Oxford G,et al.RhoGDI2 is an invasion and metastasis suppressor gene in human cancer.Cancer Res,2002,62(22):6418-6423
[3]Harding MA,Theodorescu D.RhoGDI2:a new metastasis suppressor gene:discovery and clinical translation.Urol Oncol,2007,25(5):401-406
[4]Wu Y,Moissoglu K,Wang H,et al.Src phosphorylation ofRhoGDI2 regulates its metastasis suppressor function.Proc Natl Acad Sci U S A,2009,106(14):5807-5812
[5]Moissoglu K,McRoberts KS,Meier JA,et al.Rho GDP dissociation inhibitor 2 suppresses metastasis via unconventional regulation of RhoGTPases.Cancer Res,2009,69(7):2838-2844
[6]Said N,Theodorescu D.Pathways of metastasis suppression in bladder cancer. Cancer Metastasis Rev,2009,28(3-4):327-333
[7]Sun D,Xu D,Zhang B.Rac signalling in tumorigenesis and as target for anticancer drug development.Drug Resist Updat,2006,9(6):274-287
[8]牛慧彦,王佳贺,徐灿,等.Rho GDI2在肺鳞癌、腺癌组织和肺癌细胞系中的表达及其临床意义.中国组织化学与细胞化学杂志,2010,19(1):32-37
[9]Chun KH,Kosmeder IIJW,Sun S,et al.Effects of deguelin on the phosphatidylinositol 3-kinase/Akt pathway and apoptosis in premalignant human bronchial epithelial cells.J Natl Cancer Inst,2003,95(4):291-302
[10]Hara K,Maruki Y,Long X,et al.Raptor,a binding partner of target of rapamycin(TOR),mediates TOR action.Cell,2002,110(2):177-189
[11]Kim DH,Sarbassov DD,Ali SM,et al.mTOR interacts with raptor to form a nutrient-sensitive complex that signals to the cell growth machinery.Cell,2002,110(2):163-175
[12]Sarbassov DD,Ali SM,Kim DH,et al.Rictor,a novel binding partner of mTOR,defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton.Curr Biol,2004,14(14):1296-1302
[13]Sarbassov DD,Guertin DA,Ali SM,et al.Phosphorylation and regulation ofAkt/PKB by the rictormTOR complex.Science,2005,307(5712):1098-1101
[14]Kathryn E.O’Reilly,Fredi Rojo,et al.mTOR Inhibition Induces Upstream Receptor Tyrosine Kinase Signalling and Activates Akt.Cancer Res,2006,66(3):1500-1508
R elationship betw een RhoG DI2 and PI3K/Akt/mTORsignalling pathw ay in lung cancer cells
Niu Huiyan,Li Hui,Wang Jiahe,Zhang Meng,Zhang Yi,He Ping*
(Department of Geriatrics,Shengjing Hospital,China Medical University,Shenyang110004,China)
Objective To investigate the effects of Rho GDI2 and PI3K/Akt/mTOR on invasion and metastasis of lung cancer,and the possible interplay between PI3K/Akt/mTOR pathway and RhoGDI2 signalling in 95D lung cancer cells.Methods Effects of PI3K/Akt/mTOR antagonists on 95D lung cancer cell growth,mobility and invasion were measured by MTT assay,wound healing assay and cell invasion assay. The expression of Rho GDI2 protein was detected by Western blot. Results Either or both PI3K/Akt/mTOR antagonists inhibited 95D lung cancer cell growth,invasion and metastasis.The expression of Rho GDI2 protein was decreased in the 30 ng/ml rhHGF group,while it was increased in L Y294002 groups and Rapamycin 10nmol/l and 20 nmol/l groups.The expression of Rho GDI2 protein was decreased in the Rapamycin 40nmol/l group.Combination of L Y294002 and Rapamycin increased Rho GDI2 expression significantly.Conclusion Rho GDI2 has a close relationship with the activation of Akt by the PI3K/Akt/mTOR signalling pathway.Rho GDI2 may be directly or indirectly involvd in the invasion and metastasis of lung cancer by its interaction with Akt.
Lung cancer; RhoGDI2; PI3K/Akt/mTOR signalling pathway; Invasion; Metastasis
R734.2
A
10.3870/zgzzhx.2011.02.001
2010-09-29
2011-03-18
辽宁省科技计划资助(2009225008-10)
牛慧彦,女(1977年),汉族,主治医师。
*通讯作者(To whom correspondence should be addressed)
