超高效液相色谱-串联质谱法分析测定食用植物油中痕量Δ9-四氢大麻酚
2011-10-28张爱芝王全林
张爱芝,王全林*
(宁波市产品质量监督检验研究院,浙江 宁波 315041)
超高效液相色谱-串联质谱法分析测定食用植物油中痕量Δ9-四氢大麻酚
张爱芝,王全林*
(宁波市产品质量监督检验研究院,浙江 宁波 315041)
以电喷雾离子源(ESI)为电离源,在负离子采集模式下建立食用植物油中Δ9四氢大麻酚(Δ9-THC)超高效液相色谱-质谱/质谱(UPLC-MS/MS)检测方法。实验以甲醇为提取剂,经中性氧化铝固相萃取柱净化、Waters ACQUITYTMUPLC BEH-C18(2.1mm×100mm,1.7μm)色谱柱分离后以UPLC-MS/MS多反应监测模式进行分析。方法检出限和定量限分别为0.15μg/kg和0.45μg/kg。实验以Δ9-氘代四氢大麻酚(Δ9-THC-D3)为内标物,采用内标法定量。3个添加水平,平均回收率为68.0%~110.0%,相对标准偏差为8.8%~18.1%。本方法能够满足食用植物油中Δ9-四氢大麻酚痕量检测的要求。
食用植物油;Δ9-四氢大麻酚;超高效液相色谱-质谱/质谱;负离子模式
Δ9-四氢大麻酚(delta 9-tetrahydrocannabinol,Δ9-THC),主要来源于大麻,是精神活性物质,对中枢神经有明显作用,并可产生依赖成瘾性。高含量的THC相关的物质在全球范围内被定性为毒品。我国纤用大麻种植面积高达成千上万亩,作为副产物,大麻籽经常被用来榨油,但由于大麻籽油中含有四氢大麻酚,我国食用植物油标准体系[1]将大麻油列为非食用油的范畴,并禁止将其掺杂到其他食用油中。然而,为了追求经济利益,未经处理、含有四氢大麻酚的大麻仁油会被不法的生产商掺入食用植物油中。食用植物油卫生标准[2]鉴别食用植物油中是否掺杂有大麻油的标准方法是以Δ9-四氢大麻酚为特征指标,采用薄层色谱法进行分析检测。薄层色谱法操作繁琐,并且胡麻油、芝麻油和牢固蓝盐B会干扰测定,容易出现假阳性,给食品安全监管造成困难。因此,开发灵敏、可靠的测定食用植物油中Δ9-THC的检测技术,对于保障人民身体健康具有重要意义。
目前,国内外有关Δ9-THC检测方法的研究主要集中在毒品吸食者、试验动物的血液、尿液、唾液等生物样品[3-10]。大麻籽及其油品中Δ9-THC检测方法研究报道的主要有气相色谱及液相色谱法[11-14]。然而,因掺杂了大麻油的食用植物油中Δ9-THC含量相对较低,这些方法难以满足测定灵敏度的要求。本实验建立食用植物油中分析测定Δ9-THC的超高效液相色谱串联质谱法,该法操作简便、分析时间短、检出限低,可用于掺杂有大麻籽油的食用植物油中Δ9-THC的检测。
1 材料与方法
1.1 材料、试剂与仪器
大豆油 上海市购。
甲醇(色谱纯) 德国Merck公司;实验用水均为超纯水(Millipore公司超纯水器制备,电阻率为18.2MΩ·cm)。Δ9-四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC,1.0mg/mL)标准品 中国药品生物制品检定所;氘代四氢大麻酚(Δ9-THC-D3,100μg/mL) 美国Cerilliant公司。
标准工作溶液的配制:以体积分数87%的甲醇溶液配制Δ9-四氢大麻酚标准工作溶液,每一标准工作溶液中内标物Δ9-氘代四氢大麻酚质量浓度均为10ng/mL。
ACQUITYTM超高效液相色谱仪、Quattro Premier XE质谱仪 美国Waters公司;超声波清洗器 宁波海曙超声仪器公司;TG16-WS 高速离心机 上海卢湘仪离心机仪器有限公司;SC-8L-150数控固相萃取仪 广州智真生物科技有限公司;氮吹仪 上海安谱仪器公司。SupelcleanTMLC-Alumina-N 固相萃取柱(1g/3mL) 美国Supelco公司。
1.2 UPLC-MS/MS分析条件
超高效液相色谱条件 色谱柱:Waters ACQUITYTMUPLC BEH C18柱(2.1mm×100mm,1.7μm);柱温:40℃;样品温度:20℃;进样体积:10μL。流动相A为水,流动相B为甲醇,实验采用87% B-13% A等度洗脱。
质谱条件:离子源:电喷雾电离(ESI-);毛细管电压:3.50kV;射频透镜1(RFlens 1)和射频透镜2(RF lens 2)的电压分别为15.0V和13.0V;离子源温度:110℃;脱溶剂温度:350℃;脱溶剂气流量:600L/h。采用MRM监测模式,优化采集参数见表1,带下划线的离子为定量离子。

表1 Δ9-THC和Δ9-THC-D3的质谱采集参数Table 1 MS parameters for THC and THC-D3
1.3 试样前处理
称取1.00g食用植物油,准确至0.01g,置于10mL具塞塑料离心管中,加入50μL质量浓度为1μg/mL的Δ9-THC-D3大麻酚标准溶液(用于加标回收实验的样品,加入一定量的标液),5mL甲醇,超声提取10min,8000r/min离心3min,吸取上清液于50mL小烧杯中,提取过程重复3次,在不高于40℃条件下N2吹至约0.5mL。5mL石油醚溶解,待净化。
SupelcleanTMLC-Alumina-N固相萃取柱(Supelco 1g/3mL)以3mL石油醚活化平衡。将小烧杯中的试液全部上柱并接收上柱液,而后石油醚洗脱,共接收石油醚40mL,洗脱液于40℃条件N2吹干。加入5mL体积分数87%的甲醇溶液,超声溶解30s,过0.2μm滤膜,上机分析。
1.4 测定
定性需满足:1)空白样品中不出现与阳性对照相同的离子峰;2)特征离子色谱峰的信噪比(RSN)都在3:1以上;3)试样色谱峰的保留时间,应与校正溶液的相对保留时间一致,容许偏差为±2.5%;4)检测到的离子的相对丰度与校正溶液的相对丰度一致,容许偏差满足2002/657/EC中的要求。本实验采用内标法定量。
2 结果与分析
2.1 样品前处理条件的确定
长期以来,我国对于养老服务机构的认识局限于只能是非营利性,非企业性,政策支持上自然也仅限于此。虽然近年我国开始转变观念,政策上允许并鼓励支持营利性养老服务机构的建设和发展,但许多职能部门的观念并没有及时调整和转变过来,从而造成国家与地方之间、部门与部门之间在政策上、做法上还有许多的不统一,某些基层部门常以上级部门还未发文为由延缓或阻碍政策的执行,一定程度上阻碍了营利性养老服务机构的建设与发展。
2.1.1 提取剂的确定
Δ9-THC的提取多采用甲醇和乙腈为提取剂[3,13,15-17],实验考察两种提取剂对目标物提取效果的影响,结果发现无论采用哪种提取剂,都存在一定的基质干扰,以基质匹配单点法定量,两者提取效果无明显差异。实验选用甲醇为提取剂。
2.1.2 提取方法的确定
已见报道的Δ9-四氢大麻酚检测的提取方法主要有4种:取少量样品直接以甲醇溶解后进行分析[15]、传统液液萃取[16]、超声波萃取[13]、碱性水解后再进行提取[17]等方法。比较了各提取方式对回收率的影响。直接溶解分析方法检出限较高,不能满足痕量残留检测的需要;分液漏斗进行液液萃取回收率较低,且需大量有机溶剂;碱性水解后再进行提取方法操作繁琐且过程中会有部分Δ9-四氢大麻酚分解损失;比较而言,超声波萃取方法简单且回收率较高,因而本实验选用超声波提取方式进行。
2.1.3 固相萃取净化柱的选择
痕量或残留分析中,采取固相萃取技术对分析液进行净化已成为分析者普遍采用的技术。已见报道的分析测定四氢大麻酚文献中采用的固相萃取净化小柱有C18[3]、Bond Elute Certify Ⅱ[18]及 LC-Alumina-N[12]。实验研究了Δ9-THC在3种柱子上的保留行为,发现Δ9-THC在 C18及LC-Alumina-N柱上的保留较强,在CertifyⅡ柱上的保留相对较弱。考察了3种固相萃取小柱对分析液净化效果的影响(以分析液中Δ9-THC响应强度衡量),由图1可以看出,LC-Alumina-N 固相萃取小柱的净化效果较好。

图1 不同固相萃取小柱净化效果图Fig.1 Clean-up efficiency of different SPE columns
2.1.4 LC-Alumina-N过柱条件的优化
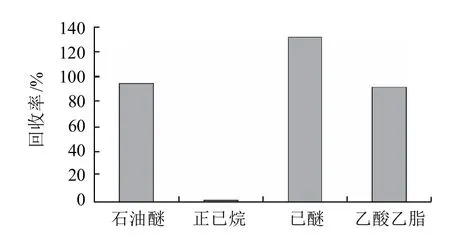
图2 不同洗脱剂对Δ9-THC回收率的影响Fig.2 Effect of eluent on recovery rate of THC
2.2 超高效液相色谱-质谱条件的优化
2.2.1 电离模式的选择
从Δ9-THC的分子结构来看,结构本身既含有酚羟基又在环结构中含有氧,这表明Δ9-THC可能既可以采用正离子电离模式也适合采用负离子采集模式进行分析,但目前基本上所有有关分析测定Δ9-四氢大麻酚的文献都是采用正离子采集模式进行分析的[4,10]。实验详细考察两种电离模式对目标化合物灵敏度的影响。在甲醇-水流动相体系下,实验同时采用正离子模式及负离子模式对Δ9-四氢大麻酚进行了采集,发现用负离子模式进行采集,Δ9-四氢大麻酚母离子较稳定且响应强度较高,因而实验选用负离子电离模式。
2.2.2 流动相的选择与优化
流动相的组成不仅会影响到目标化合物的保留时间和峰形,最重要的是还会影响到目标化合物的离子化效率,从而最终影响灵敏度。液质联用采用的流动相的基础体系是甲醇-水及乙腈-水体系。为提高离子化效率,在采用负离子电离模式时通常选用乙腈-水体系。实验考察两种流动相体系对目标化合物响应灵敏度的影响,发现在两种流动相体系下目标物的响应强度相差不大,实验采用以甲醇-水作为流动相并详细优化了洗脱梯度,结果表明用体积分数87%的甲醇溶液等度洗脱时,5min内即可完成对Δ9-四氢大麻酚的分析测定。图3是在选定的实验条件下,同一标准溶液连续进样6次Δ9-四氢大麻酚和Δ9-氘代四氢大麻酚的总离子流图叠加图,6次的变异系数为3.3%,表明在优化条件下,测定方法稳定。图4是Δ9-四氢大麻酚和氘代四氢大麻酚标准溶液的MRM色谱图。依据选定的实验方法,测试阴性空白大豆食用油样品提取测试液(图5,图中箭头标示的出峰位)和阴性加标样品提取测试液(图6,加标2.0μg/kg)中目标物的MRM色谱图。可以看出,Δ9-四氢大麻酚在实际样品测定中不受复杂的样品基质的干扰。

图3 Δ9-四氢大麻酚和Δ9-氘代四氢大麻酚的总离子流图叠加图(n=6)Fig.3 Stability of the developed method (n=6)

图4 标准溶液MRM色谱图Fig.4 MRM chromatograms of standard solutions of THC-D3 and THC

图5 空白样品MRM色谱图Fig.5 MRM chromatogram of blank sample

图6 加标样品的色谱图Fig.6 Chromatogram of the spiked sample with THC at the concentration of 2.0μg/kg
2.3 检出限、定量限
采用向阴性样品中逐级降低加标浓度的方法来确定检出限(LOD)和定量限(LOQ)。以3倍信噪比(RSN=3)对应的目标物浓度作为检出限,以10倍信噪比(RSN=10)对应的目标物浓度作为定量限,得到Δ9-THC的方法检出限和定量限分别为0.15μg/kg 和0.45μg/kg。
2.4 校准曲线、回收率及精密度
配制Δ9-THC质量浓度为0.5~40.0μg/L的系列标准溶液,内标物Δ9-THC-D3质量浓度恒定为10μg/L以Δ9-THC的定量离子色谱峰面积与Δ9-THC-D3的定量离子色谱峰面积之比(Y)为纵坐标、分析物标准溶液浓度(X)为横坐标做标准曲线,标准曲线为Y=0.109564X+0.00935539,R2=0.996581,大于0.99,截据斜率之比小于0.1,表明Δ9-THC在质量浓度0.5~40.0μg/L内具有较好的线性关系,且无背景干扰。
添加水平为0.50、2.00μg/kg及10.00μg/kg时的回收率及精密度见表2。由数据可以看出,Δ9-THC在3种加标水平下平均回收率为68.0%~110.0%,相对标准偏差为8.8%~18.1%,能够满足残留检测需要。
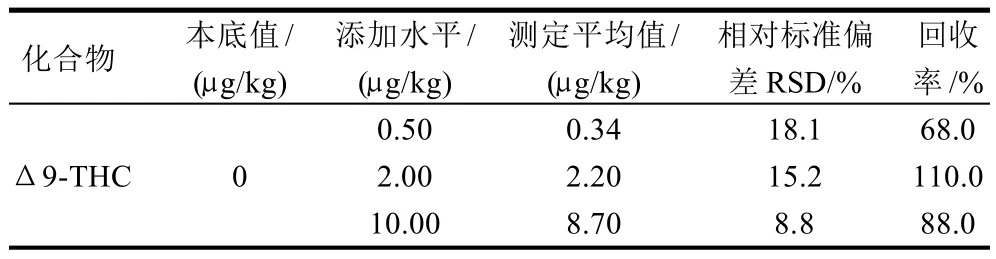
表2 不同添加水平下THC的加标回收率、相对标准偏差(n=6)Table 2 Average recovery rate and relative standard errors of THC at different spiked levels (n=6)
3 结 论
本实验建立了UPLC-MS/MS法测定食用植物油中痕量Δ9-THC的分析方法。实验系统考察了提取剂、提取方法、净化方法对测定结果的影响,确定了甲醇超声提取、中性氧化铝固相萃取小柱净化富集的前处理方法;详细优化超高效液相色谱-质谱/质谱(UPLC-MSMS)法的仪器条件,比较了正、负电离模式对Δ9-THC响应灵敏度的影响,在负离子采集模式下以多反应检测模式进行分析;在3个添加水平下对食用植物油中的Δ9-THC进行检测,以内标法定量,平均回收率为68.0%~110.0%。本方法操作简便、分析时间短、检出限低,有一定的实际应用价值。
[1] GB/T 2716—2005 食用植物油卫生标准[S].
[2] GB/T 5009.37—2003 食用植物油卫生标准的分析方法[S].
[3] MANNILA J, LEHTONEN M, JARVINEN T, et al. Determination of Δ9-tetrahydrocannabinol from rabbit plasma by gas chromatographymass spectrometryusing two ionization techniques[J]. J Chromatogr A,2004, 810(2): 283-290.
[4] MARALIKOVA B, WEINMANN W. Simultaneous determination of Δ9-tetrahydrocannabinol, 11-hydroxy-Δ9-tetrahydrocannabinol and 11-nor-9-carboxy-Δ9-tetrahydrocannabinol in human plasma by high-performance liquid chromatography/tandem mass spectrometry[J]. J Mass Spectrom, 2004, 39(5): 526-531.
[5] ABRAHAM T T, LOWE R H, PIRNAY S O, et al. Simultaneous GCEI-MS determination ofΔ9-tetrahydrocannabinol, 11-hydroxy-Δ9-tetrahydrocannabinol, and 11-nor-9-carboxy-Δ9-tetrahydrocannabinol in human urine following tandem enzyme-alkaline hydrolysis[J]. J Anal Toxicol, 2007, 31(8): 477-485.
[6] 汪聪慧, 徐建中, 谷翠红, 等. 头发中滥用药物的检测(三)四氢大麻酚[J]. 质谱学报, 1997, 18(3): 7-12.
[7] 向平, 沈敏, 沈保华, 等. GC/MS同时分析头发中大麻酚类和Δ9-四氢大麻酸[J]. 法医学杂志, 2002, 18(4): 216-219.
[8] 吴筠, 吴侔天. 11-羟基-Δ9-四氢大麻酚二酸的定量分析[J]. 中国运动医学杂志, 2004, 23(1): 101-103.
[9] 杨瑞琴. 液相色谱-大气压化学电离质谱法分析小鼠全血和脑组织中的大麻酚[J]. 中国人民公安大学学报: 自然科学版, 2006, 48(2): 9-10.
[10] TEIXEIRA H, VERSTRAETE A, PROEN A P et al. Validated method for the simultaneous determination ofΔ9-THC and Δ9-THC-COOH in oral fluid, urine and whole blood using solid-phase extraction and liquid chromatography-mass spectrometry with electrospray ionization[J]. Forensic Sci Int, 2007, 170(2/3): 148-155.
[11] GAMBARO V, DELL'ACQUA L, FARE F, et al. Determination of primary active constituents in Cannabis preparations by high-resolution gas chromatography/flame ionization detection and high-performance liquid chromatography/UV detection[J]. Anal Chim Acta, 2002, 46(2):245-254.
[12] 张晓京, 陆峰, 马丽娟. 用气相色谱法分析大麻籽油中的Δ9-四氢大麻酚[J]. 宁夏大学学报: 自然科学版, 2004, 25(3): 253-254.
[13] 张岗, 郭江宁, 毕开顺. 高效液相色谱法测定火麻仁油中Δ9-四氢大麻酚的含量[J]. 沈阳药科大学学报, 2003, 20(4): 269-271.
[14] 许庆琴, 杜黎明, 曹玺珉. 气相色谱法同时测定大麻、海洛因和鸦片中的8种组分[J].分析化学, 2003, 31(8): 961-964.
[15] ZOLLER O, RHYN P, ZIMMERLI B. High-performance liquid chromatographic determination ofΔ9-tetrahydrocannabinol and the corresponding acid in hemp containing foods with special regard to the fluorescence properties of Δ9-tetrahydrocannabinol[J]. J Chromatogr A,2000, 872(1/2): 101-110.
[16] YOTORIYAMA M, ISHIHARAJIMA E, KATO Y, et al. Identification and determination of cannabinoida in both commercially available and cannabis oils[J]. J Health Sci, 2005, 51(4): 483-487.
[17] Industrial Hemp Technical Manual. Health Canada, Effective as of :March 12, 1998 Standard operating procedures for sampling,testing and processing methodology[S].
[18] SU H L, FENG L I, JEN H P, et al. Using sweeping micellar electrokinetic chromatography to analyzeΔ9-tetrahydrocannabinol and its major metabolites[J]. J Chromatogr A, 2009, 1216(16): 3512-3517.
Determination of THC in Edible Vegetable Oil by Ultra-high Performance Liquid Chrmatography-Electrospray Tandem Mass Spectrometry
ZHANG Ai-zhi,WANG Quan-lin*
(Ningbo Academy of Product Quality Supervision and Inspection, Ningbo 315041, China)
A determination method for Δ9-tetrahydrocannabinol (THC) in edible vegetable oil was developed on the basis of ultra-high performance liquid chrmatography-electrospray tandem mass spectrometry (UPLC-MS/MS) under negative ion mode using electrospray ionization (ESI) source. THC was extracted with methanol and then purified by LC-alumina-N solid phase extraction column. Qualitative and quantitative analysis were carried out for the analyte under a MRM mode after THC was separated on Waters ACQUITY UPLCTMBEH C18 (1.7 μm, 2.1 mm×100 mm) column. The limit of detection (LOD) of the developed method was 0.15 μ g/kg and the limit of quantification (LOQ) was 0.45 μ g/kg for THC. Quantitative analysis was corrected by internal standard method using delta 9-THC-D3 as internal standard. Average recovery rate of THC varied from 68.0%-110.0% with relative standard deviation ranging from 8.8%-18.1% at three spiked levels. Therefore, the developed method meets the requirements for the determination of THC in edible vegetable oil.
edible vegetable oil;Δ9-Tetrahydrocannabinol;ultra-high performance liquid chromatography-electrospray tandem mass spectrometry (UPLC-MS/MS);negative ion mode
TS201;O657
A
1002-6630(2011)10-0194-05
2010-07-21
浙江省质检系统科研计划项目(20080228)
张爱芝(1981—),女,硕士,主要从事食品安全检测技术研究。E-mail:zhangaizhi1981@163.com
*通信作者:王全林(1962—),男,教授级高级工程师,博士,主要从事食品安全检测技术及标准化研究。E-mail:quanlinwang@163.com
