甘肃河西沙区锁阳多糖提取工艺优化及含量测定
2011-10-28罗光宏祖廷勋陈天仁
罗光宏,王 勤*,祖廷勋,陈天仁
(1.河西学院凯源生物技术开发中心,甘肃省微藻工程技术研究中心,甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000;2.甘肃省张掖市药品检验所,甘肃 张掖 734000)
甘肃河西沙区锁阳多糖提取工艺优化及含量测定
罗光宏1,王 勤2,*,祖廷勋1,陈天仁1
(1.河西学院凯源生物技术开发中心,甘肃省微藻工程技术研究中心,甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000;2.甘肃省张掖市药品检验所,甘肃 张掖 734000)
采用水提醇沉法,利用L9(33)正交试验优选锁阳多糖的提取工艺,用硫酸苯酚比色法对甘肃河西沙区不同地区锁阳中多糖含量进行测定。结果表明:提取最佳工艺条件为料液比1:15(g/mL)、提取时间90min、提取次数为2次;甘肃河西沙区不同地区锁阳多糖含量差别显著。锁阳多糖可作为控制锁阳质量的一项指标性成分。
锁阳;多糖;正交试验;提取工艺;含量测定
锁阳(Cynomorium songaricum Rupr.)俗称“不老药”,又名铁棒槌、锈铁棒、地毛球、羊锁不拉、乌兰高腰(蒙语),为锁阳科锁阳属多年生肉质寄生草本植物,多寄生于蒺藜科(Zygophyllaceae)白刺属(Nityaria L.)植物根部,为全寄生种子植物[1]。主要分布于土壤缺乏有机质而富含盐分的荒漠沙区地带,主产于甘肃、新疆、青海、宁夏、内蒙古等地,其中尤其以甘肃河西走廊地区分布最广[2]。现代药理学研究证明,锁阳具有促进性功能和肾功能;耐缺氧、抗应激、抗疲劳作用;清除体内自由基、抗氧化、抗衰老作用;抑制血小板聚集;调节免疫系统;润肠通便作用;抗癌及抑制艾滋病病毒增殖的等作用[3-9]。 锁阳中含有的主要有效成分有以儿茶素为代表的黄酮类、原儿茶酸为代表的有机酸类、熊果酸为代表的三萜类、多糖与鞣质等化合物[10-14]。其中,锁阳多糖具有防癌、抗癌、提高机体免疫力、延缓衰老等作用,并对心血管系统有强心、降压、保护心肌、抑制血栓形成和降血脂作用[15-17]。近年来,锁阳的保健价值已被广泛重视,并成为保健食品和药品的新原料,具有一定开发潜力[18]。
本实验以锁阳多糖含量为考察指标,采用L9(33)正交试验法优选锁阳多糖的提取工艺,确定最佳提取条件,并对不同地区锁阳中多糖含量进行测定。通过研究认为可以将多糖作为控制锁阳药材质量的指标性成分,为锁阳优质药材的选择和综合开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
锁阳原料采自或购于甘肃河西走廊各地,由兰州大学药学院马志刚教授鉴定为Cynomorium songaricum Rupr.。
D-葡萄糖对照品(批号:110833-200904) 中国药品生物制品检定所,供含量测定用,含量以100%计(置五氧化二磷减压干燥器中干燥12h以上使用);苯酚(AR)宜兴市化学试剂厂有限公司;硫酸(AR) 西安化学试剂厂;无水乙醇(AR) 天津市天新精细化工开发中心;乙醇(AR) 天津市化学试剂二厂;乙醚(AR) 天津市百世化工有限公司;丙酮(AR) 西安市福晨化学试剂有限公司;五氧化二磷(AR) 天津市大茂化学试剂厂;实验用水为超纯水,由纯水发生器制得。
1.2 仪器与设备
U-3900H型紫外-可见分光光度计 日本岛津公司;Metler-D2025型十万分之一电子天平 梅特勒仪器上海公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;SHB-Ⅲ型水循环式多用真空泵 郑州长城科工贸有限公司;101-1A型电热鼓风干燥箱 北京科伟永兴仪器有限公司;DZF-6020型真空干燥箱 上海精宏实验设备有限公司;HHS-24型电热恒温水浴锅 江苏大地自动化仪器厂;PTHW型电热套 巩义市英峪予华仪器厂;信强牌多功能高速粉碎机 上海广沙工贸有限公司;SB2200-T型超声波提取器(输入功率90W) 上海必能信超声有限公司;UPS-Ⅱ型优普UPS系列纯水系统 成都超纯科技有限公司。
1.3 方法
1.3.1 锁阳多糖样品的提取制备
将采集的锁阳材料分别清洗干净,切块,自然晾干,粉碎成粗粉,备用。具体方法是取锁阳粗粉9份,每份约20g,分别用乙醇100mL回流提取2次,每次2h,除去单糖、低聚糖及苷类等干扰性成分后,残渣按正交试验方案提取,水提液浓缩至约30mL,加入乙醇,使含醇量达到80%,冰箱中放置过夜后离心,沉淀分别用无水乙醇、乙醚、丙酮依次洗涤,50℃减压烘干,作为正交试验样品。
1.3.2 锁阳多糖提取的单因素试验
1.3.2.1 料液比对提取效果的影响
料液比分别为1:5、1:10、1:15、1:20、1:25(g/mL),按照提取制备方法提取2次,每次90min,测定其多糖得率(mg/g)。
1.3.2.2 提取时间对提取效果的影响
在料液比为1:15(g/mL)的提取条件下,分别提取30、60、90、120、150min,分别提取2次,合并提取液,测定其多糖得率/(mg/g)。
1.3.2.3 提取次数对提取效果的影响
分别在料液比为1:15,每次90min的提取条件下进行1、2、3、4、5次提取,合并提取液,测定其多糖得率(mg/g)。
1.3.3 锁阳多糖提取工艺的正交试验设计
采用硫酸苯酚比色法[19-20]。试验以溶液吸光度为指标,选择对提取率影响较大的3个因素料液比、提取时间、提取次数做正交试验。以锁阳多糖得率(mg/g)为评价指标,通过正交试验优选锁阳多糖的最佳提取条件。选取料液比、提取时间、提取次数作为考察因素,采用L9(33)正交表进行试验,见表1。
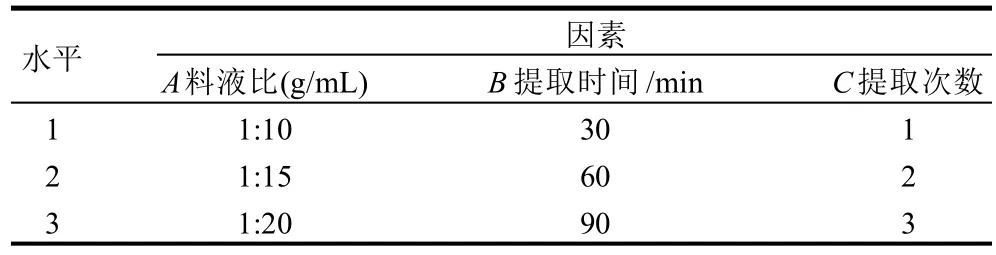
表1 锁阳多糖提取工艺正交试验因素水平表Table 1 Factors and levels in orthogonal array design
1.3.4 供试样品溶液的制备
按1.3.5节方法分别测定正交试验样品中多糖得率,确定最佳提取工艺,按照最佳提取工艺方法分别提取供试样品。精密称取锁阳多糖供试样品约20mg于50mL量瓶中,加水溶解并稀释至刻度,摇匀,即得供试样品溶液。
1.3.5 标准曲线的绘制[21-22]
取置五氧化二磷减压干燥器中干燥12h的D-葡萄糖49.36mg,精密称定,置100mL容量瓶中,加水溶解并稀释至刻度,摇匀,作为对照品溶液(每1mL含D-葡萄糖0.4936mg)。精密量取上述对照品溶液0.0、1.0、2.0、3.0、4.0、5.0mL和7.0mL,分别置于25mL量瓶中,加水稀释至刻度,摇匀。分别精密量取上述溶液各2mL,分别加入5%苯酚溶液1.0mL,摇匀,迅速加入7.0mL浓硫酸,摇匀后放置5min,水浴加热30min,取出,冰水浴中冷却至室温,选择中间质量浓度的溶液于450~550nm的波长范围进行扫描,确定标准品经硫酸苯酚法显色后产物的最大特征吸收波长。并在该波长处测定不同浓度标准溶液经硫酸苯酚法显色后产物的吸光度,每个质量浓度梯度平行测定3次,绘制标准曲线。
1.3.6 锁阳中多糖得率计算
采用硫酸苯酚比色法,分别精密量取供试样品溶液2mL,测定锁阳供试样品溶液经硫酸苯酚法显色后产物的吸光度,将结果代入回归方程中,计算多糖得率。锁阳中多糖得率为锁阳粗粉中多糖的质量分数,即1g锁阳中所含多糖的质量/mg,计算公式:

2 结果与分析
2.1 最大吸收波长的确定
按照文献方法[18]于450~550nm的波长范围进行扫描,确定D-葡萄糖对照品经硫酸苯酚法显色后产物的最大特征吸收波长为486nm,结果见图1。本实验以此为标准吸光度来确定锁阳多糖得率。
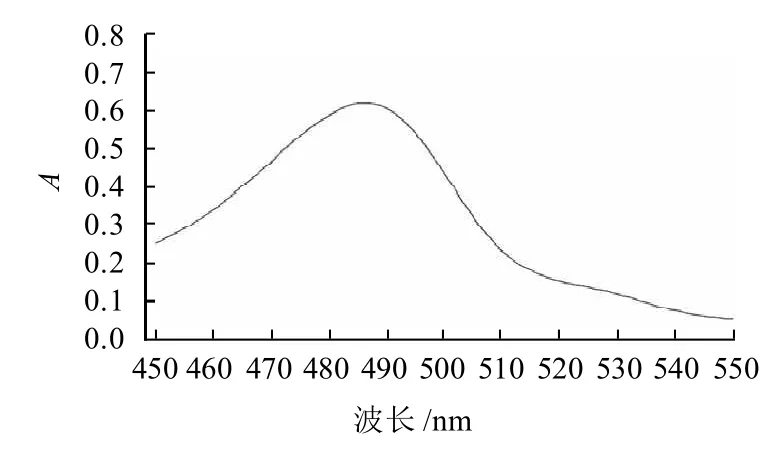
图1 D-葡萄糖的吸收光谱曲线Fig.1 UV absorption spectrum of D-glucose
2.2 测定锁阳多糖得率的标准曲线方程

图2 D-葡萄糖标准曲线Fig.2 Standard curve of D-glucose
D-葡萄糖对照品经硫酸苯酚法显色后产物的最大特征吸收波长为486nm。以对照品质量浓度/(μg/mL)为横坐标、吸光度(A)为纵坐标进行线性回归,D-葡萄糖的回归方程为:Y=0.0553X+0.0232,r=0.9985。结果表明,D-葡萄糖对照品质量浓度在3.95~27.64μg/mL时,与吸收度具有良好的线性关系,结果见图2。
2.3 单因素试验
2.3.1 料液比对锁阳多糖得率的影响
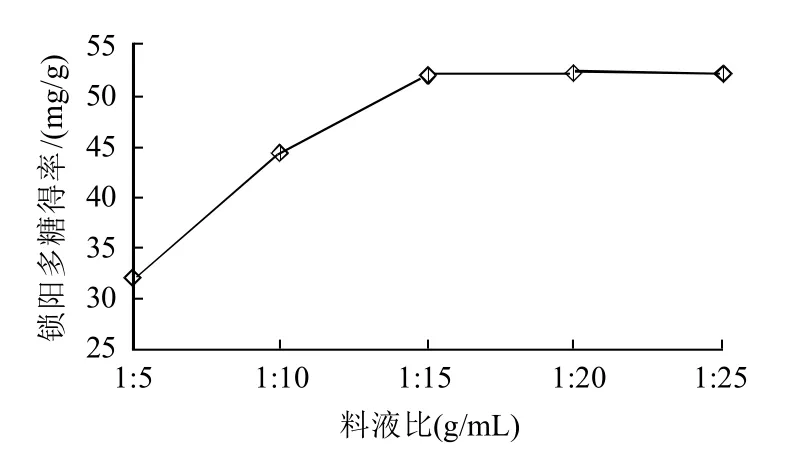
图3 料液比对锁阳多糖得率的影响Fig.3 Effect of material/liquid ratio on extraction rate of polysaccharides
如图3所示,采用不同料液比进行提取,多糖提取得率有差别,料液比实际上是溶剂的用量大小,一般溶剂的用量越大提取得率也越大,但是过多的溶剂用量会造成溶剂和能源的浪费,综合考虑,选择1:10~1:20(g/mL)料液比作为操作条件。
2.3.2 提取时间对锁阳多糖得率的影响

图4 提取时间对锁阳多糖得率的影响Fig.4 Effect of time on extraction rate of polysaccharides
如图4所示,锁阳多糖得率随时间的延长而升高,达到90min时得率最高,然后随提取时间的延长略呈下降趋势。时间的延长,有助于传质过程,使分子充分扩散,有利于多糖物质的溶出;但随着提取时间的延长,也可能导致部分多糖物质的分解或部分其他物质的溶解而使锁阳多糖得率下降。所以选择30~90min作为提取操作条件。
2.3.3 提取次数对锁阳多糖得率的影响

图5 提取次数对锁阳多糖得率的影响Fig.5 Effect of repeated extraction number on extraction rate of polysaccharides
如图5所示,采用不同提取次数进行提取时多糖提取得率有差别,一般提取得率随提取次数增加而升高,为节约溶剂和能源,综合考虑,选择1~3次作为提取操作条件。
2.4 正交试验及方差分析
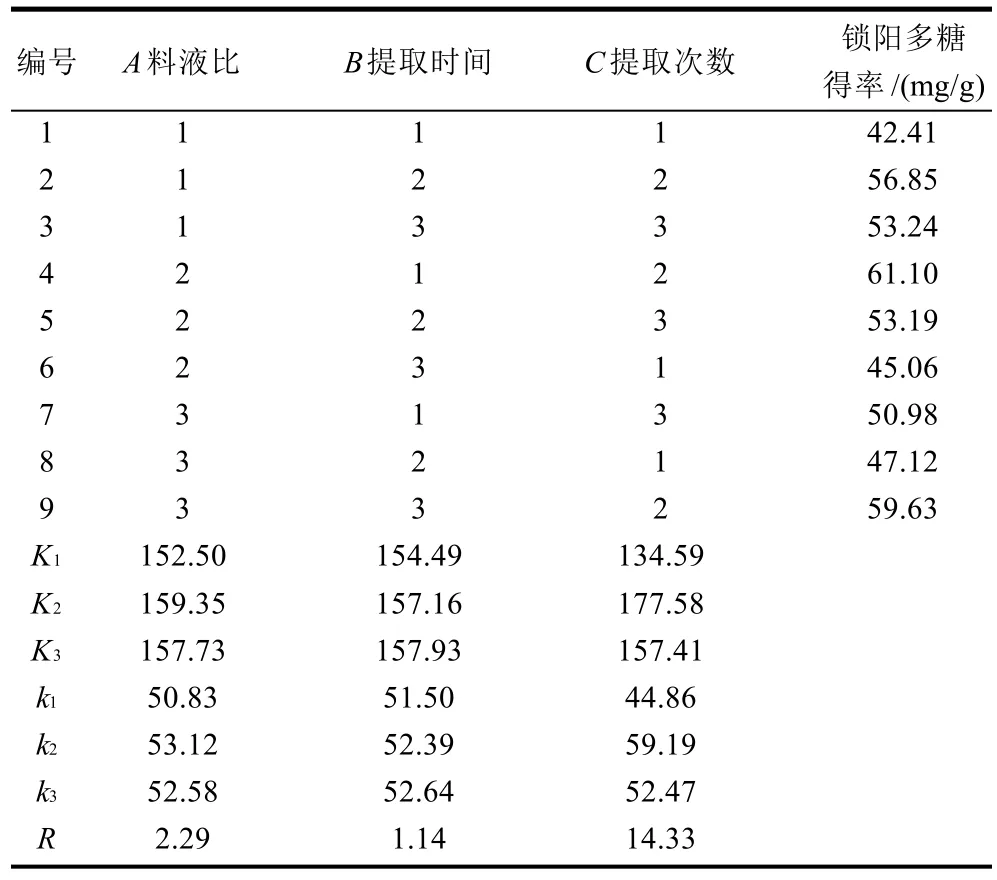
表2 锁阳多糖提取正交试验设计及结果Table 2 Orthogonal array design matrix and corresponding experimental results

表3 方差分析表Table 3 Variance analysis for extraction rate of polysaccharides with various extraction conditions
采用正交试验优化锁阳多糖提取工艺的结果见表2,方差分析结果见表3[23]。由表2和表3极差分析结果表明,A、B、C三个因素对锁阳多糖提取影响的主次关系为:提取次数>料液比>提取时间。提取次数、料液比和提取时间对锁阳多糖的提取效率都有一定影响,提取的最佳工艺为A2B3C2,即料液比1:15、提取时间90min、提取次数为2次。用该条件进行验证实验(样品产地:甘肃张掖市),多糖得率为43.39mg/g。
2.5 精密度实验
精密量取对照品溶液2mL,共6份,按1.3.5节方法测定,结果吸收度的相对标准偏差RSD为0.27%,表明本方法精密度良好。
2.6 重复性实验
精密量取同一供试品溶液2mL,共6份,按1.3.5节方法测定,吸收度的相对标准偏差RSD为0.34%,表明本方法重现性良好。
2.7 稳定性实验
精密量取供试品溶液2mL,按1.3.5节方法操作,每10min测1次吸收度,到1h后改为20min测一次,吸收度的相对标准偏差RSD为0.59%,测定值在120min内基本保持稳定。以下吸光度测定均在120min内完成。
2.8 加样回收率实验
精密称取验证实验的锁阳粉末(甘肃张掖市)6份,各约5g,编号1~6,每2份为1组。分别加入对照品溶液10.0、15.0、20.0mL,按照最佳提取工艺方法分别提取回收试验样品。分别精密称取锁阳多糖回收试验样品约20mg于50mL量瓶中,加水溶解并稀释至刻度,摇匀,得回收试验样品溶液1~6。依法测定,计算回收率,结果均值为98.39%,RSD为0.94%,结果见表4。
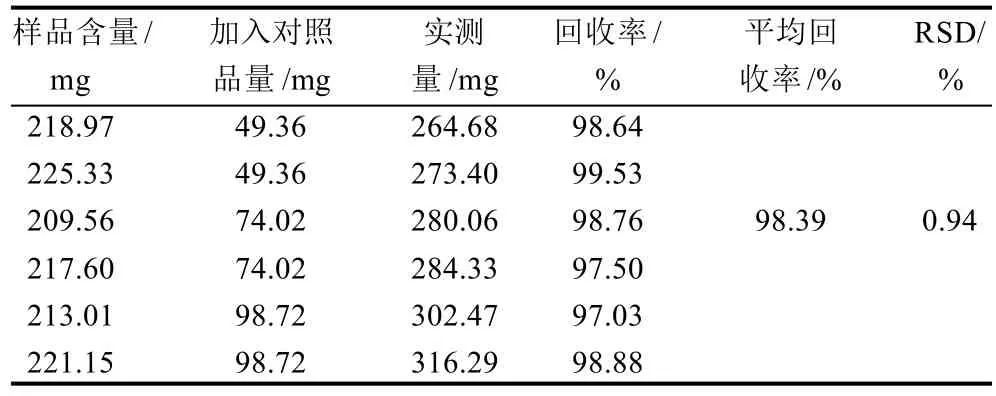
表4 回收率实验结果(n=6)Table 4 Recoveries of polysaccharides from spiked Cynomorium songaricum Rupr. roots (n=6)
2.9 样品的含量测定
精密量取供试品溶液5mL于25mL量瓶中,加水稀释至刻度,摇匀。精密量取上述溶液2mL,按1.3.5节方法测定,吸光度代入回归方程计算多糖含量,结果见表5。

表5 样品含量测定结果(n=3)Table 5 Polysaccharide contents in root samples of Cynomorium songaricum Rupr. from different habitats in Hexi Corridor (n=3)
3 结 论
以水回流提取、乙醇沉淀法提取锁阳多糖,用正交试验优化锁阳多糖提取工艺,结果表明:以料液比为1:15,提取时间90min、提取次数2次时提取效果最好,优化后的提取工艺稳定可靠,可提高锁阳多糖提取得率,为锁阳多糖提取提供了一种新方法。
结果表明,河西走廊不同地区的锁阳多糖含量差别很大,这可能与生长环境的土壤营养、水分、气候等因素有关。研究结果为科学评价锁阳药材内在质量、优质药材的选择提供了科学依据。
[1] 江苏新医学院编. 中药大辞典: 下册[M]. 上海: 上海人民出版社, 1997:2395-2399.
[2] 李薇. 河西走廊的道地药材: 锁阳[J]. 甘肃中医, 2003, 17(3): 28-29.
[3] 俞腾飞, 田向东, 朱惠珍. 锁阳三种总成分耐缺氧及对血小板聚集功能的影响[J]. 中国中药杂志, 1994, 19(4): 244-246.
[4] 齐艳华, 苏格尔. 锁阳的研究进展[J]. 中草药, 2000, 31(2): 146-148.
[5] 陶晶, 屠鹏飞. 锁阳茎的化学成分及其药理活性研究[J]. 中国中药杂志, 1999, 24(5): 292-294.
[6] 赵永青, 汤晓琴, 李广宇, 等. 锁阳对耐力训练大鼠小脑Purkije氏细胞线粒体超微结构的影响[J]. 中国运动医学杂志, 2001, 20(4): 373-375.
[7] 袁毅君, 赵国珍, 郭红英. 锁阳的抗疲劳抗缺氧效应及对血红蛋白含量的影响[J]. 天水师范学院学报, 2001, 21(2): 49-50.
[8] 苏格尔, 常艳旭. 锁阳化学成分和药理作用的研究概况[J]. 中国民族医药研究杂志, 2005, 23(6): 46-48.
[9] 常艳旭, 苏格尔. 锁阳有效成分及指标性成分的探讨[J]. 现代中药研究与实践, 2005, 19(3): 55-57.
[10] MA Chaomei, NORI N, HIROTSUGU M, et al. Inhibitory effects of constituents from Cynomorium songaricum and related triterpene derivatives on HIV-1 protease[J]. Chem Pharm Bul, 1999, 47(2): 141-145.
[11] CHENG Zhongzhang, XIU Zhixu, CHANG Li. Frusctosides from Cynomorium songaricum[J]. Phytochemistry, 1996, 41(3): 975-976.
[12] Van der DOELEN G A, van den BERG K J, BOON J J, et al. Analysis of fresh triterpenoid resins and aged triterpenoid varnishes by highperformance liquid chromatography-atmospheric pressure chemical ionisation (tandem) mass spectrometry[J]. Journal of Chromatography A, 1998, 809(1/2): 21-37.
[13] LUSHPA O U, ATALYKOVA F M. Chemical composition of parasitic plants of Kazakhstan flora[J]. CA, 1970, 73: 6318.
[14] ZHANG Siju, LIU Li, YU Jiangyong. Studies on the identification of Herba Cynomorii[J]. Chin Pharm J, 2004, 39(8): 579-581.
[15] 熊亚. 青海锁阳自然资源及应用前景[J]. 安徽农业科学, 2007, 35(10):3024-3026.
[16] 张思巨, 张淑运. 中药锁阳的化学成分研究[J]. 中国药学杂志, 1991,26(11): 649-651.
[17] 中国药典: 一部[S]. 北京: 化学工业出版社, 2005: 241.
[18] 刘晔玮, 邸多隆 葛斌, 等. 锁阳多糖提取工艺的研究[J]. 天然产物研究与开发, 2006(18): 1007-1109.
[19] 盛惟, 周红城, 白伟. 天然锁阳栽培锁阳中多糖的含量测定[J]. 中国民族医药杂志, 2000, 6(12): 62.
[20] 常艳旭, 李晋, 苏格尔, 等. 锁阳不同生育期多糖含量的动态研究[J].内蒙古大学学报: 自然科学版, 2007, 38(2): 237-240.
[21] 吕丽娟, 马明辉, 贡济宇, 等. 正交试验法优选麦冬多糖提取工艺[J].长春中医药大学学报, 2007, 23(2): 30-31.
[22] 张家建. 正交试验法优选当归多糖的提取工艺[J]. 浙江中医杂志,2008, 43(2): 117-118.
[23] 潘丽军, 陈锦泉. 试验设计与数据处理[M]. 南京: 东南大学出版社,2009: 156-158.
Optimum Extraction Process and Content Determination of Polysaccharides from Cynomorium songaricum Rupr.in Hexi Corridor Desert Area of Gansu
LUO Guang-hong1,WANG Qin2,*,ZU Ting-xun1,CHEN Tian-ren1
(1. The Provincial Key Laboratories of Characteristic Resource Utilization of Hexi Corridor in Gansu, Microalgae Engineering Research Center of Gansu Province, Kaiyuan Bio-tech Development Center, Hexi University, Zhangye 734000, China;
2. Zhangye Institute for Drug Control, Zhangye 734000, China)
The water extraction and ethanol precipitation of polysaccharides from the roots of Cynomorium songaricum Rupr.were optimized by orthogonal array design and the contents of polysaccharides in samples from different habitats in Hexi Corridor were determined by benzenol-H2SO4 method. Results indicated that the optimal extraction conditions were material/liquid ratio of 1:15 (g/mL), refluxing extraction duration of 90 min and repeated extraction number of 2. Root samples of Cynomorium songaricum Rupr. from different habitats in Hexi Corridor were significantly different from each other in their polysaccharide contents. Therefore, polysaccharide content can be used as a quality control indicator for Cynomorium songaricum Rupr..
Cynomorium songaricum Rupr.;polysaccharide;orthogonal test;extraction process;content determination
TS201.1;R284.1
A
1002-6630(2011)10-0079-05
2011-02-22
甘肃省科技支撑计划项目(0804NKCG082);甘肃省教育厅研究生导师计划项目(0809-07);甘肃省高校河西走廊特色资源利用省级重点实验室项目(XZ0707)
罗光宏(1965—),男,教授,硕士,研究方向为植物资源开发与利用。E-mail:luoguanghong@163.com
*通信作者:王勤(1969—),女,主任药师,硕士,研究方向为药品质量标准及成分分析。E-mail:wangqin690529@yahoo.com.cn
