溶剂浸提秋橄榄果实中番茄红素工艺优化
2011-10-28李纪元朱高浦杨艳春
李纪元,朱高浦,杨艳春,倪 穗,2,周 斌
(1.中国林业科学研究院亚热带林业研究所,浙江 富阳 311400;
2.宁波大学生命科学与生物工程学院,浙江 宁波 315211;3.浙江银象生物工程有限公司,浙江 台州 317200)
溶剂浸提秋橄榄果实中番茄红素工艺优化
李纪元1,朱高浦1,杨艳春1,倪 穗1,2,周 斌3
(1.中国林业科学研究院亚热带林业研究所,浙江 富阳 311400;
2.宁波大学生命科学与生物工程学院,浙江 宁波 315211;3.浙江银象生物工程有限公司,浙江 台州 317200)
分别采用乙酸甲酯、丙酮、石油醚、二氯甲烷4种浸提剂,设计3种提取方法对成熟秋橄榄浆果中番茄红素的提取效果进行评价和分析,获得优化小试提取工艺参数:在避光环境下,乙酸甲酯为浸提剂,料液比1:40(g/mL),边研磨边浸提,循环浸提4次,真空浓缩蒸干温度为57.8℃,此法可从秋橄榄浆果中获得番茄红素34.81mg/100g,回收溶剂可重复利用,浓缩粗提物中番茄红素质量浓度达6.4~7.5mg/100mL。乙酸甲酯适合作为秋橄榄番茄红素的提取溶剂。
秋橄榄;番茄红素;溶剂浸提;工艺参数
植物黄金——番茄红素对预防前列腺癌、肺癌、乳腺癌、子宫癌等有显著效果,还具有预防心脑血管疾病、提高免疫力、延缓衰老等功效,越来越引起人们的重视,被誉为“21世纪保健品的新宠”[1-3]。番茄红素是一种极强的抗氧化剂,能强烈清除自由基,对体内的抗氧化酶系统活性均有促进作用[4]。此外,在体育运动领域的应用也有报道[5-6]。目前世界上番茄红素的开发主要有番茄果实提取、化学合成等方法,但进入商品化的是主要以番茄果实为材料的提取。从营养数据库获知,新鲜西红柿番茄红素含量为3mg/100g、番茄酱为29mg/100g[7]。Ingrid等[8]研究表明,秋橄榄中番茄红素含量高达15~54mg/100g,同时也富含大量的β-胡萝卜素、叶黄素等有益成分。目前番茄红素市场需求存在极大缺口,寻找更高含量的番茄红素资源尤为迫切,而秋橄榄有可能成为替代西红柿成为生产番茄红素的新型植物资源[9]。现有的溶剂法提取番茄红素,所用溶剂多为毒性大,对人体有害的氯仿、丙酮、烷类等提取后残留较多[10]。本研究从溶剂种类、料液比、提取方式等关键影响因子着手,探讨秋橄榄成熟浆果番茄红素的提取工艺,在最大提取量的前提下,优化工艺流程,且浸提剂符合国家食品安全之要求,旨在为番茄红素的生产提供参考。
1 材料与方法
1.1 材料与试剂
秋橄榄果实采摘于河南洛阳市;番茄红素标准品 美国Sigma公司。乙酸甲酯、丙酮、石油醚、二氯甲烷、无水硫酸钠(均为分析纯) 浙江三鹰化学试剂公司。液相色谱流动相由体积分数为65%氰化甲烷、25%二氯甲烷、10%甲醇及1g/L 2,6-二叔丁基-4-甲基苯酚(BHT)和0.1mL/L 2-氮-二异丙基乙胺组成(除BHT为化学纯外,其他试剂均为色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SP-755PC分光光度计 上海光谱仪器有限公司;Senco R系列旋转蒸发器、SHB-3型循环水真空泵 上海申生科技有限公司;液相色谱岛津LC-20AT 日本岛津公司。
1.3 方法
1.3.1 最佳吸收波长选择
取0.4mL番茄红素浓缩液于试管中,用氮气干燥,先用0.4mL流动相溶解,从中取50μL稀释样品通过预柱(30mm×4.6mm,5μm),然后进入反相C18分析柱(250mm×4.6mm,5μm),样品在30min内,流速为0.8mL/min采用等度洗脱的方法洗脱。全波段扫描,确定最佳波长。
1.3.2 分光光度法测定番茄红素含量
参照国标法[11]制作标准曲线,并计算番茄红素含量。
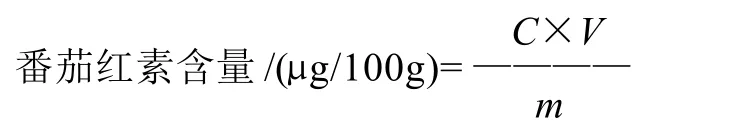
式中:C为查标准曲线得到的提取液质量浓度/(μg/mL);V为浸提剂体积/mL;m为样品质量/g。
1.3.3 提取方法
方法一:秋橄榄鲜样经研磨机低温粉碎,称取5g,加入50mL含质量分数0.5%抗氧化剂(BHT)的乙酸甲酯浸提剂摇匀,常温浸提10min,过滤上清液。滤渣按照相同方法连续提取至无色,共需9次,耗时1.5h,测定每次OD485值;收集9次滤液混合,测O D值。
方法二:与方法一不同之处在于,秋橄榄鲜样采用冰浴研磨匀浆。提取6次,耗时1.5h,测定每次OD485值;收集6次滤液混合,测O D值。
方法三:与方法一不同之处在于,采用乙酸甲酯浸提剂与秋橄榄鲜样共同冰浴研磨匀浆,提取6次,耗时1.5h,测定每次OD485值;收集6次滤液混合,测O D值。
为了减少实验误差,均在上述3种方式中设置3次重复,每个样品设稀释1、3倍和5倍共3个稀释梯度测定OD值。
1.3.4 最佳料液比选择方法
根据1.3.3节的结果确定提取方法,设1:10、1:20、1:30、1:40、1:50、1:60(g/mL)共6个料液比梯度以确定最佳料液比。
1.3.5 最佳提取剂的选择方法
根据1.3.3节和1.3.4节结果确定的最佳提取方法和最佳料液比,选择以石油醚、丙酮、二氯甲烷、乙酸甲酯为比较溶剂,以选择最佳提取剂。将提取液用无水硫酸钠滤除水分,用旋转蒸发仪浓缩蒸干,再将油树脂用最佳提取剂洗脱定容至100mL,测定OD值。
1.3.6 溶剂回收率和提取效果
回收1.3.5节的溶剂,并计算回收率,再用回收溶剂作为提取剂来检测回收溶剂的提取效果。
1.3.7 粗体物中番茄红素质量浓度测定
采用旋转蒸发仪将溶剂分离,待无溶剂冷凝后,即可获得呈树脂状、浓稠、颜色鲜红、富含番茄红素的粗体物浓缩液,根据1.3.3、1.3.4和1.3.5节结果确定的最佳提取方式、最佳料液比、最佳提取剂和浓缩方法来完成整个提取过程得到番茄红素粗提物,取1mL粗提物稀释10、20、30倍,在485nm波长处测定OD值,重复3次,查标准曲线,并计算番茄红素质量浓度。

式中:C为查标准曲线得到的提取液质量浓度/(μg/mL);X为稀释倍数;10-3将提取液质量浓度μg/mL换算为标准mg/mL单位系数。
1.3.8 数据处理
数据录入和制图采用Excel 2003;方差分析采用DPS 7.05进行。
2 结果与分析
2.1 番茄红素最佳吸收波长确定

图1 秋橄榄中番茄红素最佳吸收波长液相色谱图Fig.1 UV-vis scanning spectrum of lycopene extract from autumn olive berry
番茄红素有多个吸收高峰,因此需要选择一个最佳波长,要求不但能很好测定番茄红素含量,而且能够准确区分番茄红素异构体和胡萝卜素等。参照Ingrid等[8]提供色谱条件,筛选出以乙酸甲酯为番茄红素提取溶剂,在485nm波长处有特异吸收高峰,选为最佳吸收波长(图 1)。
2.2 不同浸提剂提取番茄红素的效果
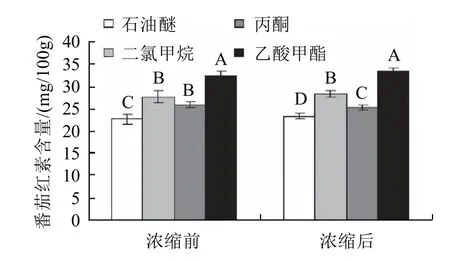
图2 不同提取剂浓缩前后番茄红素含量变化Fig.2 Effect of four solvents on extraction rate of lycopene
由图2可知,乙酸甲酯的提取效果最好,和其他3种提取剂相比差异达显著以上,且浓缩前后的趋势一致;观察滤渣亦可见丙酮和乙酸甲酯提取的颜色最浅,提取能力最好;二氯甲烷在用滤纸过滤时,长时间放置,仅有少量液体滤出,这可能与二氯甲烷密度大有关(二氯甲烷1.33>乙酸甲酯0.92>丙酮0.8,相对水密度=1时)。
2.3 3种不同浸提方式的提取效果比较

图3 不同提取次数对番茄红素残留量的影响Fig.3 Effect of repeated extraction time on extraction rate of lycopene
由图3可以看出,3种提取方式的番茄红素含量,除方法一外均随着提取次数的增加而呈逐渐下降趋势,可见番茄红素的残量随着提取次数的增加而减少,且提取至第5次时其含量已经很低,第6次趋近于零。经方式一处理需要9次才接近提取完全。因此,出于节约成本考虑,一般提取4次(每次50mL提取液)即可;同时可推算出5g鲜样需要浸提液200mL左右即可将番茄红素较完全提取出来;其中方法三处理后,在前3次提取过程中含量都最高,且在第5和第6次提取的含量最低,由此可以看出方法三能在最少提取次数条件下获得最大番茄红素得率。因为在浸提过程中,研磨物料促进了物料细胞壁破裂,从而提高其提取效率。
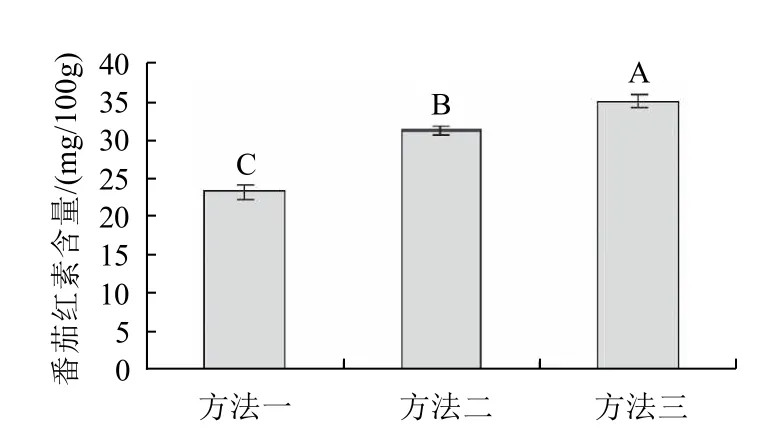
图4 3种提取方式对番茄红素含量的影响Fig.4 Effect of extraction method on extraction rate of lycopene
由图4可以看出,通过方法三可获得番茄红素的最大提取量34.81mg/100g,显著高于方法一(31.08mg/100g)和方法二(23.15mg/100g),其中方法三和方法一相差10mg/100g以上,这可能是由于方法一提取次数过多,时间过长,导致番茄红素分解,且其没有研磨未能使番茄红素充分释放出来的缘故。方法三和方法二比较相差3mg以上,可能是由于方法二所耗时间长造成的番茄红素分解所致。由此认定:合适的提取次数,尽量缩短提取时间,采用研磨破壁等工艺均为改善秋橄榄桨果中番茄红素提取效率的重要因素。
2.4 料液比对提取番茄红素的影响

图5 不同料液比时的提取效率比较Fig.5 Effect of solid-to-liquid ratio on extraction rate of lycopene
由图5可以看出,1:40作为料液比可以得到番茄红素的最大含量,且显著高于其他料液比;1:30、1:50、1:60之间的差异不显著,观察提取后的滤渣除1:10、1:20颜色微红之外,其他均呈白色,可见1:30~1:60的料液比可将浆果的色素完全提取出来。
2.5 回收溶剂的回收率和提取效果
按照优化的条件,即采用充分研磨,1:40(g/mL)料液比,反复取4次后旋转蒸发仪浓缩,浓缩后量取回收的溶剂,得到整体平均回收率为(97.29±0.01)%,其中浓缩后溶剂二氯甲烷回收率最高,可达(98.93±0.47)%;而石油醚回收率最低,为(95.64±0.64)%(表1)。浓缩后新试剂和回收试剂所提取的番茄红素含量都没有显著差异,因此浸提剂可回收反复利用,节约成本;在番茄红素油树脂浓缩过程中,其浓度温度可达到乙酸甲酯的沸点温度57.8℃,从表1可以看出,无论是哪一种浸提剂,回收率无较大差异,说明番茄红素具有较高的热稳定性。

表1 浓缩前后不同提取剂的回收率Table 1 Recovery rates of different organic extraction solvents after condensation
2.6 浓缩蒸干的番茄红素油树脂的含量
按1.3.7节的方式测得番茄红素浓缩液的质量浓度为6.4~7.5mg/100mL。
3 讨 论
对农林资源进行微粒超微化处理,可以使其比表面积成倍增长[12],通过对3种提取方式的提取效果比较发现,研磨是提高番茄红素提取率的最有效方式之一。在浸提过程中,采用研磨处理能使秋橄榄果实含番茄红素的细胞壁破裂,加快番茄红素释放,不仅缩短浸提处理时间,降低番茄红素的自然降解,而且可显著提高番茄红素在有机溶剂中的溶出率。提取次数和总的浸提时间也会影响番茄红素的得率,要尽量缩短提取时间,研磨充分后立即开始过滤,并且把提取次数控制在4次左右,这可能是由于天然番茄红素对光较敏感,在光照条件下很不稳定造成分解所致,因此提取番茄红素时,应避光操作。虽然番茄红素对光极为敏感,但却具有良好的热稳定性能[13-15]。57.8℃浓缩前后的番茄红素得率变化趋势基本一致,因此出于效率最大原则考虑,选择浸提剂的沸点不应超过57.8℃。
秋橄榄果实富含的天然色素不溶于水和酒精等,在选用浸提剂时,应首先考虑选用亲油性有机溶剂来提取番茄红素。选用了目前较为通用的提取试剂——丙酮、石油醚、二氯甲烷等作为对照,最后确定了乙酸甲酯作为优化的提取溶剂,它具有沸点较低(乙酸甲酯沸点57.8℃,乙酸乙酯为77.06℃)、经济、有香味等允许在食品中少量残留的优点,克服了丙酮、氯仿等有机溶剂虽然提取效率高,但毒性大的缺点,适合作为秋橄榄番茄红素的提取。
秋橄榄是一种极具开发潜力的天然抗氧化剂,在我国尚处于野生状态[16],因此加快秋橄榄野生资源的引种驯化与培育,将来有可能成为替代番茄作为获取番茄红素的新型植物原材料。
[1] 张莉, 王政军. 番茄红素的保健功能综述[J]. 中国调味品, 2009, 34(9): 98-100.
[2] 梅晓岩, 刘荣厚, 刘军. 番茄红素对体外肿瘤细胞抑制作用的研究[J]. 食品科学, 2007, 28(4): 305-309.
[3] HEATH E, SAHIN K, SEREN S, et al. Lycopene: prospects for chemoprevention and treatment of prostate cancer[J]. Nutrition Abstracts and Reviews A, 2007, 77(2): 1-9.
[4] 范远景, 黄璐. 番茄红素吸收与体内抗氧化的机理研究[J]. 食品科学, 2007, 28(11): 545-548.
[5] 董少斌. 补充番茄红素对篮球运动员大强度训练后免疫机能的影响[J]. 北京体育大学学报, 2008, 31(3): 351-352; 358.
[6] 李军汉, 周进, 黄雷. 番茄红素的生物学特性及其在体育运动领域的应用研究[J]. 吉林体育学院学报, 2009, 25(4): 64-65.
[7] HOLDEN J M, ELDRIDGE A L, BEECHER G R, et al. Carotenoid content of U.S. foods: an update of the database[J]. J Food Compos Anal,1999, 12(3): 169-196.
[8] INGRID M F, BEVERLY A C, EUGENE R W, et al. Fruit of autumn olive: a rich source of lycopene[J]. HortScience, 2001, 36(6): 1136-1137.
[9] FORDHAM I M, ZIMMERMAN R H, BLACK B L, et a1. Autumn olive: a potential alternative crop[J]. Acta Horticulturae, 2003, 626: 437-439.
[10] CORTSA J M, VZQUEZB A, SANTA-MAR?A G, et al. Pesticide residue analysis by RPLC-GC in lycopene and other carotenoids obtained from tomatoes by supercritical fluid extraction[J]. Food Chemistry,2009, 113(1): 280-284.
[11] GB/T 1421—93番茄酱罐头: 附录A[S].
[12] 谢瑞红, 王顺喜, 谢建新, 等. 超微粉碎技术的应用现状与发展趋势[J]. 中国粉体技术, 2009, 15(3): 64-67.
[13] 邱伟芬, 汪海峰. 天然番茄红素在不同环境条件下的稳定性研究[J].食品科学, 2004, 25(2): 56-60.
[14] 冯晓梅, 韩玉谦, 隋晓, 等. 番茄红素稳定性的研究[J]. 青岛海洋大学学报, 2003, 33(6): 875-880.
[15] SHI J, DAI Yuzhu, KAKUDA Y, et al. Effect of heating and exposure to light on the stability of lycopene in tomato purée[J]. Food Control,2008, 19(5): 514-520.
[16] 倪穗, 李纪元, 李辛雷. 牛奶子果实性状及营养成分的产地与株间变异研究[J]. 林业科学研究, 2007, 20(3): 404-407.
Optimization of Solvent Extraction Process for Lycopene from Autumn Olive Berry
LI Ji-yuan1,ZHU Gao-pu1,YANG Yan-chun1,NI Sui1,2,ZHOU Bin3
(1. Subtropical Forestry Research Institute, Chinese Academy of Forestry, Fuyang 311400, China;
2. Faculty of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China;
3. Zhejiang Silver-elephant Bio-engineering Company, Taizhou 317200, China)
A comparative investigation was carried out to evaluate and analyze the effects of four solvents and three extraction methods on the extraction of lycopene from autumn olive berry. The optimal process for lab-scale extraction of lycopene from autumn olive berry was as follows: Autumn olive berry was extracted repeatedly 4 times using methyl acetate as extraction solvent at a material/liquid ratio of 1:40 with grinding under light-free conditions, and then the extract was vacuum concentrated at 57.8 ℃. The resulting yield of lycopene was 34.81 mg/100 g of fruit. Meanwhile, the extraction solvent could be recycled. The content of lycopene in the concentrated extract ranged from 6.4 mg/100mL to 7.5 mg/100 mL. This study can offer an experimental reference for future industrial production.
autumn olive;lycopene;solvent extraction;process parameters
TS201.1
A
1002-6630(2011)10-0044-04
2010-07-04
浙江省重大科技攻关项目(2007C12117);宁波市科技攻关项目(2008C10029)
李纪元(1964—),男,研究员,研究方向为观赏植物与花卉分子育种。E-mail:jiyuan_li@126.com
