不同处理工艺对苦荞麸皮膳食纤维体外抗氧化活性的影响
2011-10-26周小理钱韻芳周一鸣宋鑫莉
周小理,钱韻芳,2,周一鸣,宋鑫莉
(1.上海应用技术学院香料香精技术与工程学院,上海 200235;2.上海海洋大学食品学院,上海 201306)
不同处理工艺对苦荞麸皮膳食纤维体外抗氧化活性的影响
周小理1,钱韻芳1,2,周一鸣1,宋鑫莉1
(1.上海应用技术学院香料香精技术与工程学院,上海 200235;2.上海海洋大学食品学院,上海 201306)
以苦荞麸皮为原料,通过对比挤压膨化处理、双酶法(淀粉酶、蛋白酶)提取处理、纤维素酶改性处理等不同工艺手段,对苦荞麸皮总膳食纤维、水溶性膳食纤维、不溶性膳食纤维、总酚和总黄酮含量,以及对DPPH自由基清除能力、还原能力、羟自由基清除能力和螯合Fe3+能力进行测定,研究其对苦荞麸皮膳食纤维体外抗氧化活性的影响。结果表明,膨化处理、酶法工艺对提高苦荞麸皮膳食纤维中黄酮、酚类物质以及总膳食纤维、水溶性膳食纤维、不溶性膳食纤维的含量及其抗氧化活性均具有一定效果。
苦荞麸皮;膳食纤维;抗氧化
膳食纤维(dietary fiber,DF)是指能抗人体小肠消化吸收而在大肠部分或全部发酵可食用植物性成分、碳水化合物及其类似物的总称,主要包括多糖、低聚糖和木质素等。膳食纤维按其在热水中的溶解性不同可分为水溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。随着对膳食纤维生理功能研究的不断深入,植物源性膳食纤维的生物活性得到重新认识。植物源性膳食纤维因其原料的不同具备不同的生物活性物质[1],其具备的抗氧化活性提高了膳食纤维的生理活性。
苦荞(tartary buckwheat,TB)又称鞑靼荞麦(Fagopyrum tartaricum L. Gaerth)是荞麦的一个栽培种,属蓼科双子叶药食兼用植物。苦荞麸皮不仅含有天然抗氧化物质,如芦丁、槲皮素等黄酮类物质[2-4],还含有大量膳食纤维和胶质状的葡聚糖。苦荞面粉产品加工所产生的副产品——苦荞麸皮目前常常被当作饲料或废料丢弃,致使苦荞麸皮中的膳食纤维及一些高生理活性的抗氧化物质没有得到很好的开发与利用。本实验以苦荞麸皮为原料,以挤压膨化处理、酶法处理,制备高品质苦荞麸皮膳食纤维,并研究了挤压膨化处理和酶法处理对苦荞麸皮膳食纤维体外抗氧化活性的影响,为今后工业化生产苦荞抗氧化膳食纤维粉提供一定参考。
1 材料与方法
1.1 材料与试剂
山西黑丰一号苦荞。
2,6-二叔丁基对甲酚(BHT)、水杨酸、没食子酸等试剂均为分析纯;1,1-二苯基-2-苦苯肼(DPPH)、芦丁美国Sigma公司。
1.2 仪器与设备
DELTA320型pH计、AL104型电子天平 梅特勒-托利多仪器(上海)有限公司;UV-2000紫外分光光度计上海菁华科技仪器有限公司;101-2型电热鼓风干燥箱北京市永光明医疗仪器厂;DZF-609真空干燥箱 上海精宏试验设备有限公司;HH-4型恒温振荡水浴箱 上海森地科学仪器有限公司;SX型单螺杆挤压膨化机 山东赛信食品机械有限公司。
1.3 方法
1.3.1 苦荞麸皮膳食纤维的制备流程

1.3.2 膨化工艺[5]
称取1kg苦荞麸皮,调节物料水分为15%,在螺杆转速90r/min、挤压温度110℃条件下处理样品。
1.3.3 膳食纤维的测定
参考GB/T 5009.88—2008《食品中膳食纤维的测定》方法测定原料麸皮中总膳食纤维、不溶性膳食纤维、水溶性膳食纤维的含量。
1.3.4 抗氧化活性成分的提取与测定
1.3.4.1 抗氧化活性成分的提取[6-7]
取2g苦荞麸皮及膳食纤维样品,用70%乙醇溶液,料液比1:50(g/mL),于70℃恒温水浴锅中浸提6h,提取后的样液3000r/min离心10min,取上清液待用。
1.3.4.2 总酚含量的测定[8]
分别加入0、5、10、20、25、30、40、50μL 1.0mg/mL没食子酸/乙醇标准溶液及0.1mL样品溶液于5mL试管中,加入1.0mL 7.5% Na2CO3溶液和0.5mL福林酚试剂,定容至4mL,室温静止30min后于波长765nm处测定吸光度,并绘制标准曲线。
1.3.4.3 总黄酮含量的测定
采用铝盐比色法[9],以芦丁为标准物测定总黄酮含量测定黄酮类化合物的含量。准确配制0.0500mg/mL芦丁标准溶液。分别准确移取以上溶液0.25、0.50、1.0、2.0、3.0、4.0mL和0.1mL于10mL容量瓶,加入三氯化铝、乙酸钾溶液,用甲醇定容至刻度,摇匀,室温下放置30min。通过二元回归法绘制标准曲线图,得到标准曲线。
1.3.5 抗氧化活性的测定
1.3.5.1 DPPH·法对苦荞麸皮膳食纤维抗氧化活性的测定[10-11]
准确称取DPPH·用无水乙醇配成储备液(1.0×10-3mol/L)保存于冰箱中,用时稀释10倍。然后在试管中依次加入1.0mL 1.0×10-4mol/L DPPH-乙醇溶液和3.0mL待测样品,总体积为4.0mL,混匀30min后,于1cm比色皿中测定A517nm,记为Ai;加入3.0mL 1.0×10-4mol/L DPPH-乙醇溶液和1.0mL蒸馏水,测定值记为(A0);加入1.0mL体积分数50%乙醇和3.0mL待测样品溶液,测定值记为Aj。做3组平行实验以最大程度降低实验误差,并按公式(1)计算DPPH自由基清除率。实验以抗氧化剂BHT为参照。
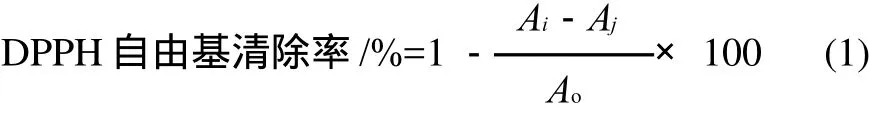
1.3.5.2 还原能力的测定[12]
取2.5mL样品溶液,加入2.5mL 0.2mol/L磷酸盐缓冲液(pH6.6)和2.5mL 1%铁氰化钾,50℃水浴20min后急速冷却,加入10%三氯乙酸溶液2.5mL,取5mL此溶液加入4mL蒸馏水和0.5mL 0.1% FeCl3,反应10min后于波长700nm处测定吸光度。吸光度越高表明还原能力越强。实验以抗氧化剂BHT为参照。
1.3.5.3 羟自由基清除能力的测定[13]
在试管中分别加入2mL 6mmol/L H2O2、2mL 6mmol/L FeSO4、2mL 6mmol/L水杨酸-乙醇溶液和2mL一系列不同浓度的样品,最后加H2O2启动反应,37℃反应0.5h,并以蒸馏水为参比,在波长510nm处测量各浓度下的吸光度。以2mL 6mmol/L Fe2+、2mL 6mmol/L水杨酸-乙醇溶液、2mL为各样品的本底吸收。实验以抗氧化剂BHT为参照。做3组平行实验以最大程度降低实验误差,计算过程如下所示。

1.3.5.4 螯合Fe3+能力的测定
参考沈淑英等[14]的研究,选择相对偏差较小的Fe滴定法(用磺基水杨酸显色)。移取样品溶液2mL、30mL水和5滴2%的磺基水杨酸于250mL锥形瓶中,用0.01mol/L FeCl3标准溶液滴定至溶液呈微红色,此时即为终点。消耗的FeCl3标准溶液的体积与螯合铁离子能力成正比例关系。
2 结果与分析
2.1 膳食纤维组成测定

表1 膳食纤维的含量Table 1 Soluble and insoluble dietary fiber content and composition in different samples
由表1可知,挤压膨化工艺使原料麸皮中水溶性膳食纤维占总膳食纤维的含量比由1.40%提高至6.03%。原料麸皮经过酶法提取后,总膳食纤维含量明显提高,改性后水溶性膳食纤维含量增加。
2.2 苦荞麸皮膳食纤维中总酚含量
以没食子酸为标准物的总酚含量标准曲线:y=0.0162x-0.0104,R2=0.9985。原料麸皮及酶法粗提物中总酚含量测定结果如图1所示。

图1 总酚含量测定结果Fig.1 Total phenolics content in different samples
由图1可知,原料麸皮经挤压膨化处理后麸皮中总酚含量有所增加;未挤压膨化麸皮的酶解粗提物中的总酚含量较原料麸皮提高1倍,说明双酶法处理能够有效去除原料麸皮中的淀粉、蛋白质等物质,提高膳食纤维中酚类物质含量;挤压膨化麸皮的酶解粗提物中总酚含量与原料麸皮趋于一致;另外,纤维素酶改性处理并不影响膳食纤维中的总酚含量。
2.3 苦荞麸皮膳食纤维中总黄酮含量
总黄酮含量标准曲线方程:y=40.7979x-0.0024。式中:y为标准溶液质量浓度/(mg/mL);x为吸光度。原料麸皮及酶法粗提物中总黄酮含量测定结果如图2所示。

图2 总黄酮含量测定结果Fig.2 Total flavonoid content in different samples
由图2可知,原料麸皮经膨化处理后麸皮中总黄酮含量有所增加;原料麸皮经酶法提取后,膳食纤维中总黄酮含量由37.43mg/g提高至52.14mg/g,表明双酶法处理提高了膳食纤维中黄酮类物质含量,且纤维素酶酶法改性不影响黄酮类物质的含量。这与总酚含量的变化趋势相一致。
2.4 DPPH自由基清除能力
原料麸皮及多种处理后其膳食纤维的DPPH自由基清除能力测定结果如图3所示。

图3 DPPH自由基清除活力测定结果Fig.3 DPPH radical scavenging capacity of different samples
由图3可知,经双酶法处理、纤维素酶改性处理后的膳食纤维清除DPPH自由基的能力都较原料麸皮有所提高,其中膨化麸皮膳食纤维粗提物的清除能力最高,达到64.12%,但较抗氧化剂BHT的清除能力低。
2.5 还原能力
原料麸皮及多种处理后其膳食纤维的还原能力测定结果如图4所示。
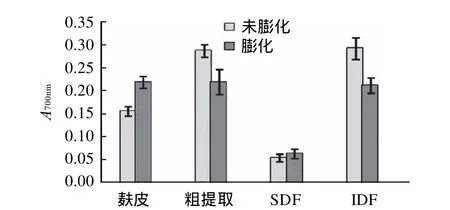
图4 还原能力的测定结果Fig.4 Reducing power of different samples
由图4可知,麸皮经挤压膨化处理后还原能力有一定提高;酶法处理能显著提高未膨化麸皮膳食纤维粗提物的还原能力,其还原能力较酶法处理前提高了82.8%,但对膨化麸皮膳食纤维粗提物的作用不明显。纤维素酶酶法改性后,不溶性膳食纤维的还原能力与改性前酶解粗提物的还原能力接近。该结果与总酚、总黄酮含量的变化趋势一致。
2.6 羟自由基清除能力
原料麸皮及多种处理后其膳食纤维的清除羟自由基能力测定结果如图5所示。
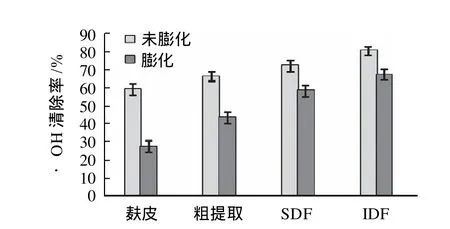
图5 ·OH清除率测定结果Fig.5 Hydroxyl radial scavenging capacity of different samples
·OH含有活性最强的活性氧[15],因此,清除羟自由基是预防各种疾病的有效途径。由图5可知,酶法处理后的麸皮膳食纤维清除·OH的能力较原料都有很大提高,其中未膨化麸皮改性后不溶性膳食纤维清除率最高,为80.01%,较抗氧化剂BHT的39.34%高;改性后水溶性膳食纤维对·OH的清除作用也很大,分别达到了71.93%和58.18%。
2.7 螯合Fe3+能力
原料麸皮及多种处理后其膳食纤维的螯合Fe3+能力测定结果如图6所示。
图6 螯合Fe3+能力Fig.6 Terric ion-chelating ability of different samples
过渡金属离子如铁离子能够催化加速O2-·与H2O2反应生成毒性更强的·OH和OH-,因此螯合铁离子能力能够反映重要的抗氧化信息[15]。由图6可知,膨化处理提高了麸皮螯合Fe3+的能力,而酶法改性处理进一步提高了水溶性膳食纤维和不溶性膳食纤维螯合Fe3+的能力,其中膨化麸皮改性后不溶性膳食纤维的Fe3+螯合能力最高,能够螯合2.98mL标准Fe3+溶液。这是因为纤维素酶打开了纤维的网状结构,增加了比表面积[16],有利于金属离子的螯合。因此改性后水溶性膳食纤维和不溶性膳食纤维螯合了Fe3+,阻断了Fe3+的催化反应,因此同时具有较强清除·OH的能力。
3 结 论
3.1 膨化处理后麸皮中水溶性膳食纤维、总酚、总黄酮含量均较未膨化麸皮高,且还原能力和螯合Fe3+能力也均较未膨化麸皮高。
3.2 双酶法处理后的提取产物中总酚、总黄酮含量均有不同程度的增加,并均提高了对DPPH自由基的清除能力、·OH的清除能力、还原能力等抗氧化能力。3.3 纤维素酶改性处理后产物中水溶性膳食纤维明显提高,在螯合铁离子、抑制·OH形成方面作用明显,而·OH是毒性较强的自由基,因此改性处理对整体提高苦荞麸皮膳食纤维的抗氧化性能具有重要价值。
[1] 谌小立, 赵国华. 抗氧化膳食纤维研究进展[J]. 食品科学, 2009, 30(5): 291-294.
[2] 郭刚军, 何美莹, 邹建云, 等. 苦荞黄酮的提取分离及抗氧化活性研究[J]. 食品科学, 2008, 29(12): 373-376.
[3] 杜敏华, 王庆林. 苦荞麦麸皮黄酮类化合物在微波辅助提取过程中的动态变化[J]. 华中农业大学学报, 2008, 27(4): 536-539.
[4] 任顺成, 孙军涛. 荞麦粉、皮、壳及芽中黄酮类含量分析研究[J].中国粮油学报, 2008, 23(6): 210-213.
[5] 徐红华, 许岩, 肖志刚. 不同挤压膨化条件对稻麸中可溶性膳食纤维含量的影响[J]. 食品科技, 2004(12): 89-90; 94.
[6] 周小理, 宋鑫莉, 周一鸣, 等. 苦荞萌发期抗氧化活性变化规律的研究[J]. 食品工业, 2009(5): 9-11.
[7] 周小理, 周一鸣. 苦荞麸皮黄酮纯品与粗品抗氧化活性的比较研究[J]. 食品工业科技, 2008(10): 78-80.
[8] YU Liangli, PERRET J, ,H,ARRIS M, et al. Antioxidant properties of bran extracts from , , Akron wheat grown at different locations[J]. Journal of Agricultural and Food Chemistry, 2003, 51(6): 1566-1570.
[9] LI Weixi. Standardization of method for determination of flavone in tartary buckwheat and its products[M]. 北京: 中国农业科学技术出版社, 2006: 38-45.
[10] 许申鸿, 杭瑚. 20种植物水提物对DPPH·的清除作用[J]. 中国野生植物资源, 1999, 18(3): 50-51.
[11] COTELLE N, BERNIER J L, CATTEAU J P, et al. Antioxidant properties of hydroxyl flaones[J]. Free Radical Biology & Medicine,1998, 20(1): 35-43.
[12] 王静, 刘大川. 紫(白)苏叶黄酮类化合物抗氧化性能的研究[J]. 中国油脂, 2004, 29(3): 33-36.
[13] 陈灵然, 王琴. 蔗麻多糖的提取及其清除自由基的作用[J]. 中国兽医科技, 2004, 34(4): 59-62.
[14] 沈淑英, 魏艳, 赵梅, 等. 螯合铁离子能力测定方法比较[J]. 印染助剂, 2009, 26(7): 50-52.
[15] KEHRER J P. The Haber-Weiss reaction and mechanisms of toxicity[J].Toxicology, 2000, 149(1): 43-50.
[16] 陶颜娟, 钱海峰, 周惠明, 等. 纤维素酶法制备麦麸可溶性膳食纤维及其理化性质研究[J]. 食品工业科技, 2008, 29(4): 127-130.
Effect of Different Processing Methods on in vitro Antioxidant Properties of Dietary Fiber from Tartary Buckwheat Bran
ZHOU Xiao-li1,QIAN Yun-fang1,2,ZHOU Yi-ming1,SONG Xin-li1
(1. School of Perfume and Aroma Technology, Shanghai Institute of Technology, Shanghai 200235, China;2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
This study aimed at comparing the chemical composition, reducing power, free radical scavenging ability and ferric ion-chelating ability of products at different stages of preparation of soluble and insoluble dietary fiber from tartary buckwheat(Fagopyrum tartaricum L. Gaerth.) bran by extrusion or not, followed by sequential enzymatic hydrolysis with α-amylase and protease and subsequent cellulase modification. The results showed that extrusion and enzymatic treatment could improve the contents of total dietary fiber, insoluble and soluble dietary fiber, total flavonoids and total phenolics and antioxidant properties of dietary fiber from tartary buckwheat bran.
tartary buckwheat bran;dietary fiber;antioxidant properties
TS213
A
1002-6630(2011)08-0001-04
2010-07-02
国家自然科学基金项目(31071527)
周小理(1957—),女,教授,学士,研究方向为食品新资源深度开发与利用。E-mail:zhouxl@sit.edu.cn
