响应曲面法优化苦水玫瑰中抗氧化物质提取工艺参数
2011-10-24李鹏飞蒋玉梅李霁昕艾娜丝
李鹏飞,蒋玉梅,李霁昕,毕 阳,艾娜丝
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
响应曲面法优化苦水玫瑰中抗氧化物质提取工艺参数
李鹏飞,蒋玉梅*,李霁昕,毕 阳,艾娜丝
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
以苦水玫瑰花提取物的总抗氧化能力为评价指标,在单因素和中心旋转组合实验设计结果的基础上,通过响应曲面法优化苦水玫瑰花中抗氧化物质的提取工艺参数。结果显示:4个因素对苦水玫瑰花中抗氧化物质提取的影响依次为温度>液料比>乙醇浓度>时间。典型性分析显示,苦水玫瑰花抗氧化物质提取最佳工艺参数为乙醇浓度50%、液料比25∶1、温度90℃、时间120min,苦水玫瑰中抗氧化物质的总抗氧化能力为 3343.9μmol·g-1,与预测值3365μmol·g-1的相对误差为0.63%。回归方程的预测值和实验值差异不显著,所得回归模型拟合情况良好,符合要求。
苦水玫瑰花,抗氧化能力,响应面
流行病学研究表明,植物中的黄酮类和酚类对癌症、中风、冠心病和神经退行性疾病有预防作用[1-3]。人类自身虽然拥有抗氧化防御系统,但其防御效率较低,有研究显示摄入抗氧化物质丰富的食品会降低人类疾病的发病率[4-5]。因此,天然抗氧化物质的提取分析受到了众多学者的关注,但多集中于水果蔬菜,花卉类研究鲜见报道[6]。玫瑰花由于含有丰富的VC、酚类物质和类胡萝卜素等天然抗氧化剂[7-8],在东亚和欧洲一直被作为药茶,同时也用来补充维生素和加工食品。苦水玫瑰(R.Setate×R.Rugosa)是钝齿蔷薇和我国传统玫瑰的杂交种,在甘肃省永登县苦水镇有大面积种植,其抗逆性、产花量、含油量和油的香气都可与国际上久负盛名的保加利亚大马士革玫瑰相媲美,是甘肃省主要香料作物[9],通常用于精油提取和干花蕾加工,原料利用率较低,深度加工缺乏基础研究支持。近年来,苦水玫瑰的分析研究虽然也开始受到关注[10-12],但关于苦水玫瑰抗氧化物质的提取和活性研究还未见报道。本文采用乙醇浸提法提取苦水玫瑰花中的抗氧化物质,以总抗氧化能力作为评价指标,采用中心旋转组合实验设计分析提取时间、温度、液料比和乙醇浓度对苦水玫瑰花抗氧化物质提取物总抗氧化能力的影响,通过响应面法(RSM)对苦水玫瑰抗氧化物质的提取工艺参数进行优化,确定乙醇浸提法提取苦水玫瑰抗氧化物质的最佳工艺参数,以期为甘肃苦水玫瑰花的深加工和提高原料利用率提供科学参考和理论数据支持。
1 材料与方法
1.1 材料与仪器
苦水玫瑰花 2009年5月中旬上午6~10点间采摘于甘肃永登苦水上新沟村,采后加冰袋迅速降温,当天上午运抵实验室,低温速冻,冻藏备用,参照邵大伟的方法[13]将原料干制后,分离花瓣和花托,粉碎花瓣,过40目筛备用;无水乙醇、硫酸亚铁、硫酸、氯化铁、盐酸、乙酸钠、冰乙酸 均为分析纯;三吡啶三吖嗪(2,4,6-tripyridyl-s-triazine,TPTZ) 日本TCI,色谱纯。
紫外-可见分光光度计UV-2550 日本岛津;电子天平AL104型 上海梅特勒-托利多仪器上海有限公司;旋转蒸发仪R-201型 上海申胜生物技术有限公司;离心机H-1850R 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 总抗氧化能力的测定 铁离子还原法(ferricreducing antioxidant power,FRAP),参照 Benzuie 和Strain 的方法[14],略做改进。
FRAP标准曲线:4.75m L TPTZ工作液(由0.3mol/L的乙酸-乙酸钠缓冲溶液,pH3.6;10mmol/L TPTZ 溶液;20mmol/L FeCl3溶液按 10∶1∶1 的比例混匀),分别加入0.1、0.2、0.3、0.4、0.5、0.6mmol/L FeSO4各0.25m L,以加入0.25m L去离子水为空白,混匀后37℃反应10m in,于593nm处测定吸光度,以此绘制标准曲线。试样还原活性(FRAP值)以达到同样吸光度所需的FeSO4的毫摩尔数表示,每份试样做3个平行。
1.2.2 单因素实验 在预实验的基础上,选择乙醇浓度、液料比、提取温度和提取时间四个因素进行单因素实验,分别考察其对苦水玫瑰花瓣提取物总抗氧化能力的影响,确定各因素的优化区间。称取玫瑰花瓣干粉5g置于500m L三口烧瓶中,选择乙醇浓度梯度分别为30%、40%、50%、60%、70%和80%;液料比梯度为 10∶1、15∶1、20∶1、25∶1、30∶1;温度梯度为 30、40、50、60、70、80、90℃;浸提时间梯度为 30、60、90、120、150min。加热回流提取,热过滤,旋转蒸发浓缩体积至约70m L,离心取上清液,定容至100m L备用。每份试样做3个平行。
1.2.3 响应曲面法优化苦水玫瑰中抗氧化成分的提取工艺参数 根据单因素实验,选取时间(m in)、温度(℃)、乙醇浓度(%)、液料比(V/m)四个因素为自变量(xi),以总抗氧化能力(FRAP)为响应值(Y),进行中心旋转组合实验设计,共30个实验点,由单因素实验确定各因素变化区间。每个实验点均做三个平行,应用Design-Expert7.1软件建立方差分析模型,选择P<0.05的因素作为主效应因素,因素水平编码见表1。

表1 中心旋转组合设计因素水平编码表
1.2.4 模型的验证 通过响应面分析法优化苦水玫瑰花中抗氧化物质的提取条件。在优化条件下提取玫瑰花中抗氧化物质,通过比较预测值和实验值来验证模型的有效性。
2 结果与分析
2.1 总抗氧化能力(FRAP)工作曲线
以FeSO4浓度为横坐标(x),593nm处吸光度为纵坐标(y),确定了标准曲线的回归方程为 y=0.9818x+0.0097,相关系数R2为0.9991,表明FeSO4浓度在0.1~0.6μmol·m L-1范围内与其吸光值呈现良好的线性关系,该方程可用于玫瑰总抗氧化能力的定量测定。

图1 FeSO4标准工作曲线
2.2 苦水玫瑰抗氧化物质提取单因素实验结果
2.2.1 乙醇浓度对提取物抗氧化能力的影响 乙醇浓度对苦水玫瑰花瓣提取物抗氧化能力的影响呈单峰型变化(图2),乙醇浓度为40%时提取物的总抗氧化能力最高,当乙醇浓度大于40%时,随着乙醇浓度增加,总抗氧化能力快速下降,当乙醇浓度达到80%时,提取物的总抗氧化能力较最高值下降了23%。
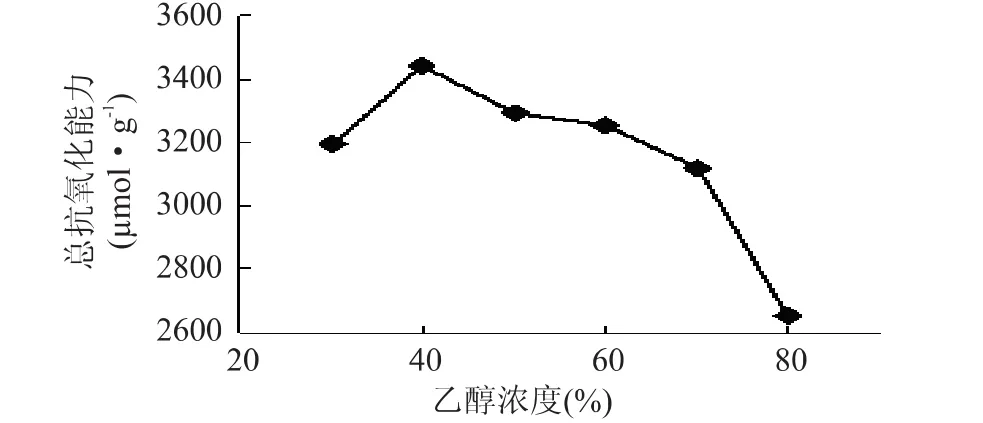
图2 乙醇浓度对抗氧化成分提取的影响
2.2.2 液料比对提取物抗氧化能力的影响 随着液料比的增加,苦水玫瑰花瓣提取物的总抗氧化能力呈上升趋势(图3)。说明随着液料比增加,玫瑰花瓣中抗氧化物质的浸出率提高。料液比达到20∶1后,继续增加料液比,提取物的总抗氧化能力无明显变化。料液比为30∶1的苦水玫瑰花瓣提取物总抗氧化能力仅较料液比为20∶1的提取物总抗氧化能力高1%,考虑到提取成本和后续处理问题,选用液料比为 20∶1。

图3 液料比对抗氧化成分提取的影响
2.2.3 温度对提取物抗氧化能力的影响 温度对苦水玫瑰花瓣提取物抗氧化能力的影响总体趋势呈单峰型变化(图4),80℃时提取物的总抗氧化能力达到最大值,是提取温度为30℃时的1.26倍,说明当浸提温度小于80℃时,随着浸提温度升高,玫瑰花瓣中的抗氧化物质的浸出率提高。继续升温,提取物的总抗氧化能力有所下降。

图4 温度对抗氧化成分提取的影响
2.2.4 时间对提取物抗氧化能力的影响 随着浸提时间的延长,苦水玫瑰花瓣提取物的总抗氧化能力呈上升趋势(图5),说明随着浸提时间延长,玫瑰花瓣中抗氧化物质的浸出率提高。浸提时间在30m in至60m in之间,提取物的总抗氧化能力增加最为明显,浸提时间为60m in时,提取物的总抗氧化能力为30m in时的1.16倍,60m in后,提取物的总抗氧化能力略有增加,120m in时总抗氧化能力最高,较60m in时增加了1.4%。120m in后提取物的总抗氧化能力略有降低。这可能是因为随着加热时间的延长,部分抗氧化物质结构变化的结果。

图5 时间对抗氧化成分提取的影响
2.3 模型的拟合
利用Design-Expert 7.1软件进行方差分析和二次多项回归拟合实验,以提取温度、提取时间、乙醇浓度、液料比为自变量,实验设计和响应值见表2。拟合所得多元二次回归方程如下:

总抗氧化能力的预测值与实际实验值拟合情况见图6,显示预测值和实验值拟合良好。模型P<0.0001,决定系数(R-squared)为 0.9629,校正系数(AdjR-squared)为0.9281(表3),响应变量 R2高于0.80,证明此模型显著,可充分地反映各变量之间的关系[15]。

图6 总抗氧化能力的预测值和实际值的对应关系

表2 中心旋转组合设计和响应值
由表 3 可知,x1、x2、x3、x4、x1x2、x1x3、x1x4、x3x4、x21、、项对抗氧化物质提取率有显著影响,其他因素影响不显著。回归方程一次项的回归系数绝对值大小依次为 x1、x2、x3、x4,表明温度对抗氧化物质提取率的影响最大,其次是液料比、乙醇浓度和时间。不同处理条件对苦水玫瑰中抗氧化物质提取物抗氧化能力影响的等高线和响应面图见图7~图12。
液料比和乙醇浓度对苦水玫瑰花瓣提取物抗氧化能力的影响(图7)结果显示:当总抗氧化能力达到3231μmol·g-1时,随着液料比的增加,乙醇浓度需相应增加,当乙醇浓度超过58%时,液料比增加,其总抗氧化能力不会再提高。因此将液料比控制在20∶1和30∶1之间,乙醇浓度在35%~58%之间时,总抗氧化能力可达到本次实验中的最大值。
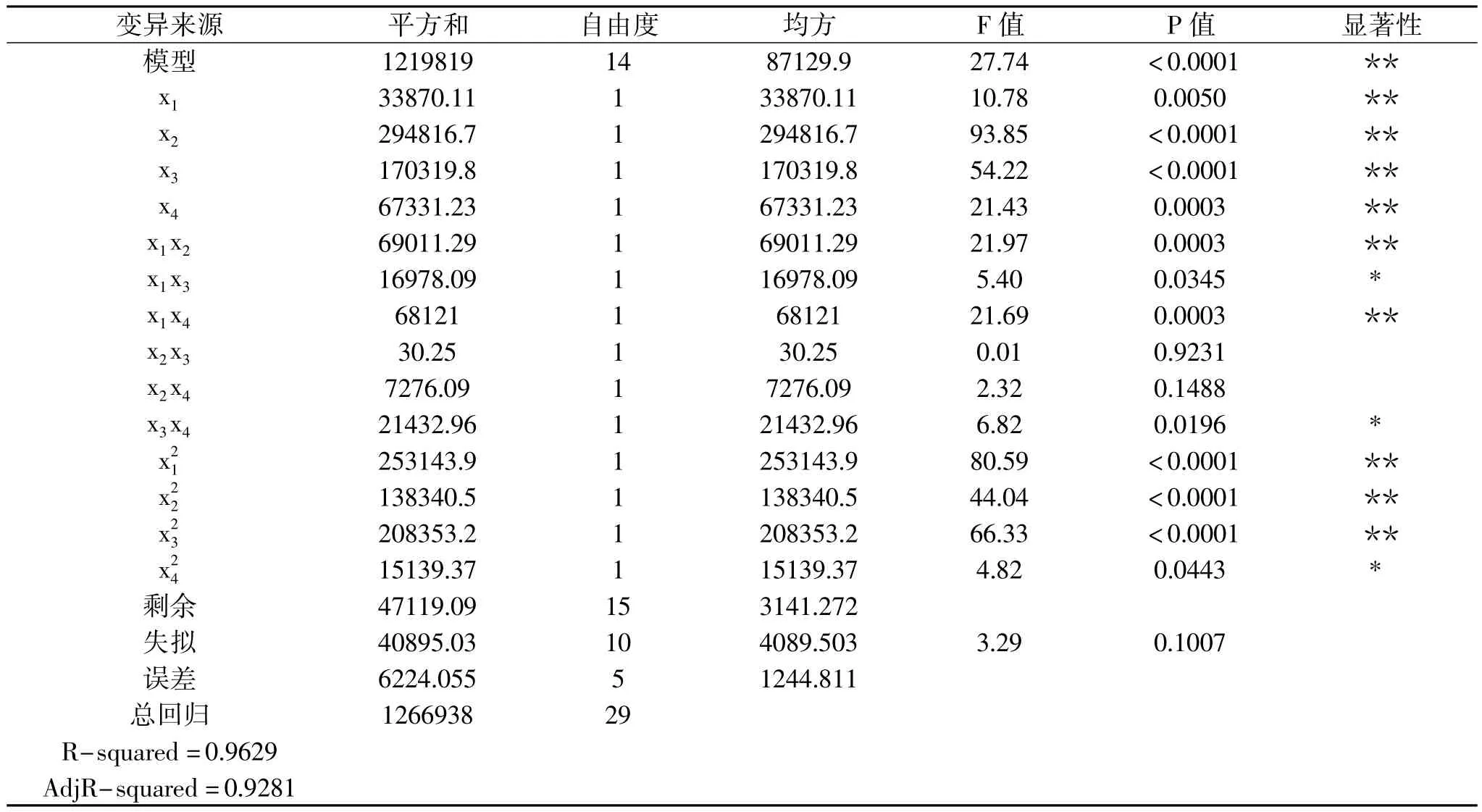
表3 中心旋转组合设计方差分析表

图7 液料比与乙醇浓度对苦水玫瑰抗氧化成分提取影响的等高线和响应面
响应面分析温度与乙醇浓度对苦水玫瑰花瓣提取物抗氧化能力的影响(图8)结果显示:温度与乙醇浓度存在着协同作用,即在一定浓度区域内,只有两者同时升高或同时降低,才能提高总抗氧化能力。当二者分别在温度为75~95℃和乙醇浓度为34%~52%时总抗氧化能力最高,达到3206μmol·g-1。两者之间等高线的形状呈椭圆形,表明交互影响作用很显著[16]。
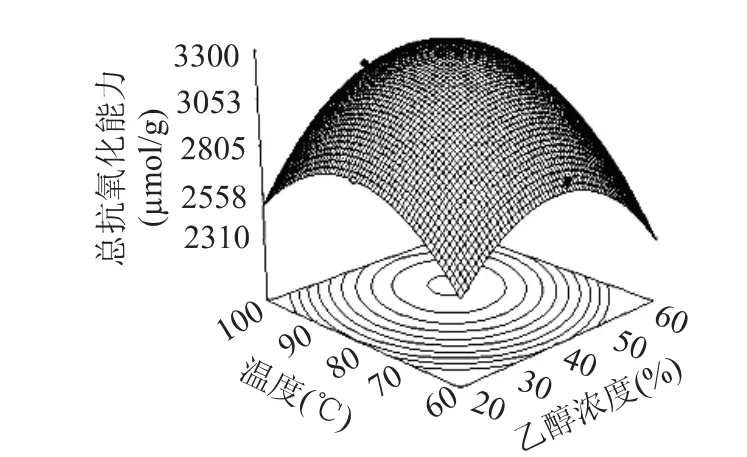
图8 温度与乙醇浓度对苦水玫瑰抗氧化成分提取影响的等高线和响应面
时间与乙醇浓度对苦水玫瑰花瓣提取物抗氧化能力的影响(图 9)结果显示:当浸提时间大于60m in,乙醇浓度在25%~50%之间时,总抗氧化能力有最大值,为 3217μmol· g-1,当浸提时间小于60m in,乙醇浓度高于50%或低与25%时,总抗氧化能力下降。

图9 时间与乙醇浓度对苦水玫瑰抗氧化成分提取影响的等高线和响应面
温度与液料比对苦水玫瑰花瓣提取物抗氧化能力的影响(图10)结果显示:温度在75~95℃之间时,液料比在18∶1到28∶1之间时提取物总抗氧化能力达最大值,为 3231μmol·g-1。液料比小于 18∶1 时,其对总抗氧化能力的影响较大,液料比大于18∶1时,其对总抗氧化能力影响趋势趋于平缓。
时间与液料比对苦水玫瑰花瓣提取物抗氧化能力的影响(图11)结果显示:当液料比小于20∶1时,随着浸提时间的延长,提取物总抗氧化能力逐渐增大,当液料比大于20∶1时,60min前浸提时间对总抗氧化能力的影响显著,90m in后浸提时间对提取物总抗氧化能力无显著影响。

图10 温度与液料比对苦水玫瑰抗氧化物质提取影响的等高线和响应面

图11 时间与液料比对苦水玫瑰抗氧化物质提取影响的等高线和响应面
时间与温度对苦水玫瑰花瓣提取物抗氧化能力的影响(图12)结果显示:浸提时间大于90m in,提取温度在75~95℃区间内时,提取物总抗氧化能力最大,为 3284μmol·g-1。当浸提时间小于 90m in 或温度高于95℃或低于75℃时,提取物的总抗氧化能力均呈下降趋势。

图12 时间与温度对苦水玫瑰抗氧化物质提取影响的等高线和响应面
3 结论

苦水玫瑰中抗氧化物质提取的最适工艺条件为:乙醇浓度 50%、液料比 25∶1、温度 90℃、时间120min。在此条件下,苦水玫瑰中抗氧化成分提取物的总抗氧化能力的预测值为3365μmol·g-1,验证实验所得值为3343.9μmol·g-1,实际值与预测值之间的相对误差为0.63%。
[1]Risal S,Adhikari D,Alurkar VM,et al.Oxidative stress and antioxidant status in cardiovascular diseases in population of western Nepal[J].Kathmandu University Medical Journal,2006,4(3):271-274.
[2]Zhang Wei-Min,Li Bin,Han Lin et al.Antioxidant activities of extracts from areca(Arecacatectu L.)flower,husk and seed[J].African Journal of Biotechnology,2009,8(16):3887-3892.
[3]Sue Jing Wu,Lean Teik Ng,Chun Ching Lin.Antioxidant Activities of Some Common Ingredients of Traditional Chinese Medicine,Angelica sinensis,Lycium barbarum and Poriacocos[J].Phytoherapy Research,2004,18:1008-1012.
[4]E Nikkhah,M Khayami,R Heidari.In vitro antioxidant activity of berry(Morus alba var.nigra)[J].International Journal of Plant Production,2009,3(4):15-18.
[5]Kelly Wolfe,Xianzhong WU.Antioxidant Activity of Apple Peels[J].Journal of Agriculture and Food Chemistry,2003,51:609-614.
[6]Dilip Ghosh,Tetsuya Konishi.Anthocyanins and anthocyanin-rich extracts:role in diabetes and eye function[J].Asia Pac J Clin Nutr,2007,16(2):200-208.
[7]Xiangqun Gao,Lars Björk,Viktor Trajkovski,et al.Evaluation of antioxidant activities of rosehip ethanol extracts in different test systems[J].JSci Food Agric,2000,80:2021-2027.
[8]Hashidoko Y.The phytochemistry of rosa rugosa[J].Phytochemistry,1996,43:535-549.
[9]薛敦渊,陈宁,李兆琳,等.苦水玫瑰鲜花香气成分研究[J].植物学报,1989,31(4):289-295.
[10]周学森,蒋玉梅,毕阳等.苦水玫瑰精油提取及其成分的GC/MS 分析[J].食品工业科技,2009,30(11):226-229.
[11]赖丽芳.永登苦水玫瑰的生产现状与发展前景[J].甘肃科技,2003,19(6):104-105.
[12]周围,周小平,赵国宏,等.中国苦水玫瑰油香气成分的研究[J].色谱,2002,20(6):560-564.
[13]邵大伟.玫瑰花蕾抗氧化能力的研究[D].山东农业大学,2008.
[14]Benzuie I F F,Strain J J.The Ferric Reducing Ability of Plasma(FRAP)as a Measure of“Antioxidant Power”:The FRAP Assay[J].Analytical Biochemistry,1996,239:70-76.
[15]H N Sin,S Yus of.Optimization of hot water extraction for sapodilla juice using response surface methodology[J].Journal of Food Engineering,2006,74:352-358.
[16]王允祥,吕凤霞,陆兆新.杯伞发酵培养基的响应曲面法优化研究[J].南京农业大学学报,2004,27(3):89-94.
Optimization of extraction technology of antioxidant components from R.Setate×R.Rugosa using response surface methodology
LI Peng-fei,JIANG Yu-mei*,LI Ji-xin,BI Yang,AI Na-si
(Food Science and Engineering College of Gansu Agricultural University,Lanzhou 730070,China)
A central composite design was employed to op timize the extraction conditions of antioxidant components from R.Setate ×R.Rugosa by ethanol with four factors:ethanol concentration,the ratio of liquid to solid,temperature and extraction time.And the combined effects of these variables on totalantioxidant power were investigated.Results showed that the generated regression models adequately explained the data variation and significantly rep resented the actual relationship between the independent variables and the responses.The results indicated that the effect order of four factors was as follows:temperature,liquid to solid,ethanol concentration and time.The canonical analysis revealed that the optimal conditions for extraction were:ethanol concentration 50%,the ratio of liquid to solid 25∶1,temperature 90℃,time 120m in.Under optimal conditions,the predicted value of the total antioxidant capacity was 3365μmol·g-1,the testing value was 3343.9μmol·g-1,and its relative error was 0.63%.There were no obvious difference between the testing value and theoretic values from regression equation and the regression model was fitted well.
R.Setate×R.Rugosa;antioxidant capacity;response surface methodology
TS201.1
B
1002-0306(2011)07-0278-05
2010-07-08 *通讯联系人
李鹏飞(1985-),男,在读硕士,研究方向:天然产物。
科技人员服务企业行动项目(2009GJG10042)。
