可卡因戒断对大鼠睡眠结构和脑电功率谱的影响*
2011-10-24洪芬芳涂桂林杨树龙贺长生
洪芬芳, 涂桂林, 杨树龙, 贺长生
(南昌大学医学院1实验教学部,2生理教研室,江西 南昌 310006;3井冈山市卫生监督所,江西 井岗山 343600)
可卡因戒断对大鼠睡眠结构和脑电功率谱的影响*
洪芬芳1▲, 涂桂林1▲, 杨树龙2△, 贺长生3
(南昌大学医学院1实验教学部,2生理教研室,江西 南昌 310006;3井冈山市卫生监督所,江西 井岗山 343600)
目的探索可卡因戒断对睡眠觉醒活动的影响。方法大鼠体内植入无线发射器,用药前、停药第1 d(急性)、8 d(亚急性)、14 d(亚慢性)记录自由活动大鼠脑电波24 h。结果停药第1 d睡眠觉醒周期上升(P<0.05)。停药第8 d夜晚和白天,非快动眼睡眠(NREM)增加(P<0.05),快动眼睡眠(REM)下降(P<0.01);停药第14 d,NREM睡眠夜晚显著增加(P<0.01)而白天仅略加强,白天和夜间REM睡眠均明显下降(P<0.01)。停药期间白天和夜间总睡眠无明显变化。整个实验期间,NREM、REM睡眠和觉醒状态的δ、θ 和α脑电功率谱均无显著变化。结论可卡因戒断所致睡眠障碍主要由于快、慢波睡眠间而非睡眠与觉醒间异动。急性戒断造成睡眠觉醒间转换异常,而睡眠结构失调则发生在亚急性和亚慢性戒断期间。
可卡因; 快动眼睡眠; 非快动眼睡眠; 脑电图
可卡因停药常导致戒断症状,如烦躁不安、食欲改变、疲劳、做生动或不愉快的梦,以及增加或减少睡眠和精神活动[1]。国外有一些来自临床滥用可卡因和/或戒断该药物造成睡眠失调的报道。在可卡因戒断第1周,快动眼睡眠(rapid eye movement, REM)潜伏期显著缩短、REM睡眠所占百分比和REM密度增加,总睡眠时间延长[2]。在可卡因戒断第3周,其睡眠模式类似慢性失眠,譬如睡眠潜伏期延长,睡眠起始后觉醒时间异常增加,以及睡眠效率差。急性和亚急性戒断后,可卡因滥用者总睡眠和REM睡眠增加[3]。用6个频带(δ、θ、慢速和快速α、慢速和快速β)脑电功率分析显示可卡因滥用者没有脑电图异常[4]。尽管有这些研究进展,但其中不确定性甚至相矛盾是显见的[5-8]。目前国外有关研究多集中在人吸食可卡因成隐方面,有关动物实验相对较少,而国内未见类似研究报道。本研究拟在大鼠体内植入无线发射器,采用国际先进的皮层脑电遥测技术,进一步探讨可卡因戒断对睡眠活动的影响规律。
材 料 和 方 法
1试剂和仪器
可卡因盐酸盐(Sigma)溶于0.9%无菌生理盐水中,并经1个微过滤器对可卡因进行过滤后使用。SN-2型脑立体定位仪,Tokyo Narishige科学仪器实验室生产;TA11CTA- F40型无线发射器,DSI公司生产(由韩国忠北大学药理毒理研究室吴教授提供);Eagle PC30型AD转换器,DSI公司生产;睡眠分析软件SleepSign 2.1,KISSEI Comtec公司生产。
2方法
2.1动物和手术 雄性SD大鼠(250-350 g,n=30),购于南昌大学医学实验动物中心。单独饲养,活动不受限制,自由摄食饮水。所有大鼠均置于明∶暗为12 h∶12 h(光照07∶00-19∶00)通风环境中,室温 (22±2) ℃。经过3 d驯化期,大鼠腹腔注射戊巴比妥钠 (50 mg/kg)麻醉后,将头部固定于立体定位仪上,暴露颅骨,双氧水清洁颅骨表面。将1个无线发射器植入皮下偏离中线肩胛骨后面,发射器导联经皮下走行,其裸露的终端通过头骨孔,按Paxinos和Watson大鼠立体定位图谱安放在硬脑膜接触处[A: 2.0 mm (前囟), L: 1.5 mm; P: 7.0 mm(前囟), L: 1.5 mm对侧],该电极以牙科水泥固定于颅骨上。如文献[9]所述,发射器通过遥感勘测记录脑电活动。
2.2实验分组和可卡因给药 雄性SD大鼠30只按随机方法分为可卡因急性戒断、亚急性戒断和亚慢性戒断3组,每组10只。手术恢复1周后,按20 mg/kg给大鼠皮下注射可卡因,每天1次共7 d。在用药前(基础记录作为对照组)、可卡因停药第1 d(急性戒断)、第8 d(亚急性戒断)和第14 d(亚慢性戒断)分别记录各组自由活动大鼠睡眠觉醒脑电活动24 h,见图1A。
2.3数据采集 皮层脑电遥测和活动记录按照以前报道方法[9]。脑波信号检测时,信号发射机增益定为-0.5 /+0.5V/U× 2,从发射器产生的原始信号频率范围为0.5-20.0 Hz。这些信号由数据科学模拟转换器进行处理并传递给连接在计算机上的1个AD转换器。AD转换器在128 Hz将脑电活动信号数字化,数字化的数据再传输到电脑以图像的形式显示出来。经Hanning窗处理后,一种在线快速傅立叶变换(fast Fourier transformation, FFT)以每2 s 256个样本完成对脑电数据加工。该FFT以0.5 Hz分辨率分析产生的功率强度从0.0到20.0Hz。FFT数据每10 s为单位在0-20 Hz范围进一步平均。每10 s睡眠数据和FFT结果保存到计算机硬盘以备进一步离线分析。与遥测接收器有关的动物运动产生晶体管逻辑(transistor-transistor logic, TTL)脉冲可以收集来计数动物活动。
2.4行为状态和脑电功率谱分析测定 使用睡眠分析软件SleepSign 2.1,从10 s作为时间参考标准的特定瞬时的数字化数据中,分析测定觉醒、非快动眼睡眠(non-rapid eye movement, NREM)和REM睡眠状态下各自所用的时间量。简单来说,如图1B 所示,该软件将觉醒识别为高频低幅脑电图; NREM睡眠是基于脑电慢波内散布梭形波来计分的。REM睡眠脑电功率是低频δ波(0.8-4.0 Hz)明显减少,θ波(活动范围5.0-9.0 Hz,峰值在7.5 Hz)则增加。先对NREM、REM和总睡眠(NREM+REM)状态所用的时间和睡眠觉醒周期进行处理,以获得每只大鼠白天和夜间各12 h总量。再进一步计算觉醒、NREM和REM睡眠状态各自所占用的时间。以0.5赫兹为单元从0.5-20.0 Hz,计算每只大鼠脑电记录整个白天和夜间各12 h觉醒、NREM和REM睡眠期间脑电绝对功率谱。选择3个频段[δ波(0.8-4.5 Hz)、θ波(5.0-9.0 Hz)和α波(8.0-13.0 Hz)],对每只大鼠觉醒、NREM和REM睡眠状态下的脑电功率谱进行评估。
3统计学处理
结 果
1可卡因戒断对睡眠/觉醒周期数的影响
通过检测可卡因停药第1、8和14 d后睡眠/觉醒周期数,研究了睡眠觉醒过渡转变是否受可卡因停药影响。我们观察到停药第1 d的日间和夜间,睡眠/觉醒周期数均显著升高(P<0.05),但在戒断后的第8、14 d,睡眠/觉醒周期又返回到基础水平,见图2。

Figure 1. Schematic representation of the experimental design and electroencephalogram (EEG) patterns in the stages of rat sleep. A:a time-line illustration of the sequence of events throughout all the experiments and the number for each examination; B:a representative EEG pattern of NREM, REM sleep and wakefulness stage.
图1整体实验设计和大鼠动眼、非动眼睡眠和觉醒状态脑电特征记录图
2可卡因戒断对大鼠睡眠结构的影响
我们接着考察了急性、亚急性和亚慢性可卡因戒断对睡眠结构的影响。在用药前(对照组)和可卡因停药后第1、第8和第14 d,我们测量了24 h不受打扰的大鼠睡眠觉醒活动。如图3所示,可卡因停药第1 d,无论白天和夜间NREM睡眠轻微减少,而REM睡眠略有增加(P>0.05);停药第8 d的夜晚和白天,NREM睡眠明显增加(分别为P<0.01和P<0.05),REM睡眠则显著下降(P<0.01);戒断第14 d,NREM睡眠在夜晚显著增加(P<0.01)而白天仅略微增加,无论白天和夜间REM睡眠均明显下降(P<0.01)。但在可卡因停药期间,总睡眠时间无论白天和夜间均未见明显变化。
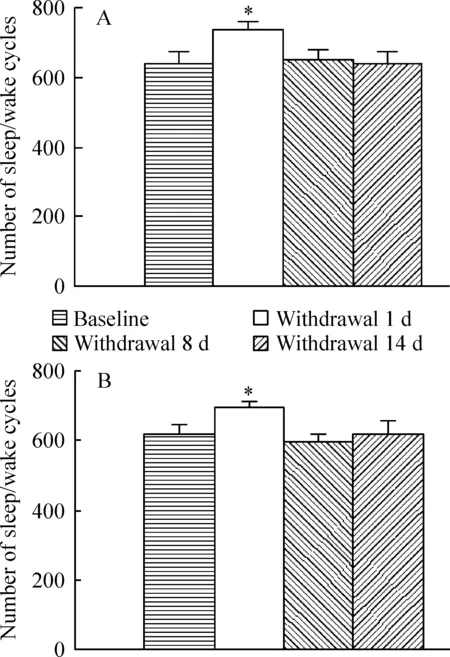

图2可卡因戒断第1、第8和第14d睡眠/觉醒周期变化
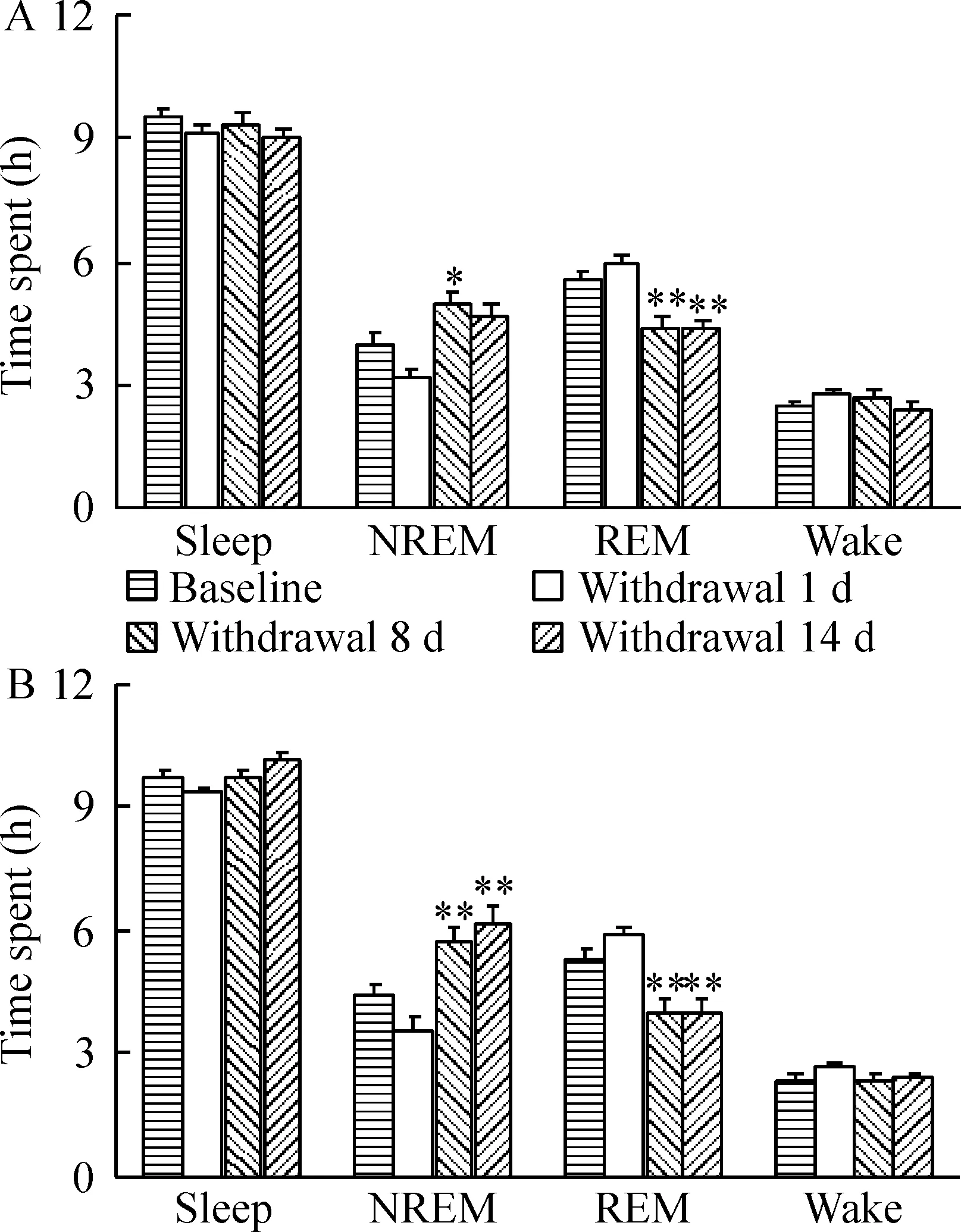

图3可卡因戒断第1、第8和第14d睡眠结构的变化
3可卡因戒断对NREM和REM睡眠和觉醒期间脑电功率谱的影响
与用药前的基础水平相比较,在整个实验期间,无论白天或夜间,在NREM(图4 A、B)、REM(图4 C、D)睡眠和觉醒(图4 E、F)状态下的δ、θ和α波功率谱百分比均没有因可卡因戒断而发生显著变化(P>0.05)。

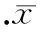
图4可卡因戒断第1、第8和14d,NREM、REM睡眠和觉醒状态脑电功率谱变化
讨 论
在目前的实验中,我们使用先进的无线遥测技术对大鼠的脑电活动进行了研究,这在国内尚无先例。我们观察到可卡因急性戒断降低了睡眠/觉醒周期数,及至亚急性和亚慢性戒断,睡眠/觉醒周期从紊乱重新回归正常,见图2。此结果与以前的报道一致[10],表明急性戒断期间睡眠质量较低,睡眠和觉醒状态之间存在过渡转变障碍。
有证据表明可卡因给药当晚快动眼睡眠被抑制[5-7]。停药后数天内出现反弹,表现为REM睡眠潜伏期减少和REM睡眠时间增加。另外,可卡因实验室给药在当晚增加了慢波睡眠活动,但由于在停药头几天快波睡眠增加,慢波睡眠降低了[5,8]。当停药进入第3周时,快动眼睡眠则降低到非常低的水平,慢波活动相应地增加。同样,本实验结果显示急性可卡因戒断降低了白天和夜间NREM睡眠,REM睡眠则略有上升。亚急性戒断增加NREM睡眠;亚慢性戒断明显增加夜间NREM,仅略加强日间NREM睡眠;亚急性和亚慢性戒断同时降低了白天和夜间REM睡眠;但总的睡眠时间并没有明显变化,见图3。可见,急性、亚急性和亚慢性可卡因戒断导致的睡眠结构紊乱主要存在于NREM和REM睡眠之间,而睡眠和觉醒之间未见明显的异常变化。此结果部分得到多数文献支持[3, 7, 10-12]。但与个别报道[10]差异较大,该研究注意到每天早晨给大鼠注射可卡因能引起觉醒增加并伴随慢波睡眠(slow-wave sleep, SWS)1、SWS2和快波睡眠(paradoxical sleep, PS)减少,随后出现黑暗阶段SWS2和PS反弹[10]。这些差异可能由于不同的实验设计和不同的实验对象、可卡因使用剂量不同,以及戒断时间不一样[5-8]。可卡因是最知名的加强人精神活力药物之一[13]。推测在本实验中,可卡因皮下注射(20 mg/kg,皮下给药7 d)可能直接和/或间接地激活觉醒系统,如组胺、胆碱能和hypocretin神经元,减少NREM睡眠。此作用与剥夺睡眠造成的结果类似。急性戒断并不能抵消可卡因的这种影响,但亚急性和亚慢性戒断则导致了NREM睡眠的反弹性增加。
此外,在整个戒断期间,无论白天和夜晚,以及无论睡眠或觉醒状态下,δ、θ和α波功率百分比均未见显著改变,提示可卡因戒断没能造成脑电功率谱的异常变化。同样,Bauer等[4]在可卡因依赖期间没有发现脑电绝对功率存在明显异常 ,支持我们的观点。
总之,本实验显示可卡因急性戒断主要造成睡眠/觉醒状态过渡紊乱,而睡眠结构功能障碍则发生在亚急性和亚慢性戒断期间。此结果进一步揭示了与可卡因戒断相关睡眠障碍的特点,提出了治疗可卡因成瘾的重要见解,从而为临床更好地治疗精神兴奋剂成瘾患者提供了进一步的实验依据。
(致谢:真诚感谢韩国忠北大学药理毒理研究室吴教授在本实验完成中给予的大力支持和帮助。)
[1] Walsh SL, Stoops WW, Moody DE, et al.Repeated do-sing with oral cocaine in humans: assessment of direct effects, withdrawal, and pharmacokinetics[J]. Exp Clin Psychopharmacol,2009,17(4):205-216.
[2] Kowatch RA, Schnoll SS, Knisely JS, et al. Electroencephalographic sleep and mood during cocaine withdrawal[J].J Addict Dis,1992,11(4):21-45.
[3] Thompson PM, Gillin JC, Golshan S, et al. Polygraphic sleep measures differentiate alcoholics and stimulant abusers during short-term abstinence[J]. Biol Psychiatry,1995,38(12):831-836.
[4] Bauer LO, Kranzler HR. Electroencephalographic activity and mood in cocaine-dependent outpatients: effects of cocaine cue exposure[J]. Biol Psychiatry,1994,36(3):189-197.
[5] Morgan PT, Pace-Schott EF, Sahul ZH, et al. Sleep architecture, cocaine and visual learning[J]. Addiction,2008,103(8):1344-1352.
[6] Johanson CE, Roehrs T, Schuh K, et al. The effects of cocaine on mood and sleep in cocaine-dependent males[J]. Exp Clin Psychopharmacol,1999,7(4):338-346.
[7] Watson R, Bakos L, Compton P, et al. Cocaine use and withdrawal: the effect on sleep and mood[J]. Am J Drug Alcohol Abuse,1992,18(1):21-28.
[8] Morgan PT, Pace-Schott EF, Sahul ZH, et al.Sleep, sleep-dependent procedural learning and vigilance in chronic cocaine users: Evidence for occult insomnia[J]. Drug Alcohol Depend,2006,82(3):238-249.
[9] Sanford LD, Yang L, Liu X, et al. Effects of tetrodotoxin (TTX) inactivation of the central nucleus of the amygdala (CNA) on dark period sleep and activity[J]. Brain Res,2006,1084(1):80-88.
[10] Dugovic C, Meert TF, Ashton D, et al. Effects of ritanserin and chlordiazepoxide on sleep-wakefulness alterations in rats following chronic cocaine treatment[J].Psychopharmacology,1992,108(3):263-270.
[11] Pace-Schott EF, Stickgold R, Muzur A, et al. Sleep quality deteriorates over a binge-abstinence cycle in chronic smoked cocaine users[J]. Psychopharmacology,2005,179(4):873-883.
[12] Gillin JC, Pulvirenti L, Withers N, et al. The effects of lisuride on mood and sleep during acute withdrawal in stimulant abusers: a preliminary report[J]. Biol Psychiatry,1994,35(11):843-849.
[13] Hack SP, Christie MJ. Adaptations in adenosine signaling in drug dependence: therapeutic implications[J]. Crit Rev Neurobiol,2003,15(3-4):235-274.
Effectsofcocainewithdrawalonsleeparchitectureandcorticalelectroencephalogrampowerspectrainrats
HONG Fen-fang1, TU Gui-lin1, YANG Shu-long2, HE Chang-sheng3
(1DepartmentofExperimentalTeaching,2Departmentofphysiology,MedicalCollegeofNanchangUniversity,Nanchang310006,China;3HealthSupervisionStationofJinggangshan,Jinggangshan343600,China.E-mail:slyang@ncu.edu.cn)
AIM: To study the characteristics of sleep disturbances resulting from cocaine withdrawal.METHODSAdult rats were instrumented with sleep-wake recording electrodes. Polygraphic signs of undisturbed sleep-wake activities were recorded for 24 h before cocaine administration, on withdrawal day 1 (acute), day 8 (subacute), and day 14 (subchronic) during cocaine treatment.RESULTSThe sleep-wake cycles increased on withdrawal day 1 (P<0.05). Non-rapid eye movement (NREM) sleep increased during nighttime (P<0.01) and daytime (P<0.05) on withdrawal day 8. The increase in NREM sleep was significant during nighttime (P<0.01) and slight during daytime on withdrawal day 14, whereas the rapid eye movement (REM) sleep was reduced during both daytime and nighttime (P<0.01) on withdrawal day 8 and 14. In either daytime or nighttime period, no significant change was observed in the total sleep time during cocaine abstinence. During NREM and REM sleep as well as wakefulness, no difference was found in δ-, θ- and α-wave power density on withdrawal day 1, 8 and 14.CONCLUSIONSleep disturbance induced by acute, subacute, or subchronic cocaine withdrawal is predominantly due to abnormal alterations between NREM and REM sleep but not between sleep and wakefulness. The transition of sleep-wakefulness state is mostly disturbed during acute withdrawal, while sleep architecture dysfunction occurs during subacute or subchronic withdrawal.
Cocaine; Rapid eye movement; Non-rapid eye movement; Electroencephalogram
R363
A
10.3969/j.issn.1000-4718.2011.01.015
1000-4718(2011)01-0077-05
2010-07-12
2010-09-25
江西省教育厅科研基金资助项目(No. 2008GJJ09038);江西省卫生厅科技计划资助项目(No. 20073183);南昌大学引进博士科研启动基金(No.300304)
△通讯作者 Tel:0791-8601308;E-mail: slyang@ncu.edu.cn
▲ 并列第1作者
