后肾细胞微环境诱导胚胎干细胞向肾系细胞分化的实验研究*
2011-10-24张立行王共先娄远蕾阮琼芳崔苏萍
汪 泱, 张立行, 王共先, 谢 安, 娄远蕾, 阮琼芳, 崔苏萍, 杨 阳
(南昌大学泌尿外科研究所, 江西 南昌 330006)
后肾细胞微环境诱导胚胎干细胞向肾系细胞分化的实验研究*
汪 泱△, 张立行, 王共先, 谢 安, 娄远蕾, 阮琼芳, 崔苏萍, 杨 阳
(南昌大学泌尿外科研究所, 江西 南昌 330006)
目的探讨胚胎后肾细胞微环境诱导胚胎干细胞(ESCs)分化为肾系细胞的作用。方法小鼠D3系胚胎干细胞通过悬滴法制备拟胚体(EBs),将EBs细胞与取自孕12.5 d小鼠胚胎的后肾细胞通过间接共培养以诱导其分化,即为共培养诱导组,设EBs细胞自然分化为对照组;采用免疫荧光染色法检测共培养第3、5、7 d后的EBs细胞Pax2、WT-1蛋白表达情况,通过逆转录PCR法检测诱导3 d后的EBs细胞Pax2、WT-1、Lim1、Sall1、Emx2、GDNF、Wnt4、BMP7、Nephl、Nephrin、KSP和CD24 mRNA的表达情况。结果EBs细胞在诱导的第3 d即出现了全部肾发育相关基因的表达,其中共培养组Pax2、WT-1、Emx2、GDNF、Nephl、Nephrin、KSP和CD24的表达强于对照组;免疫荧光结果显示在诱导3 d后的EBs细胞中可观察到Pax2阳性细胞,阳性细胞数在共培养第5、7 d增多;诱导5 d后可观察到WT-1阳性细胞,对照组未见Pax2或WT-1蛋白阳性细胞出现。结论后肾细胞微环境可促进ESCs分化为肾系细胞。
胚胎干细胞; 后肾细胞; 肾系细胞
急性肾衰竭的主要病因是各种原因导致的急性肾小管损伤,其转归依赖于肾内存留的正常肾细胞数或具有修复作用的成体肾干细胞数目。目前,研究者致力研究修复损伤肾脏的方向之一是利用干细胞补充受损的肾细胞,其可能细胞来源包括胚胎干细胞(embryonic stem cells, ESCs)和自体的各种成体干细胞。成体干细胞的多向分化能力有限,而ESCs可分化为成体器官内不同胚层的所有细胞,显示出其独特的优势。肾脏是由多种细胞组成的复杂器官,研究ESCs向肾脏细胞定向分化可为肾损伤的修复再生提供种子细胞的新来源。本研究拟将小鼠ESCs形成的拟胚体(embryoid bodies, EBs)细胞与分离自E12.5 d胎鼠的后肾细胞间接接触共培养,体外模拟胚胎肾脏发育微环境,观察ESCs向肾脏细胞定向分化状况,为进一步建立ESCs向肾脏细胞定向分化的技术及研究ESCs分化为肾细胞的分子机制提供实验基础。
材 料 和 方 法
1材料
1.1细胞株 小鼠D3胚胎干细胞株(ES-D3)购自中科院上海生命科学院生物化学与细胞生物学研究所,小鼠后肾细胞和小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)均提取自昆明小鼠孕12.5 d(E12.5 d,观察到阴道栓计孕0.5 d)胎鼠。昆明小鼠购自南昌大学医学院动物科学部。
1.2主要试剂和仪器 H-DMEM、0.05% EDTA/胰蛋白酶、非必需氨基酸、L-谷氨酰胺均购自Gibco。胎牛血清购自Hyclone。2-巯基乙醇购自Merk。丝裂霉素C购自Roche。兔抗小鼠WT-1抗体购自Neomarkers。兔抗小鼠Pax2抗体购自Abcam。罗丹明标记的牛抗兔IgG购自Chemicon。倒置相差荧光显微镜(IX71)和体视显微镜均为Olympus产品。
2方法
2.1ES-D3细胞的培养及诱导EBs形成 将ES-D3细胞单细胞悬液添加到预先用丝裂霉素C处理过的MEF饲养层细胞上,ESCs培养液包含H-DMEM、20% 胎牛血清、0.1 mmol/L 2-巯基乙醇、0.1 mmol/L 非必需氨基酸和2 mmol/L L-谷氨酰胺,细胞放于37 ℃、5% CO2、饱和湿度孵箱(Thermo)培养。制备EBs时,将脱离MEF饲养层细胞的ES-D3细胞制备为单细胞悬液,调整细胞密度为约800-1 000 cells/30 μL,通过悬滴法培养制作EBs,在悬滴法培养的第3 d观察并收集EBs,所用培养液为ESCs培养液。
2.2小鼠胚胎肾细胞的制备 取E12.5 d的孕鼠,无菌条件下打开腹腔,取出胎鼠,在体视显微镜下分离后肾。后肾提取方法参照文献[2]。即取E 12.5d胎鼠放置在30 mm塑料培养皿中,用无菌眼科镊子打开胎鼠腹腔,体视显微镜下在胎鼠神经管两侧胎鼠后肢芽水平面附近找到小鼠后肾,取出胎鼠后肾置入培养皿中。将取出的后肾组织用生理盐水清洗2遍,剪成1 mm×1 mm×1 mm小块后以0.05% EDTA/胰蛋白酶消化,调节细胞密度为1×108cells/L,种植到12孔Transwells(Costar)的插入式小皿中,细胞培养液为ESCs培养液。
2.3EBs细胞与胚胎后肾细胞间接接触共培养 将悬滴法制备的EBs加入12孔细胞培养板中,每孔加入的EBs为10-20个。共培养组:采用Transwells进行间接接触共培养,即将后肾细胞接种培养于Transwells的插入小皿中,EBs细胞培养于12孔板的小孔中,2种细胞进行间接接触共培养,细胞分泌的因子可通过插入小皿的半透膜相互交换,但细胞间没有直接接触;自然分化对照组:于12孔细胞培养板中常规培养EBs细胞。每天半量换液,共培养3 d后,每天全量换液,培养液为ESCs培养液。
2.4RT-PCR法检测EBs细胞肾脏发育相关基因的表达 在共培养第3 d,按Trizol试剂盒说明(Invitrogen)分别提取共培养组、对照组和E 12.5 d后肾组织的总RNA。按照RevertAidTMH Minus First Strand cDNA Synthesis Kit说明书(Fermentas)两步法逆转录总RNA。PCR反应引物均由上海生物工程公司合成,引物序列及退火温度见表1。PCR反应参数分别是:94 ℃预变性5 min,94 ℃ 30 s,58-67 ℃ 30 s,72 ℃ 30 s,32个循环,最后72 ℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳分离检测。

表1 引物序列和退火条件
2.5间接免疫荧光染色法检测Pax2、WT-1蛋白的表达 在共培养第3、5、7 d按照间接免疫荧光法,分别检测共培养组和对照组EBs细胞Pax2、WT-1蛋白表达情况,即将EBs细胞用PBS清洗后加入4%多聚甲醛固定20 min,加入1%牛血清白蛋白(Roche)封闭20 min,再分别滴加兔抗小鼠Pax2、WT-1抗体,4 ℃饱和湿度孵育过夜,PBS充分洗涤后滴加罗丹明标记的牛抗兔IgG,37 ℃孵育1 h,清洗后加入50 mg/L 4, 6-二乙酰基- 2-苯基吲哚(DAPI, Sigma) 衬染5 min。PBS洗涤后,荧光显微镜下观察并记录拍照。
结 果
1细胞形态变化
生长在MEF饲养层细胞上的ES-D3细胞形成相互分离的圆形或椭圆形细胞集落,细胞集落边缘清楚,见图1A。ES-D3细胞通过悬滴法制备的EBs呈圆球状悬浮于ESCs培养液中,细胞透亮活性较好,见图1B。单独分离培养的后肾细胞大多呈现成体肾小管细胞样的铺路石样细胞集落,见图1C。EBs细胞在共培养的第1 d即贴壁,第2 d即可观察到EBs周围有少量细胞爬出,随着培养天数延长爬出细胞逐渐增多,细胞形态表现为梭形、多角形、圆形或不规则形等,见图1D。
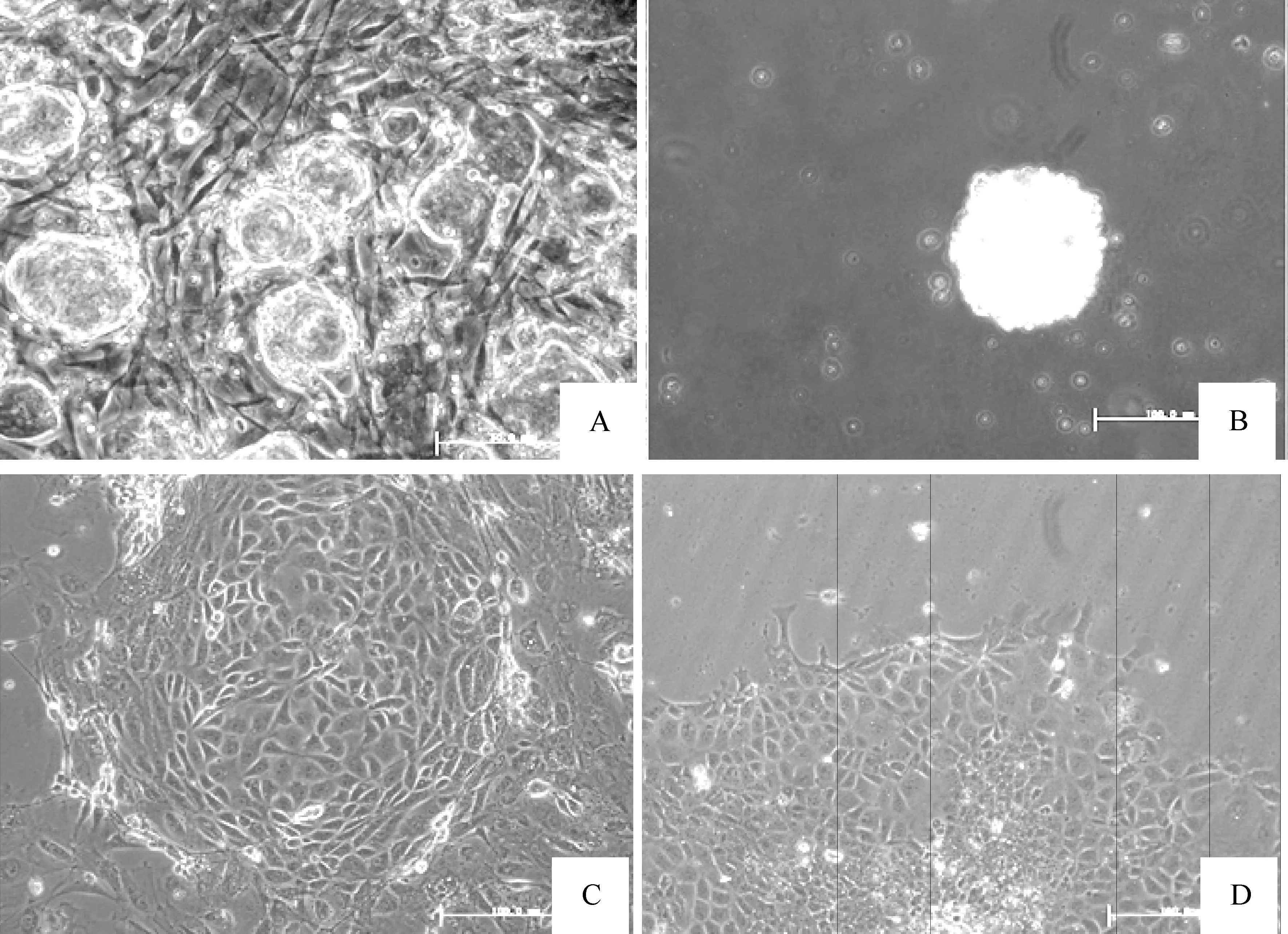
Figure 1. Morphology of mouse embryonic stem cells on MEF feeder cells(A), embryoid body(B), primary culture of mouse E12.5 d metanephric cells(C) and EBs cells co-cultured with metanephric cells for 3 d(D).Bar=100 μm.
图1小鼠胚胎干细胞、拟胚体、原代培养的胎肾细胞和3d共培养后的拟胚体细胞形态学观察
2后肾细胞微环境可促进EBs细胞表达肾脏发育相关基因
与E12.5 d后肾细胞共培养3 d后的EBs细胞,均表达所检测的12种肾脏发育相关基因,其中WT-1、Emx2、GDNF、Nephl、KSP和CD24 mRNA的表达明显强于自然分化对照组,Pax2和Nephrin mRNA的表达亦强于自然分化对照组,但无显著差异,自然分化对照组Lim1 mRNA的表达较强,Wnt4、Sall1、BMP7 mRNA的表达则在2组间相差不大,见图2。
3后肾细胞微环境促进EBs细胞表达Pax2和WT-1蛋白
与后肾细胞共培养的第3 d,即可见少数EBs细胞表达Pax2,而未见WT-1阳性表达细胞;与后肾细胞共培养的第5 d可见Pax2阳性细胞增多,亦见部分WT-1阳性细胞;随着共培养天数的延长,Pax2和WT-1阳性细胞数逐渐增多并成簇分布,且在Pax2阳性细胞中,有部分细胞呈现“指环”样排列,见图3。在自然分化对照组EBs中,未见Pax2或WT1阳性细胞。表明后肾细胞微环境可促进EBs细胞表达Pax2和WT-1。

Figure 2. mRNA expression of the genes involved in kidney development in EBs cells(RT-PCR). A: 1: EBs cells co-cultured with metanephric cells for 3 d; 2: EBs cells natural differentiated for 3 d; 3: primary cultured E12.5 d metanephric cells. B: relative expression level.*P<0.05,△P<0.01vsEBs cells natural differentiated group.
图2EBs细胞肾发育相关基因的表达

Figure 3. Pax2 and WT-1 positive cells in EBs cells. A-C: Pax2 positive cells emerged in EBs cells after 3 d co-culture(×200); J-L: WT-1 positive cells emerged in EBs cells after 5 d co-culture(×200); G-I(×200), M-O(×400) and P-R(×200): Pax2 and WT-1 positive cells number increased in EBs cells after 5 or 7 d co-culture. S-X: no Pax2 or WT-1 positive cells showed up in control groups.
图3EBs细胞Pax2和WT-1的表达
讨 论
由于肾脏组织结构复杂,有关ESCs向肾脏细胞分化的研究起步相对较晚。研究报道ESCs可向肾脏细胞分化,但调控ESCs向各种肾脏分化的关键因素及调控途径尚不清楚[1-3]。胚胎干细胞的定向分化与其所处的微环境有关,通过细胞共培养或提取细胞培养液的方法模拟发育所需微环境,研究者已经成功将ESCs诱导分化为神经元样细胞[4]、心肌细胞[5]、造血干细胞[6]等。哺乳动物成体肾脏发育来自后肾,后肾包括后肾间充质和输尿管芽两部分,二者相互诱导最终形成成体肾,因此胚胎后肾细胞可能具有诱导ESCs分化成为肾脏细胞的能力。本研究将ESCs形成的EBs细胞与E12.5 d的后肾细胞进行共培养,体外模拟肾脏发育微环境,探讨胚胎肾发育微环境定向诱导ESCs向肾细胞分化的作用,为进一步研究ESCs向肾脏细胞分化的机制及建立高效诱导ESCs向肾脏细胞定向分化的方法奠定实验基础。
本实验检测了12种肾脏发育相关基因,其中Pax2、Lim1、Sall1和WT-1基因是在后肾发育早期即后肾胚芽开始出现时的作用基因;后肾发育中期一般指从输尿管芽长入后肾间充质区,到二者相互诱导发生comma-和S-形形变的过程,GDNF、Emx2、Wnt4和BMP-7基因在此期间发挥了重要作用;而Nephl、Nehprin和KSP基因主要作用于后肾发育晚期,三者也在成熟肾脏小管上皮细胞上表达。此外,本实验还检测了肾脏祖细胞标志物CD24 mRNA的表达变化[7]。实验结果显示,与后肾细胞共培养后的ESCs表达所检测的与肾脏发育相关的12种基因,其中Pax2、WT-1、Emx2、GDNF、Nephl、Nephrin、KSP和CD24 mRNA的表达强于自然分化对照组,说明胚胎后肾微环境可促进ESCs表达肾脏发育相关基因。免疫荧光实验结果还显示,与后肾细胞共培养后的ESCs表达肾脏细胞标志蛋白Pax2和 WT-1,且部分Pax2阳性细胞呈现“指环”样排列,而自然分化对照组未见Pax2或WT1阳性细胞。表明胚胎后肾细胞微环境可促进ESCs向肾脏细胞分化。本研究结果显示ESCs在自然分化条件下亦表达肾脏发育相关基因,与Kramer等[8]的报道类似,说明ESCs形成EBs过程中已具备向内胚层细胞分化的潜能。进一步筛选胚胎后肾细胞微环境中促进ESCs向肾脏细胞分化的关键因子并深入探讨其作用途径,对于将来精确调控ESCs向肾脏各种细胞的分化具有重要意义。
[1] Yamamoto M, Cui L, Johkura K, et al. Branching ducts similar to mesonephric ducts or ureteric buds in teratomas originating from mouse embryonic stem cells[J]. Am J Physiol Renal Physiol, 2006, 290(1): F52-F60.
[2] Kim D, Dressler GR. Nephrogenic factors promote differentiation of mouse embryonic stem cells into renal epithelia[J]. J Am Soc Nephrol, 2005, 16(12): 3527-3534.
[3] Kobayashi T, Tanaka H, Kuwana H,et al. Wnt4-transformed mouse embryonic stem cells differentiate into renal tubular cells[J]. Biochem Biophys Res Commun,2005, 336(2): 585-595.
[4] 周玉峰,方 峰,付劲蓉,等. 星形胶质细胞条件培养液促进胚胎干细胞分化为神经元样细胞的实验研究[J]. 中国病理生理杂志,2006,22(12):2407-2410.
[5] Mummery C, Ward-van Oostwaard D, et al. Differentiation of human embryonic stem cells to cardiomyocytes: role of coculture with visceral endoderm-like cells[J]. Circulation, 2003, 107(21):2733-2740.
[6] 张绪超,陈惠芹,黄绍良,等. 含人AGM区基质细胞培养体系定向诱导胚胎干细胞为造血干细胞的实验研究[J]. 中国病理生理杂志,2007,23(9):1747-1751.
[7] Challen GA, Bertoncello I, Deane JA, et al. Kidney side population reveals multilineage potential and renal functional capacity but also cellular heterogeneity[J]. J Am Soc Nephrol, 2006,17(7): 1896-1912.
[8] Kramer J, Steinhoff J, Klinger M, et al. Cells differentiated from mouse embryonic stem cells via embryoid bodies express renal marker molecules[J]. Differentiation, 2006,74(2-3): 91-104.
Metanephriccellmicroenvironmentinducesembryonicstemcellstodifferentiatetowardrenalcells
WANG Yang, ZHANG Li-xing, WANG Gong-xian, XIE An, LOU Yuan-lei, RUAN Qiong-fang, CUI Su-ping, YANG Yang
(InstituteofUrology,NanchangUniversity,Nanchang330006,China.E-mail:wangy63cn@sina.com)
AIM: To explore the effects of metanephric cell microenvironment on inducing embryonic stem cells (ESCs) to differentiate toward renal cells.METHODSEmbryoid bodies (EBs) of D3 mouse embryonic stem cells were prepared by hanging drop culture, and the EBs were co-cultured indirectly with metanephric cells derived from E12.5 d mouse embryo. The EBs cell with spontaneous differentiation was used as the control. The proteins of Pax2 and WT-1 were analyzed by immunofluorescence assay. The mRNA expression of Pax2, WT-1, Lim1, Sall1, Emx2, GDNF, Wnt4, BMP7, Nephl, Nephrin, KSP and CD24 genes was detected by RT- PCR.RESULTSThe genes related to kidney development were expressed in the EBs cells after co-culture on day 3, and the mRNA expression of Pax2, WT-1, Emx2, GDNF, Nephl, Nephrin, KSP and CD24 was stronger than those in control group. Pax2 positive cells were found on day 3 in the co-cultured EBs cells, and the positive cells increased on day 5 and day 7. WT-1 protein positive cells were found in the co-cultured EBs cells on day 5. No Pax2 or WT-1 positive cell was observed in control group.CONCLUSIONMetanephric cell microenvironment promotes ESCs differentiation toward renal cells.
Embryonic stem cells; Metanephric cells; Renal cells
R363
A
10.3969/j.issn.1000-4718.2011.01.025
1000-4718(2011)01-0129-05
2010-07-28
2010-10-27
国家自然科学基金资助项目(No.30960385);江西省自然科学基金资助项目(No. 2007GZY1470)
△通讯作者 Tel:0791-8692527; E-mail: wangy63cn@sina.com
