白芍总苷对小鼠实验性牙周炎血清IgG1和IgG2a水平的影响*
2011-10-24潘倩茹吕芳丽黄世光
潘倩茹, 吕芳丽, 宋 宁, 黄世光△
(1暨南大学医学院口腔医学系, 广东 广州 510632;2中山大学医学院寄生虫教研室,广东 广州 510080;3深圳市儿童医院口腔科,广东 深圳 518026)
白芍总苷对小鼠实验性牙周炎血清IgG1和IgG2a水平的影响*
潘倩茹1, 吕芳丽2, 宋 宁3, 黄世光1△
(1暨南大学医学院口腔医学系, 广东 广州 510632;2中山大学医学院寄生虫教研室,广东 广州 510080;3深圳市儿童医院口腔科,广东 深圳 518026)
目的观察白芍总苷(TGP)对小鼠实验性牙周炎的治疗效果,分析TGP对牙周炎的免疫调节作用。方法采用清洁级12周龄雄性昆明小鼠60只,随机分成3组:(l)正常对照组;(2)牙周炎组:用浸有牙周致病菌的5-0丝线结扎小鼠左侧上颌第1磨牙牙颈部建立牙周炎模型;(3) TGP治疗组:同上法复制牙周炎模型,于建模后第5周开始用TGP灌胃。各组动物分别于建模后第4、6、8和10周处死,每组各时点处死动物数为5只。处死动物前测量牙龈指数(GI)和牙周附着丧失(AL);制作颊舌向牙体牙周组织联合切片,HE染色,显微镜下观察牙周组织学改变; ELISA法检测各组小鼠外周血清IgG1和IgG2a水平。结果(1)GI改变:牙周炎组GI在各个时点均明显高于正常对照组(P<0.05),TGP治疗组GI水平从第6周起较牙周炎组显著下降(P<0.05)。(2)AL改变:牙周炎组AL在各个时点明显高于正常对照组和TGP治疗组(P<0.05),TGP治疗组AL在 6、 8和10周时明显低于牙周炎组(P<0.05)。(3)组织学改变:牙周炎组牙周炎症破坏明显;TGP治疗组的牙周组织炎症程度较牙周炎组明显减轻,且牙周组织出现明显的修复反应。(4)血清抗体水平:与正常对照组比较,牙周炎组血清IgG1水平明显下降,IgG2a水平明显升高(均P<0.05);与牙周炎组比较,TGP治疗组血清IgG1水平明显升高(P<0.05),IgG2a水平明显下降(P<0.05)。结论TGP可能通过降低牙周炎的Th1细胞反应及提高Th2细胞反应,提高小鼠的免疫能力,减轻牙周组织的炎症程度,对牙周炎发挥治疗作用。
牙周炎; 模型,动物; 抗体; 白芍总苷
牙周疾病是一种以菌斑为始动因子的多因素慢性感染性疾病,是导致成人牙齿丧失的最主要原因。该病是革兰氏阴性厌养菌如牙龈卟啉单胞菌等对牙周组织所致慢性病理损害的结果,由细菌激发的免疫应答和炎症反应是造成牙周组织破坏的主要原因[1]。牙周炎的发病过程与Th1、Th2细胞免疫应答平衡的失调密切相关,表现为Th1细胞功能相对亢进,Th2细胞功能不足;前列腺素(prostaglandins, PGs)、一氧化氮(nitric oxide,NO)和基质金属蛋白酶(matrix metalloproteinases, MMPs)等炎症介质均参与牙周炎的形成[2]。研究表明白芍总苷(total glucosides of paeony, TGP)具有抗炎、调节免疫和止痛等作用,临床上广泛应用于类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病的治疗,但在牙周炎中的应用尚未见报道。本实验通过建立小鼠实验性牙周炎模型,观察TGP对牙周炎的治疗效果,并从细胞免疫学的角度分析其免疫调节的作用机制。
材 料 和 方 法
1材料
无特定病原体(specific pathogen free,SPF)级12周龄雄性昆明小鼠购于中山大学医学院实验动物中心;白芍提取物(TGP含量:≥66.7%,HPLC)由香港大学中医药学院陈剑萍助理教授惠赠;辣根过氧化物酶(horseradish peroxidase, HRP)标记兔抗鼠IgG1、IgG2a抗体购自北京博蕾德公司。
2方法
2.1动物分组及牙周炎动物模型的建立
① 动物分组 实验采用清洁级12周龄雄性昆明小鼠60只,体重约37-42 g,于室内采光条件良好、清洁、安静、通风良好、室温22 ℃左右、光照周期12 h∶12 h、无特殊致病菌的环境中适应性饲养1周后实验。将实验小鼠编号,按随机数字表法分成3组,每组20只:(1)正常对照组(control group):正常喂养,牙周不做特殊处理,于第5周开始用蒸馏水(0.2 mL/d)灌胃。 (2)实验性牙周炎组(experimental periodontitis group):参照Kimura等[3]的方法,用浸有牙周致病菌的5-0丝线结扎左侧上颌第1磨牙牙颈部建立实验性牙周炎模型,并于建模后第5周开始用蒸馏水(0.2 mL/d)灌胃,连续观察至第10周。(3)白芍总苷治疗组(periodontitis+TGP treatment group):同上法复制实验性牙周炎模型,于建模后5周开始用TGP混悬液(0.48 g · kg-1· d-1)灌胃,连续观察至第10周。各组小鼠分别于建模后第4、6、8和10周分批处死动物,每组各时点处死动物数为5只。
② 牙周致病菌丝线的制备 收集临床确诊为慢性牙周炎患者的牙周病变区域龈下菌斑,置于盛有1.0 mL硫乙醇酸盐溶液的小瓶中,并充分混匀,以生理盐水进行10倍系列稀释,选择稀释度为10-3的浓度接种于CDC厌氧血琼脂平板上,将5-0无菌丝线置于该琼脂平板上,在厌养菌培养箱中37 ℃培养5 d。
③ 牙周炎动物模型的建立 小鼠用0.7%戊巴比妥钠[0.1 mL/10 g BW(body weight),ip]麻醉,取仰卧位,固定四肢及头部,用1%碘酊消毒口腔及口周,用尖探针分离左侧上颌第1磨牙牙龈组织,浸有牙周致病菌的5-0丝线缠绕牙颈部2-3圈,于近中牙龈乳头处缝扎固定,在前庭沟区打结,结扎线置于龈沟内。
④ 牙周致病菌的鉴定 于建模的0 d、7 d用无菌的纸尖收集各组实验小鼠左侧上颌第一磨牙的龈下菌斑,置于1 mL转送液中,振荡分散30 s,按10倍系列稀释法稀释,取各稀释度样本液0.1 mL,分别接种于改良GAM 培养基,37 ℃厌氧培养2-5 d, 对培养的菌落进行分离和生化鉴定。
⑤ 白芍水提取物灌胃 白芍提取物按小鼠体重折算的剂量以蒸馏水配成混悬液 (0.48 g·kg-1·d-1) 灌胃,从结扎后第5周起开始灌胃给药,连续观察至第10周;正常对照组和实验性牙周炎组从第5周起每天给予等量的蒸馏水灌胃。
2.2观察指标及检测方法
① 牙龈指数(gingival index,GI)的测量 采用乙醚吸入法麻醉小鼠,取仰卧位,固定四肢及头部。采用钝头牙周探针进行探查,参照Löe法[4]测量牙龈指数,分为4级: 0表示牙龈健康;1表示牙龈轻度炎症:牙龈的颜色有轻度改变并轻度水肿,探诊不出血;2表示牙龈中等炎症:牙龈色红,水肿光亮,探诊出血;3表示牙龈严重炎症:牙龈明显红肿或有溃疡,并有自动出血倾向。每颗实验牙测量近中龈乳头、正中颊缘、远中腭乳头和舌侧龈缘共4个点,记分为4个测量点记分的平均值。
② 牙周附着丧失(attachment loss,AL)的测量 采用乙醚吸入法麻醉小鼠,选用自制牙周探针探测牙周附着丧失数值,牙周探针的刻度单位与工作端直径均为0.2 mm。牙周附着丧失为釉牙骨质界到牙周袋底的距离,测量部位为实验牙颊、腭侧近中、中央、远中共6个点,取平均值。
③ 组织学观察 采用颈椎脱臼法处死小鼠,取左侧上颌骨标本于10%中性甲醛液中固定48 h以上,修整标本,仅保留磨牙区段牙齿及牙周组织。采用混合脱钙液脱钙,制成颊舌向5μm厚度的牙体牙周组织联合切片,HE染色,光学显微镜下观察结合上皮、上皮下炎症细胞浸润及牙槽骨的吸收情况。
④ 血清标本采集和抗体测定 采用摘眼球法采集血液约1 mL,静置2 h,4 ℃过夜, 3 000 r/min离心10 min,分离收集上层血清,-20 ℃冰箱内冷冻保存。测量血清抗体时,将保存的标本平衡至室温,放置20 min。ELISA法检测 IgG1和IgG2a水平:在酶标板的反应孔中加入用0.05 mol/L pH 9.6包被缓冲液稀释至蛋白质含量为1-10 mg/L的抗原 0.1 mL,4 ℃孵育过夜。用含Tween 20的5%PBS洗液洗涤4次。加入稀释的待测血清,37 ℃放置2 h。分别用PBS与PBST洗涤酶标板2次。加入酶标抗体,37 ℃孵育1 h后洗涤4-6次。加入底物液,37 ℃避光放置30 min。加入2 mol/L H2SO40.05 mL终止反应,混匀后在30 min内用酶标仪测量波长为450 nm时各孔的吸光度值(absorbance,A)。
3统计学处理
结 果
1GI的变化
牙周炎组GI在各个时点均明显高于正常对照组(P<0.05);TGP治疗组GI水平从第6周起较牙周炎组显著下降(P<0.05),见表1。
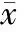
表1 各组小鼠GI的变化
▲P<0.05vscontrol group;*P<0.05vsperiodontitis group.
2AL的变化
牙周炎组AL在各个时点明显高于正常对照组(P<0.05);TGP治疗组AL在 6、 8和10周时明显低于牙周炎组(P<0.05),见表2。
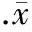
表2 各组小鼠AL的变化
▲P<0.05vscontrol group;*P<0.05vsperiodontitis group.
3组织学改变
(1)正常对照组:牙龈上皮结构完整,结合上皮结构正常、无钉突,牙周膜纤维排列整齐,结缔组织内无炎症细胞浸润,固有牙槽骨形态结构完整,见图1A、B。(2)实验性牙周炎组:牙周炎症破坏明显,结合上皮与牙面分离,上皮向根方增殖,组织深部可见大量炎症细胞浸润,血管扩张充血,牙周纤维水肿、变性,牙槽骨表面可见活跃的破骨细胞和骨吸收,呈凹坑状吸收,牙槽嵴顶高度降低,见图1C、D。(3)TGP治疗组:牙周组织炎症细胞浸润程度比牙周炎组明显减轻,结缔组织可见小血管增生,成纤维细胞增生活跃;牙槽骨骨吸收陷窝内可见成纤维细胞,少见破骨细胞,见图1E、F。
4血清抗体水平
由表3可见,牙周炎组各时点IgG1水平均比正常对照组显著下降(P<0.05);TGP治疗组IgG1水平从第6周起较牙周炎组显著升高(P<0.05)。
由表4可见,牙周炎组IgG2a水平在各个时点均明显高于正常对照组(P<0.05);TGP治疗组IgG2a水平从第6周起较牙周炎组显著下降(P<0.05)。

Figure 1. Histological changes of periodontal tissues(HE staining, ×20). A, B:control group;C,D:periodontitis group;E,F:periodontitis+TGP group.A,C,E:6 weeks;B,D,F:8 weeks.
图1各组牙周组织HE染色结果
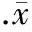
表3 各组小鼠血清IgG1水平的变化
▲P<0.05vscontrol group;*P<0.05vsperiodontitis group.
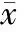
表4 各组小鼠血清IgG2a水平的变化
▲P<0.05vscontrol group;*P<0.05vsperimental periodontitis group.
讨 论
关于牙周组织疾病的免疫机制目前尚未清楚[5]。研究表明牙周病的组织损害主要是由宿主对感染的免疫应答和炎症反应引起,牙周致病菌及其毒性产物通过白细胞介素(interleukin, IL)、肿瘤坏死因子 α(tumor necrosis factor α, TNF-α)、PGs、 NO和MMPs等导致组织炎症及牙槽骨吸收。近年的研究表明Th1和Th2细胞互为调节细胞,通过分泌功能不同的细胞因子相互制约,其平衡维持着机体免疫系统的正常功能[6]。Th1和Th2细胞所致的不同优势免疫应答与疾病的发生、发展及预后密切相关[7]。牙周炎时机体的免疫反应向Th1偏移,Th1极化在牙周炎中起着促进炎症的作用[8];而Th2型细胞反应可减轻牙周组织的破坏,提示Th2免疫应答对牙周感染具有免疫保护作用[9,10]。
抗体的产生受Th1、Th2细胞因子的调控,并与特异性抗体IgG亚类的表达水平相关。Th1细胞因子刺激IgG2a的产生,Th2细胞因子促进IgG1的合成。Houri-Haddad等[11]的研究显示慢性心理应激能显著升高小鼠血清IgG2a水平,提示心理应激时机体的免疫反应表现为Th1极化,加重牙槽骨吸收。O’Brien-Simpson等[12]用P.gingivalis建立小鼠牙周炎模型,同时将RgpA-Kgp蛋白酶黏连复合体接种于动物,结果检测到IgG1水平明显升高,牙槽骨吸收减少,提示Th2细胞反应对牙周炎具有保护作用。通过比较IgG1、IgG2a水平的变化,可以间接反映Th1和Th2细胞免疫应答的变化[13]。本研究中,实验性牙周炎组小鼠GI和AL明显升高,血清IgG1水平明显低于正常对照组,IgG2a水平明显高于正常对照组,提示实验性牙周炎时Th2细胞功能相对不足,Th1功能亢进,使牙周炎症加重。
白芍(radixPaeoniaealba)别名白芍药、金芍药,多年生草本,为毛莨科植物芍药(PaeonialactifloraPall.)的去皮干燥根。其主要的有效成分为TGP,具有抗炎、免疫调节及止痛等作用。TGP能抑制纤维化大鼠肝组织核转录因子 κB (nuclear transcription factor κB,NF-κB)、TNF-α、NO和转化生长因子(transforming growth factor,TGF)的表达,并能抑制高迁移率族蛋白B1(high-mobility group box 1 pronetein,HMGB1)的核转位和释放而发挥抗炎作用[14]。TGP还可以通过降低诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达而抑制大鼠腹腔巨噬细胞NO合成及TNF-α、IL-1β、IL-2等的过度分泌[15]。本研究发现,实验性牙周炎经TGP治疗后血清IgG1水平比牙周炎组明显升高,IgG2a在TGP治疗后明显下降,表明TGP能抑制Th1细胞反应,促进 Th2细胞反应;组织学也观察到牙周组织出现明显修复反应,炎症细胞浸润减少,成纤维细胞增生活跃,局部有新骨基质沉积。总之,TGP通过降低牙周炎Th1细胞反应及提高Th2细胞反应,提高小鼠的免疫能力,减轻牙周组织炎症程度,对牙周炎发挥治疗作用。这一结果将为牙周炎的免疫治疗提供科学理论依据。
[1] Deo V, Bhongade ML. Pathogenesis of periodontitis: role of cytokines in host response[J].Dent Today,2010,29(9):60-62,64-66.
[2] Liu YC, Lerner UH, Teng YT. Cytokine responses against periodontal infection: protective and destructive roles [J]. Periodontol 2000,2010,52(1):163-206.
[3] Kimura S, Nagai A, Onitsuka T, et al. Induction of experimental periodontitis in mice withPorphyromonasgingivalis-adhered ligatures [J]. J Periodontol,2000,71(7): 1167-1173.
[4] Löe H. The gingival index, the plaque index and the retention index systems[J].J Periodontol,1967,38(6 Suppl):610-616.
[5] 张增方,黄世光,黄绮凌,等.旋毛虫感染促进白细胞介素-4表达并抑制小鼠实验性牙周炎[J].中国病理生理杂志,2010,26(3):573-576.
[6] Gaffen SL, Hajishengallis G. A new inflammatory cytokine on the block: re-thinking periodontal disease and the Th1/Th2 paradigm in the context of Th17 cells and IL-17 [J]. J Dent Res, 2008,87(9): 817-828.
[7] Gemmell E, Yamazaki K, Seymour GJ. The role of T cells in periodontal disease: homeostasis and autoimmunity[J]. Periodontol 2000,2007,43(1):14-40.
[8] 谢 敏, 黄世光, 宋 宁, 等. Th1极化反应与牙周炎病理改变的实验研究[J]. 实用口腔医学杂志,2010,26(4):457-460.
[9] 谢 敏, 黄世光, 黄绮凌, 等. Th2极化对牙周炎保护作用的实验研究[J]. 实用口腔医学杂志,2009,25(6): 787-790.
[10]Taubman MA, Kawai T. Involvement of T-lymphocytes in periodontal disease and in direct and indirect induction of bone resorption[J]. Crit Rev Oral Biol Med,2001,12(2):125-135.
[11]Houri-Haddad Y, Itzchaki O, Ben-Nathan D, et al. The effect of chronic emotional stress on the humoral immune response toPorphyromonasgingivalisin mice [J]. J periodontal Res, 2003,38(2):204-209.
[12]O’Brien-Simpson NM, Pathirana RD, Paolini RA, et al. An immune response directed to proteinase and adhesin functional epitopes protects againstPorphyromonasgingivalis-induced periodontal bone loss[J]. J Immunol, 2005, 175(6):3980-3989.
[13]Day MJ.Immunolobulin G subclass distribution in caine leishmaniosis:A review and analysis of pitfall in interpretation[J].Vet Parasitol,2007,147(1-2):2-8.
[14]路景涛,孙妩弋,刘 浩,等. 白芍总苷对免疫性肝纤维化大鼠肝组织NF-κB和TGF-β1蛋白表达的影响[J]. 中国药理学通报,2008,24(5):588-592.
[15]陈 刚, 郭莉霞, 邓小红, 等. 白芍总苷对巨噬细胞一氧化氮和诱导型一氧化氮合酶生成的影响及其机制研究[J]. 中国免疫学杂志, 2008,24(4):345-347,351.
EffectoftotalglucosidesofpaeonyonserumlevelsofIgG1andIgG2ainmousemodelofperiodontitis
PAN Qian-ru1, LÜ Fang-li2, SONG Ning3, HUANG Shi-guang1
(1FacultyofDentistry,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;2DepartmentofParasitology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China;3DepartmentofStomatology,ShenzhenChildren'sHospital,Shenzhen518026,China.E-mail:thshg@126.com)
AIM: To investigate the effect of total glucosides of paeony (TGP) on immune regulation in the mouse model of experimental periodontitis.METHODSSixty 12-week-old male Kunming mice were randomly divided into 3 groups. The naive mice were used for control. In experimental periodontitis group, the mice were ligated by 5-0 braided silk inoculated with putative periodontopathic bacteria around the left first maxillary molar. In periodontitis+TGP treatment group, experimental periodontitis were produced by the same way as above, and the mice were gavaged with TGP at the beginning of the fifth week after the ligature. The mice were sacrificed at week 4,6, 8 and 10. The gingival index (GI) and attachment loss (AL) were measured before the mice were executed. The histological changes of periodontal tissues were observed under microscope with hematoxylin and eosin (HE) staining. The serum levels of IgG1and IgG2ain mice were determined by ELISA.RESULTSGI in periodontitis group was significantly higher than that in control group (P<0.05). GI in periodontitis+TGP treatment group was significantly lower than that in periodontitis group since the 6th week after the ligature (P<0.05). AL in periodontitis group was significantly higher than that in control group(P<0.05). AL in periodontitis+TGP treatment group was significantly lower than that in periodontitis group at week 6, 8 and 10 (P<0.05). The destruction of periodontal tissues in periodontitis group was more serious than that in other groups. The serum level of IgG1in periodontitis group was significantly lower than that in the other two groups(bothP<0.05).The serum level of IgG2ain periodontitis group was significantly higher than that in the other two groups (bothP<0.05).CONCLUSIONTGP may play a significant role in periodontitis in mice by decreasing serum level of IgG2aand increasing the serum level of IgG1.
Periodontitis; Models,animal; Antibodies; Total glucosides of paeony
R781.4
A
1000-4718(2011)08-1462-05
2011-03-27
2011-04-25
国家自然科学基金资助项目(No.81071387);广东省自然科学基金资助项目(No.10151008901000006)
△通讯作者 Tel: 020-85221165; E-mail: thshg@126.com
10.3969/j.issn.1000-4718.2011.08.002
