新型化学电源的高考考点例析
2011-10-23宋红杰
宋红杰
新型化学电源的高考考点例析
宋红杰
高考中的新型电池,有“高铁电池”“海洋电池”“燃料电池”“锂离子电池”“银锌电池”“纽扣电池”等。这些电池一般具有高能环保、经久耐用、电压稳定、比能量高等特点。取材于这些知识点的试题,由于题材广、信息新、陌生度大,所以大多数考生对这类试题感到难,实际上这些题目主要考查的是学生迁移应用的能力。试题主要从以下几个角度进行考查:
一、新型电池电极的判断以及电极反应式的书写
例1:Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe有关该电池的下列中,正确的是:
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-3e-=2Li++ FeS
【解析】
A.Li和Al分别是两极材料,化合价应为0;B.应有Li的参加;C.根据给出的正极得电子的反应,原电池的电极材料Li-Al/FeS可以判断放电时(原电池)负极的电极反应式为Li -e-= Li+;D.应是阳极失电子反应。
【答案】B
原电池与电解池的教学一定要重视电极反应式书写。电极反应式书写是原电池和电解池内容或原理的核心。原电池的教学可以从原电池反应的总反应式,可以自发进行的氧化还原反应,负极反应(因负极就是参加反应的电极)开始。电解池的教学要从外加电源的正负极,分析阳极开始,最终获得被进行的氧化还原反应。
二、由电极反应进行电解原理的考查
例2:图1为一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏染料(S)涂覆在 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:

下列关于该电池叙述错误的是:
A.电池工作时,是将太阳能转化为电能
B.电池工作时,I-离子在镀铂导电玻璃电极上放电
C.电池中镀铂导电玻璃为正极
D.电池的电解质溶液中I-和I3-的浓度不会减少

图1
【解析】
这是个太阳能电池,从装置示意图可看出是个原电池,最终是将光能转化为化学能,A选项正确,从图1可看在外电路中电子由负极流向正极,也即镀铂电极做正极,发生还原反应:I3-+2e-=3I-,所以C正确,B选项错误,应为把上面4个反应加起来可知,化学物质并没有减少, D正确。
【答案】B
太阳能电池,新奇的反应体现基本原理。据原电池的两电极反应式,判断电子流向与电流流向,了解太阳能电池的工作原理,原电池的总反应式等,还考查考生变通能力和心理素质,能否适应陌生的情境下应用所学知识解决新的问题等。
三、电解质溶液中电子、电流、离子移动方向、电子转移数目的判断
例3:某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图2,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是:
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极

图2
【解析】
(2)经预处理样品。取“2.2”项下经预处理的空白脂质体溶液、空白脂质体+米索硝唑溶液、米索硝唑pH敏感脂质体溶液各适量,于200~400 nm波长范围内扫描,光谱图见图2。由图2A可知,经预处理完全沉淀了辅料磷脂酰乙醇胺,空白脂质体在322 nm波长处无明显的紫外吸收;由图2B、C可知,米索硝唑的最大吸收峰仍出现在322 nm波长处,因而此时辅料对主成分的测定已无干扰。
燃料电池中通H2的一极为负极,通O2的一极为正极,电子通过外电路从负极a流向正极b,电流与此相反,阳离子通过电解质流向正极,即由a到b,A错误,D正确;电解质传递H+,b极上的电极反应式为:O2+4H++4e-=2H2O,B错误,a极上的电极反应式为:H2-2e-=2H+,每转移0.1 mol电子,消耗0.05 mol的H2,标准状况下为1.12 L, C错误。
【答案】D
四、有关电化学的计算
例4:图3装置中,甲、乙、丙3个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_极;②电极b上发生的电极反应为_;
③列式计算电极b上生成的气体在标准状态下的体积:_;
④电极c的质量变化是_g;
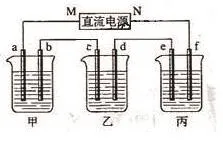
图3
【解析】
(1)①乙中C电极质量增加,则c处发生的反应为:Cu2
++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等,有100×10%=(100-χ)×10.47%,得χ=4.5g,故为0.25mol。由方程式2H2+O2= 2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。
【答案】(1)①正极 ②4OH--4e-=2H2O+ O2↑。③2.8L ④16g
近年高考试题中,计算题型的比例近两年呈递增的趋势,运用守恒法解题可以避免书写繁琐的化学方程式,简化计算过程,提高解题的速度和准确度。
五、能源转化、环境保护、工业生产等热点问题
例5:图4是一种航天器能量储存系统原理示意图。下列说法正确的是:
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:
O2+2H2O+4e-=4OH
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化

图4
【解析】
在该装置系统中,有4种能量转化的关系,即太阳能、电能、化学能和机械能之间的相互转化,A错误;负极失电子发生氧化反应,B错误;装置X 中H2O转变成H2、O2,C正确;在反应过程中,有能力的损耗和热效应的产生,不可能实现化学能和电能的完全转化,故D错误。
【答案】C
由于能源问题逐渐成为社会热点问题,因此化学反应中的能量变化也成为近几年高考命题的一个热点,几乎每年高考都有此类试题,估计今后几年有关能源的试题仍将成为高考命题的重点,考查能量转化的内容将不断拓宽,难度不断加大,题型也会有新的变化。
[1] 魏万青.金版教程(第三版)[M].内蒙古:内蒙古大学出版社,2010
稿件编号:P1101030
宋红杰,本科,中教一级。
河北省迁安市第二中学。
