柱层析法提纯羊毛脂中胆固醇的工艺
2011-10-22胡文娜苏宝根杨亦文任其龙
胡文娜,苏宝根,苏 云,杨亦文,任其龙
(浙江大学化学工程与生物工程学系,二次资源国家专业实验室,浙江 杭州 310027)
研究开发
柱层析法提纯羊毛脂中胆固醇的工艺
胡文娜,苏宝根,苏 云,杨亦文,任其龙
(浙江大学化学工程与生物工程学系,二次资源国家专业实验室,浙江 杭州 310027)
采用柱层析法分离羊毛脂中的胆固醇,以胆固醇与杂质羊毛甾醇的分离度为判定依据来筛选吸附剂及优化层析工艺,同时对吸附剂进行了再生考察。实验表明,当以200~300目粗孔硅胶为吸附剂、丙酮/正己烷混合溶剂(体积比4∶96)为流动相、35 ℃下胆固醇上载量为2.4%(质量分数)时,胆固醇的分离效果较好,所得胆固醇含量可达84.36%,收率为85.67%。另外选用丙酮/正己烷混合溶剂(体积比50∶50)对吸附剂进行再生处理,硅胶经7次使用再生循环,分离效果未降低。
胆固醇;羊毛甾醇;柱层析;硅胶;再生
胆固醇也称胆甾醇,是动物组织细胞不可缺少的重要物质,工业上主要用于化妆品[1]、乳化剂、医药等。胆固醇既可以从动物脑组织和脊髓组织中提取,又可以从羊毛脂中提取。前种方法由于其资源有限,无法满足日益增长的需求。羊毛脂[2]中不仅有较高的胆固醇含量,而且在我国有较丰富的资源,可成为胆固醇的主要来源[3],因此如何将胆固醇从羊毛脂中分离出来就成为关键技术。
目前提纯胆固醇的方法主要有溴化法、分子蒸馏法、超临界萃取法、结晶法、络合法和色谱法等[4]。溴化法所得收率偏低,而且溴的使用限制了此方法的应用;分子蒸馏法[5]得到的胆固醇含量较低[6],适合作为前处理步骤;超临界萃取法对胆固醇选择性不高,而且其在CO2的溶解度有限[7-8];结晶法的优点在于过程简单,但结晶步骤和相应的工艺条件需要严格控制,且胆固醇收率低,操作难度较大;络合法是目前应用较多的方法,但其操作复杂,且金属离子对环境不友好[9];色谱法是应用比较成熟的一种工业方法[10-11],操作方便,分离效果较好。van Dam[12]曾使用Merck60硅胶层析色谱将皂化预处理过的羊毛脂进行分离纯化,胆固醇产品含量为 60%~80%,但其流动相采用甲苯与乙酸丁酯的混合溶剂,有一定毒性,不适合工业应用。
本文作者采用与文献[12]不同的原料,该原料为羊毛脂经转酯化与分子蒸馏预处理所得,主要是多种链状脂肪醇与甾醇的混合物羊毛醇[13]。下文将以产品中胆固醇与杂质代表物羊毛甾醇[14]的分离度为依据,最终产品胆固醇含量和回收率为目标,通过筛选合适的固定相和流动相组成,考察温度和上载量等主要参数对分离的影响,得到柱层析法分离胆固醇的优化工艺条件,并完成对吸附剂的再生[15]。
1 实验部分
1.1 试剂与材料
甲醇、正己烷、硫酸、乙醇(分析纯,国药集团化学试剂有限公司);丙酮(分析纯,杭州化学试剂有限公司);200~300目粗孔硅胶(青岛海洋化学试剂);SRC活性炭(先科有限公司);HZ-816树脂(上海华震科技有限公司);GF254硅胶板(青岛海洋化学试剂);胆固醇标样(含量95%,sigma公司)。 原料为羊毛脂经转酯化和分子蒸馏预处理的产物,其中胆固醇含量为20%~30%,由浙江花园生物高科股份有限公司提供。
1.2 仪器
层析柱,φ1.54 cm×50 cm,带水浴夹套;Waters高效液相色谱(HPLC)系统,包括Waters 510高压泵,Waters717自动进样器,Waters 2487紫外检测器。
1.3 高效液相色谱定量分析条件
色谱柱,Waters Symmetry C18柱(5 μm,φ0.46 cm×15 cm);流动相,无水甲醇;流速,1.0 mL/min,检测波长,205 nm;柱温,35 ℃;进样量,10 μL。
1.4 实验方法
1.4.1 样品溶液制备
原料用正己烷溶解,配制成浓度为100 mg/mL的溶液备用。
1.4.2 分离条件选择
使用规格为φ0.39 cm×15 cm不锈钢色谱空柱,干法填入吸附剂,将色谱柱连入HPLC系统,在设定操作条件下平衡色谱柱后,进10 μL样品溶液,根据色谱流出曲线计算胆固醇与羊毛甾醇的分离度,以此筛选合适的流动相组成和操作温度。
1.4.3 层析柱制备与样品分离
称取18 g粗孔硅胶的吸附剂,加入80 mL流动相制成匀浆,湿法装柱,床层体积约为50 mL。使用3倍床层体积以上的流动相平衡固定相,再将10 mL样品溶液从柱顶端缓缓加入,进样完毕后使用流动相洗脱。控制流速在 1~1.2 mL/min,每收集15 mL流出液作为一个馏分,每一馏分中的胆固醇与羊毛甾醇浓度由HPLC定量分析,分别合并富含羊毛甾醇与含胆固醇的馏分,并真空浓缩,再用HPLC进行胆固醇含量分析,计算回收率。
1.5 再生条件考察
1.5.1 薄层色谱法筛选再生溶剂
取活化后的GF254硅胶板,用样品溶液点样,以丙酮/正己烷的混合溶液为展开剂,考察展开剂中丙酮与正己烷体积比(1∶9、3∶7、5∶5、7∶3、9∶1)对薄层色谱分离的影响,硅胶板晾干后用硫酸的乙醇溶液(1∶9,体积比)显色。
1.5.2 再生实验
使用粗孔硅胶装填不锈钢色谱空柱,进样分离测试羊毛甾醇与胆固醇的分离度,之后使用不低于5倍床层体积的样品连续通过硅胶柱后,使用再生溶剂对硅胶柱进行再生,待再生完全后进样分离测试此时硅胶柱对羊毛甾醇与胆固醇的分离度,多次重复循环上述步骤比较分离度,考察重复性。
2 结果与讨论
2.1 固定相筛选
胆固醇分子尺寸为 1.91 nm×0.77 nm×0.40 nm[16],分子体积较大,应选择大孔径吸附剂。本研究选取了活性炭、大孔树脂与硅胶3种吸附剂,将其装填于色谱柱内,在35 ℃、流速0.4 mL/min条件下,使用优化的流动相色谱分离考察羊毛甾醇与胆固醇的分离效果,结果如图1所示。
以羊毛甾醇为杂质组分代表,通过羊毛甾醇与胆固醇两峰的分离度作为实验判断依据。当树脂与活性炭作为色谱柱固定相时,得到的洗脱曲线仅有单一的峰,无分离效果。以硅胶为固定相时,可将胆固醇与杂质进行分离,硅胶柱分离效果好,选择硅胶为吸附剂进行后续研究。经标定,保留时间在 15~20 min的峰是羊毛甾醇在紫外检测下的峰,在25~30 min的峰是胆固醇在紫外检测下的响应峰,脂肪醇等杂质在选定的紫外波长下没有明显响应。
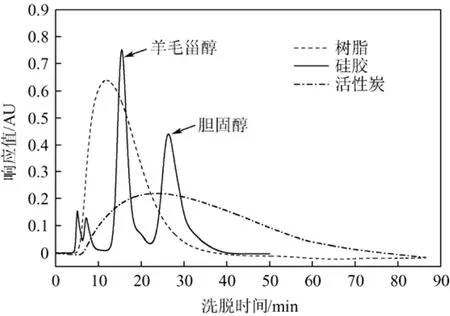
图1 3种吸附剂的洗脱曲线
2.2 流动相的选择
硅胶层析是一个正相色谱洗脱的过程,应选择非极性的流动相。选择正己烷为流动相主体,考察在其中加入不同类型及不同比例极性溶剂的分离效果。极性溶剂的含量越高,流动相极性越大,洗脱能力越强,若极性过大会无法实现分离,因此需要寻找合适的极性溶剂及配比。本研究分别选用甲醇和丙酮作为极性溶剂。
按照 1.4.2节中测试分离效果的步骤,分别以不同体积比的甲醇/正己烷(0.5∶99.5,1∶99,2∶98)和丙酮/正己烷(2∶98,3∶97,4∶96,5∶95)为流动相测试分离效果,结果见图2。
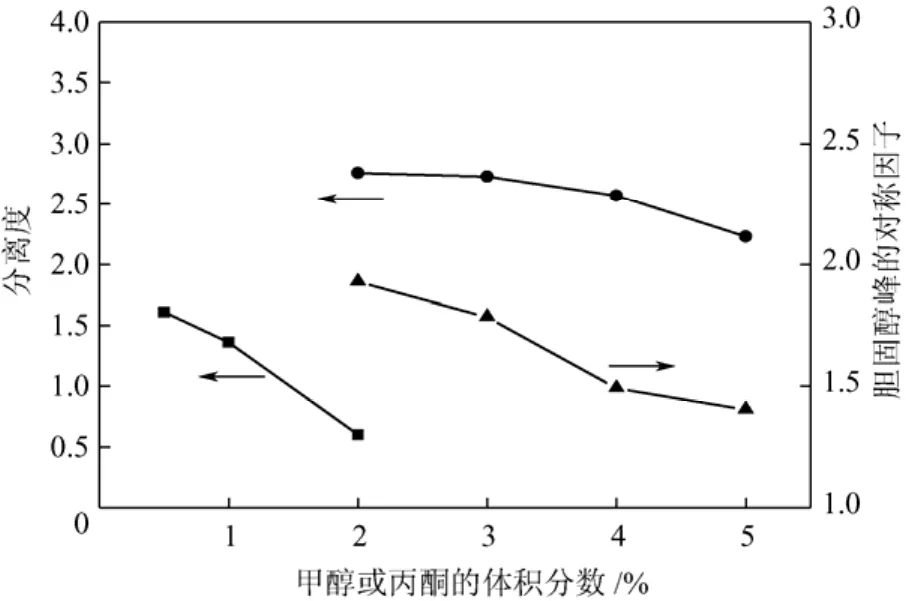
图2 流动相组成对分离度的影响
结果表明,正己烷很难将甾醇从硅胶上洗脱下来,而在正己烷溶液中加入少量甲醇或丙酮后,洗脱能力有显著提高。当甲醇与正己烷体积比在(0.5∶99)~(2∶98)范围内时胆固醇与羊毛甾醇的分离度均小于 1.7,而当丙酮与正己烷体积比在(2∶98)~(5∶95)范围内时分离度均大于2,可以较好地实现羊毛甾醇和胆固醇峰的分离,因此选择正己烷与丙酮的混合溶剂作为流动相。胆固醇峰的对称因子随丙酮体积分数的增加趋近 1,峰形对称性更好并且拖尾较小。当丙酮与正己烷体积比为4∶96时,分离度略低于3∶97条件下的分离度,但两峰已可实现基线分离,对最终产品纯度影响有限,并且洗脱体积减少了不低于2个床层,降低了洗脱时间及流动相的使用量。综合上述因素,选择适宜的流动相为丙酮/正己烷(4∶96,体积比)。
2.3 温度的影响
温度对吸附平衡有一定影响,在常用温度范围内对其进行考察。在丙酮/正己烷(4∶96,体积比)为流动相、流速0.4 mL/min条件下,分别考察了25℃、35 ℃、45 ℃、55 ℃下羊毛甾醇杂质峰与胆固醇峰的分离度,结果见表1。由表1可知,分离度相差不大,均能实现基线分离。但较低温度需要较长的洗脱时间且拖尾现象较严重,而温度过高增加溶剂挥发,最终选择操作温度为35 ℃。
2.4 上载量的影响
层析过程中,需要寻找一个合适的上载量,使吸附剂得到充分利用,同时不因过高的上载量造成色谱柱过载而降低分离效果。固定分离条件为:35℃,玻璃柱规格φ1.54 cm×50 cm,硅胶装填量18.0 g(50 mL),丙酮/正己烷(4∶96,体积比)为流动相,流速保持在每小时一个床层体积(BV/h)左右,考察3个不同上载量下胆固醇的含量与回收率,实验结果见表2。
上述数据表明,对吸附分离羊毛脂中胆固醇的体系来说,硅胶体现出较高的处理能力,以胆固醇的质量计算,上载量在 3%以下,胆固醇含量与回收率均不低于70%;而当上载量为2.407%时,得到的胆固醇含量与回收率均在85%左右。图3即为此上载量下得到的流出曲线,分离条件为丙酮/正己烷(4∶96,体积比)洗脱,35 ℃,流速1 BV/h。从流出曲线可以看出,羊毛甾醇等杂质与胆固醇的流出峰有部分重合,因此切割位点的选择也会对含量与回收率有一定影响。
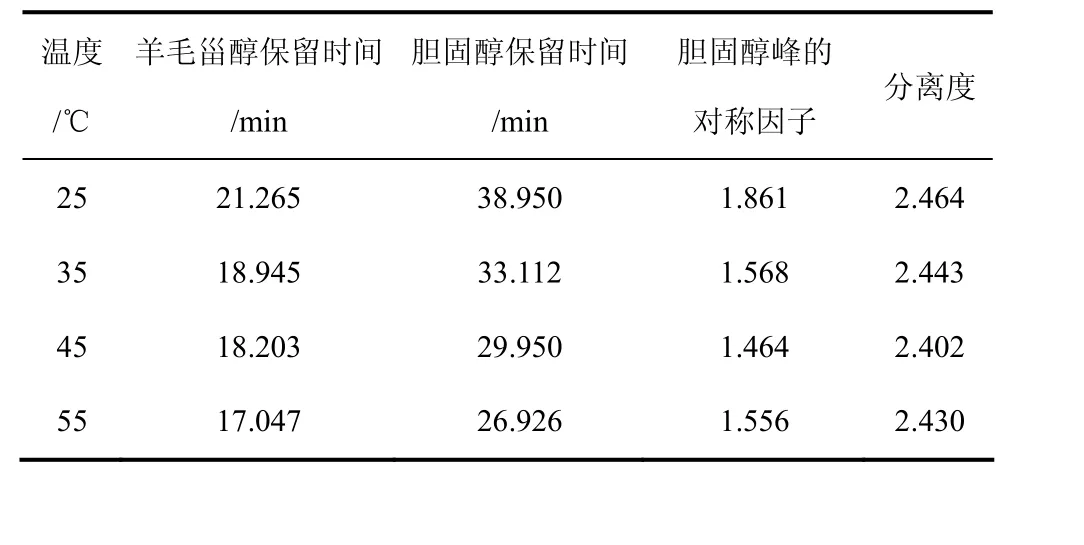
表1 温度的影响
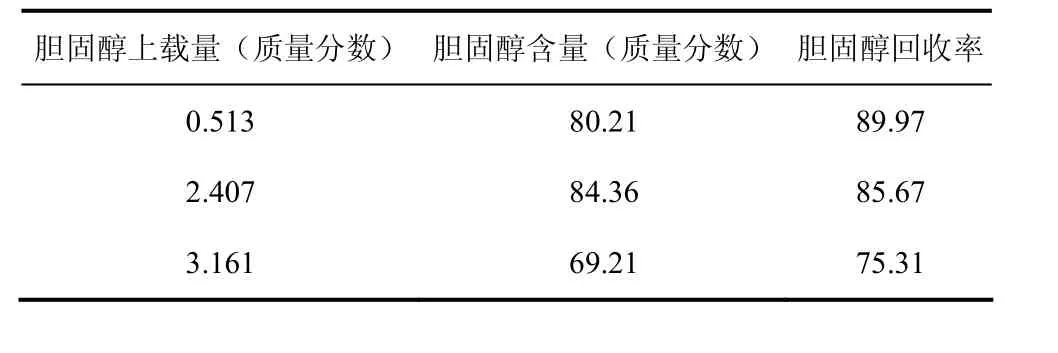
表2 上载量对胆固醇含量与收率的影响 单位:%
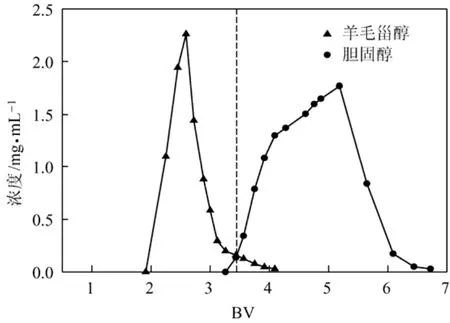
图3 上载量2.407%下的硅胶柱流出曲线
2.5 硅胶再生
吸附剂无法重复利用是限制柱层析工艺广泛应用的一个因素,可重复使用的吸附剂不仅压缩了生产成本,同时减少了环境负担,使层析工艺得以推广。本研究选定了不同的再生溶剂,并考察再生后硅胶柱的分离效果。
2.5.1 再生溶剂的选择
丙酮对附着于硅胶吸附剂的极性物质具有较强的洗脱能力,且之前的分离过程使用了正己烷与丙酮的混合溶剂,选择适当比例的丙酮正己烷混合溶剂为再生溶剂效果好,并减少了溶剂更换,操作简易。表3为对多次点板上样后的硅胶板使用丙酮与正己烷体积比例分别为1∶9、3∶7、5∶5、7∶3、9∶1的溶剂为展开剂时硅胶板再生效果。
当丙酮与正己烷体积比为1∶9和3∶7时,体系仍能表现出一定的分离效果,羊毛甾醇与胆固醇Rf值有明显差异,并且在原料点附近有某种较难洗脱的杂质残留;使用体积比5∶5和7∶3的丙酮/正己烷展开液时,两种甾醇的相对Rf比均为1,且其在5∶5的比例下有较大的Rf值;当丙酮/正己烷体积比为 9∶1时,可能由于对甾醇溶解度下降,Rf值有所减小。能同时将所有物质快速洗脱是理想的再生溶剂,因此本研究选择了体积比为5∶5的丙酮/正己烷作为再生溶剂。

表3 不同溶剂配比再生效果
2.5.2 再生效果的考察
为保证吸附剂可以多次再生使用,本研究进行了重复性实验来验证硅胶在多次分离并再生后的分离效果,结果如图4所示。
按照1.5.2节的操作步骤再生7次的过程中,实验使用的填充硅胶柱分离羊毛脂中胆固醇与羊毛甾醇的分离度并未下降,而是在2.7附近略有波动,可认为波动基本是由实验误差引起的。因此实验用的硅胶可以再生完全,并重复使用而不影响分离效果。
3 结 论
通过硅胶柱层析法提纯羊毛脂中胆固醇的实验研究,得到以下结论。

图4 再生不同次数后的硅胶对胆固醇与羊毛甾醇的分离度
(1)从3种不同的吸附剂中,优选出200~300目层析用粗孔硅胶做为柱层析的固定相。
(2)最佳分离工艺条件为:35 ℃下,固定相为粗孔硅胶,流动相为体积比4∶96的丙酮/正己烷混合溶剂,胆固醇上载量在2.4%(体积分数)时,产品中胆固醇含量在 84.36%,回收率为 85.67%,可进一步结晶纯化。
(3)选择了体积分数为 50%丙酮正己烷混合溶剂为适宜的再生溶剂,经7次使用再生后硅胶仍能保持其分离能力,分离度未降低。
[1]Lower E S. Cholesterol in cosmetic formulation—Review[J].Drug & Cosmetic Industry,1975,116:54-57.
[2]Motiuk K. Wool wax alcohols:A review[J].Journal of American Oil Chemists’Society,1978,56:651-658.
[3]邵妙娟. 不同催化剂催化羊毛脂转酯化反应制备胆固醇的工艺[D].杭州:浙江大学,2007.
[4]刘勇,杨扬,杨景昌. 从羊毛醇中提取胆甾醇方法的评述[J]. 日用化学工业,2006,36(2):107-130.
[5]林涛,王宇,梁晓光,等. 分子蒸馏技术浓缩合成维生素E[J]. 化工进展,2009,28(3):496-503.
[6]Guengrous J,Lutisan J. Process for preparing sterol alcohols from lanolin:CZ,279996[P]. 1995-09-13.
[7]Jones F W,Bateup B O,Dixon D R,et al. Solubility of wool wax in supercritical carbon dioxide[J].Journal of Supercritical Fluids,1997,10:105-111.
[8]Chen W,Su B G,Xing H B,et al. Solubility of cholesterol and desmosterol inn-hexane + ethanol mixed solvents[J].Fluid Phase Equilibra,2009,287(1):1-6.
[9]胡芬,谭兰兰,杨景昌,等. 从羊毛醇中提取胆甾醇的工艺研究[J].化学研究与应用,2008,20(11):1441-1446.
[10]张颖颖,杨亦文,任其龙,等. 硅胶柱层析法提纯大豆磷脂酰胆碱的研究[J]. 高校化学工程学报,2006,20(5):685-689.
[11]张琳,杨磊,祖元刚,等. pH梯度萃取-碱性氧化铝柱层析分离长春花中的文多灵和长春质碱[J]. 化工进展,2009,28(7):1282-1286.
[12]van Dam. Method of isolating sterols in commercial quantities from sterol-containing material:US,4664807[P]. 1987-05-12.
[13]Lamparcayk H,Miszkiel M. Gas chromatographic evaluation of wool wax alcohols supported by principal component analysis[J].Chromatographia,1991,31(5-6):243-246.
[14]Levan K K,Merilyn M H,Brian K N. A low-toxicity method for the separation of lanosterol and dihydrolanosterol from commercial mixtures[J].Steroids,2004,69:697-700.
[15]董亮,农绍庄,王伟,等. 层析用硅胶G再生的可行性及方法研究[J]. 离子交换与吸附,2007,23(1):82-87.
[16]Hsu C W,Yang M C. Enhancement of the imprinting effect in cholesterol-imprinted microporous silica[J].Journal of Non-Crystalline Solids,2008,354:4037-404.
Purification of cholesterol from lanolin by column chromatography
HU Wenna,SU Baogen,SU Yun,YANG Yiwen,REN Qilong
(Department of Chemical and Biological Engineering,National Laboratory of Secondary Resources Chemical Engineering,Zhejiang University,Hangzhou 310027,Zhejiang,China)
Cholesterol was purified from lanolin by column chromatography. The separation process was optimized based on the resolution between cholesterol and lanosterol,which was one of the impurities. The regeneration of adsorbent was also studied. The optimum purification condition was as follows:adsorbent was silica gel,mixture solvent of acetone/hexane(4∶96,volume ratio)was used as eluent and proper temperature was 35℃. After the separation,the purity of cholesterol was determined by HPLC to be 84.36% and the recovery was 85.67% when the column charge of cholesterol was 2.407% by weight. Additionally,the adsorbent was regenerated by the mixture solvent of acetone/ hexane(50∶50,volume ratio). The separation ability of silica gel remained almost unchanged after 7 cycles of usage and regeneration.
cholesterol;lanosterol;column chromatography;silica gel;regeneration
TQ 645.9
A
1000–6613(2011)07–1426–05
2010-12-17;修改稿日期:2010-12-30。
国家自然科学基金重点项目(20936005)及国家863计划重点项目(2010AA101503)。
胡文娜(1986—),女,硕士研究生,主要研究天然产物分离方向。E-mail foxhu@zju.edu.cn。联系人:苏宝根,副教授,主要从事天然产物分离和超临界流体技术研究。E-mail subg@zju.edu.cn。
