牛初乳中sIgA双抗夹心ELISA检测方法的建立
2011-10-19朱洪艳赵红宇周盛华高学军
朱洪艳,赵红宇,周盛华,高学军
(1.黑龙江康普生物科技有限公司,哈尔滨150000;2.东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
牛初乳中sIgA双抗夹心ELISA检测方法的建立
朱洪艳1,赵红宇1,周盛华1,高学军2
(1.黑龙江康普生物科技有限公司,哈尔滨150000;2.东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
为定量检测牛初乳中sIgA,建立双抗夹心ELISA方法。以牛初乳中的sIgA为抗原,免疫新西兰白兔,制得抗血清,经纯化后作为包被抗体;利用简易过碘酸钠法对兔抗牛sIgA标记辣根过氧化物酶(HRP),制得酶标抗体;通过方阵滴定法确定ELISA最佳工作条件;进行特异性、重复性、稳定性实验并且检测牛初乳粉样本中的sIgA含量。结果:成功建立了一种定量检测牛初乳中sIgA的双抗夹心ELISA方法。该方法线性范围:15.625~1 000 μg/L;最低检测限(LOD)为15.625 μg/L;精密度为:批内CV=4.8%;批间CV=6.5%。
ELISA,sIgA,牛初乳
0 引言
sIgA是外分泌液中存在的主要抗体,它具有和人初乳相同的免疫源性,是呼吸道、消化道、泌尿生殖道等抵御病毒、细菌等病原及有害物质入侵的第一道免疫屏障。研究发现sIgA能聚集细菌和病毒形成复合物,而易被黏膜屏障所阻挡或通过粪便、痰液及鞘膜液等分泌作用排出体外,是人体黏膜免疫的主要抗体[1-3]。然而,目前牛初乳类产品国内外缺乏必要的检测方法,此种方法的建立为牛初乳类产品的工业化开发与检测提供一种准确、快速、稳定的检测手段。
1 实验
1.1 材料
牛sIgA蛋白,兔抗牛sIgA多克隆抗体(自制),可溶型单组份TMB底物溶液,辣根过氧化物酶,牛初乳粉,96孔酶标板(Nunc);Bovine IgA ELISA Quantitation Kit试剂盒,SeperdexG-25,BCA蛋白浓度测定试剂盒,其他试剂均为进口分装或国产分析纯化学试剂,实验室用水均为去离子水。
1.2 仪器
酶标仪(BIO﹣RAD680),微量移液器,高速冷冻离心机。
1.3 方法
1.3.1 包被抗体的制备
取4只6~8周龄、雄性、健康新西兰白兔。分成2组,第一组3只,为被免疫兔,第二组1只设为阴性对照。采用颈、背部皮下多点注射的方法进行免疫,每只兔每次2 mg(以蛋白量计)牛sIgA蛋白免疫原,每隔15 d免疫1次。第3次免疫后10 d,耳静脉取血,间接ELISA法检测兔血清效价,当效价达到1︰10 000时心脏采血,制备抗血清。
抗血清经饱和(NH4)2SO4盐析后,过SeperdexG-25柱除盐,收集除盐后的溶液,PEG-6000透析浓缩,浓缩后的溶液即为兔抗牛sIgA抗体,检测效价后,分装、-20℃冻存。用BCA蛋白浓度测定试剂盒检测纯化后抗体浓度。
1.3.2 酶标抗体的制备
采用简易过碘酸钠法[4]对纯化的兔抗牛sIgA抗体标记辣根过氧化物酶(HRP),加甘油分装后,-20℃冻存。
1.3.3 双抗夹心ELISA方法的建立
以方阵滴定法分别确定包被抗体的最佳稀释度和工作条件;最适封闭液和作用时间;酶标抗体的最佳稀释度和作用时间;底物溶液的最佳反应时间。建立ELISA的最佳实验条件。
1.3.4 标准曲线的建立
以牛sIgA蛋白为标准品,系列稀释质量浓度:1000,500,250,125,62.5,31.25,15.625 μg/L,按照已确定的ELISA最佳实验条件进行检测,同时设定样品稀释液为阴性对照,TBST为空白对照,平行测定20次。以标准蛋白sIgA的质量浓度为自变量,其所对应的OD450nm值平均值减去空白OD450nm值为应变量,利用ELISACalc数据分析专用软件绘制标准曲线。确定标准曲线的最低检测限和线性范围。
1.3.5 特异性实验
选取与待检蛋白性质相近的另外几种乳蛋白:牛免疫球蛋白G(IgG)、牛免疫球蛋白M(IgM)、乳铁蛋白(LF)、酪蛋白进行特异性实验,每种蛋白重复两个孔,设置样品稀释液为阴性对照,sIgA的最低检出限为阳性对照。
1.3.6 重复性实验
随机抽取14个批次的牛初乳粉样,同时进行批内和批间检测,批内设两个平行,批间设10个平行,设置阴性对照和空白对照,对所得数据进行统计学分析。
1.3.7 稳定性实验
包被抗体的破坏性实验:将已包被的酶标板,置于37℃72 h,取出,以1.1.3建立的程序检测sIgA标准品溶液(62.5 ng/mL),设两个平行,计算所测得的sIgA质量浓度占sIgA标准溶液初始质量浓度的百分比;酶标抗体的破坏性实验:1︰3000稀释酶标抗体后,分成小支,约1 mL/支,置于37℃72 h,取出,按1.1.3建立的ELISA程序实验,检测sIgA标准品溶液(62.5 μg/L),设置两个平行,计算所测得的sIgA质量浓度占sIgA标准溶液初始质量浓度的百分比。
1.3.8 牛初乳粉样本的检测
随机抽取50个牛初乳粉样,用建立的ELISA方法(设为A方法)测定其中的sIgA质量浓度,在相同条件下与Bovine IgA ELISA Quantitation Kit试剂盒(设为B方法)的检测结果作对照,用统计学方法分析这两种方法的符合性。
2 结果
2.1 抗血清纯化前后效价的测定
表1为抗血清纯化前后效价对比结果。由表1可以看出,纯化前后血清效价均可以达到1︰10 000以上,采用BCA蛋白质量浓度测定试剂盒检测纯化后抗体质量浓度为3 g/L。分装,冻存,备用。

表1 前后效价对比结果
2.2 双抗夹心ELISA最佳实验条件的确定
方阵滴定法确定的双抗夹心ELISA的最佳实验条件为:每孔100 μL质量浓度为1 mg/L包被抗体,37℃1 h包被酶标板;pH 8.0 TBST洗板3次,每次间隔3 min;200 ml每孔1%BSA 37℃0.5 h封闭;洗板3次;加抗原或标准品37℃1 h,每孔100 μL;洗板5次;酶标抗体1︰3000稀释,每孔100 μL(37℃,1 h);洗板5次;加TMB底物溶液12 min;浓度为2 mol/L的H2SO4终止反应;酶标仪450 nm(主)及630 nm(辅)的双波长读取OD值。
2.3 标准曲线的建立
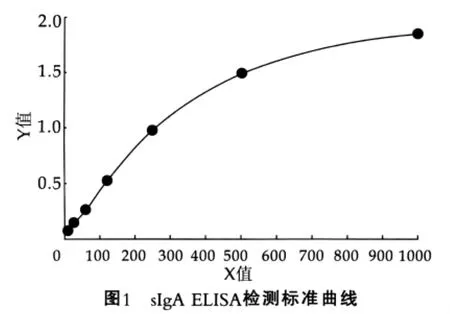
表2为sIgA ELISA检测结果。根据表2的sIgA ELISA检测数据建立的标准曲线如图1所示,该曲线为4参数Logistic拟合;方程:y=(A-D)/[1+(x/C)^B]+D;A=2.10897;B=-1.63730;C=371.61047;D=0.04871;r2=0.99689。从结果可以看出:最低检测限15.625 μg/L;检测范围15.625~1 000 μg/L。
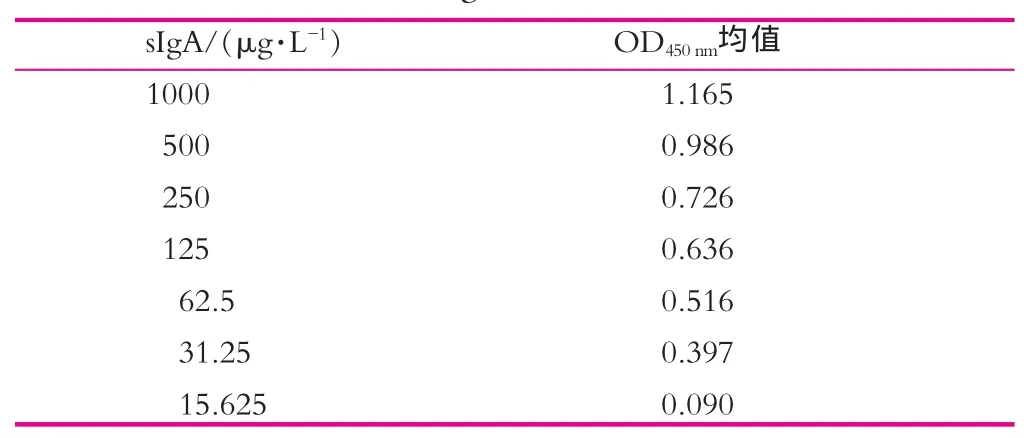
表2 sIgA ELISA检测
2.4 特异性实验
表3为特异性实验结果。由表3可以看出,阳性OD450nm值与这4种蛋白的OD450nm值的比值均大于2.0,说明本研究建立的ELISA方法不与这几种蛋白反应,有较好的特异性。
2.5 重复性实验
根据SPSS10.0统计软件中的随机单位组设计资料的S–N–K方差分析方法进行分析:批间比较,F=0.487,P=0.673>0.05;批内比较,F=2.16,P=0.259>0.05,二者差异均无显著意义。说明建立的双抗夹心ELISA方法在批内和批间检测同一样品时差异不显著。根据公式CV=S/X×100%,计算批内和批间的变异系数均小于10%。可见用该方法检测样品具有较好的重复性。
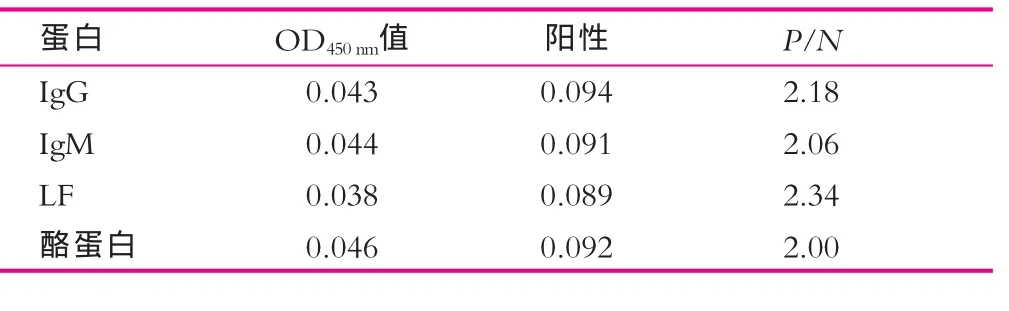
表3 特异性实验结果
2.6 稳定性实验
表4为稳定性实验结果。由表4可以看出,放置37℃(72 h)后所测sIgA质量分数基本不变,根据《中国生物制品检定规程》:一般37℃72 h破坏,与4℃放置相比较,读值下降不超过20%,认为其效期在6个月左右。由此可以断定本实验具有较好的稳定性。
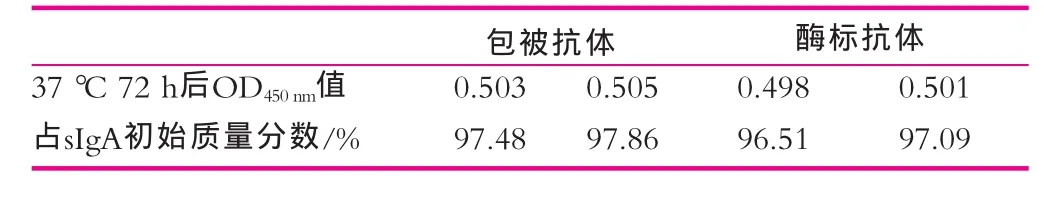
表4 稳定性实验结果
2.7 实际牛初乳粉样本的检测
表5为牛初乳粉样本检测结果。分别以A方法和B方法检测随机抽取的50个牛初乳粉样,依据表5所得数据做图,结果如图2所示。进行统计学分析:分别对两种方法所测数据进行F和t检验。置信度为95%时F计算<F表,这两种检测方法的精密度无显著性差异。再进行t检验:查t值表,f=48,95%置信度时t计算<t表,故这两种方法的测定结果无显著性差异。两种方法的检出符合率为92%。

表5 牛初乳粉样本检测结果
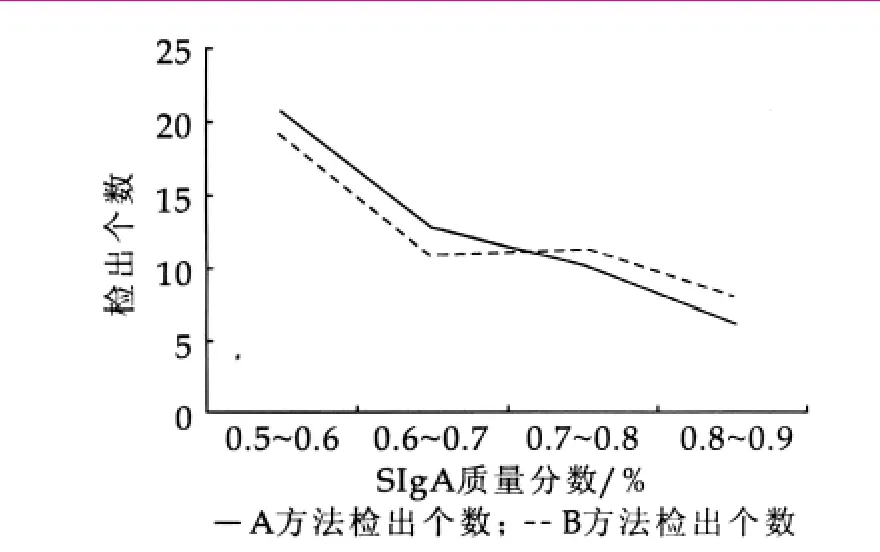
图2 A方法与B方法的比较
3 讨论
影响ELISA实验结果的因素很多,需要加强各个环节的质量才能充分发挥其方法学的优点。特别是固相载体的包被难达到各个体之间的一致,因此在本实验中每批测试均须用一系列不同质量浓度的参考标准品,在相同的条件下制作标准曲线。标准曲线稀释的最适比例可以直接影响到检测样本中sIgA质量浓度的最终检出值,因此选择标准曲线的最适稀释比例对于定量检测非常重要[10]。本研究所测的sIgA属于大分子量物质,故选择的标准曲线范围较宽,曲线最高点的吸光度接近2.0。以检测物的质量浓度为横坐标,以吸光度为纵坐标,将各质量浓度的值逐点连接,所得曲线一般呈S形,其头、尾部曲线趋于平坦,中央较呈直线的部分是最理想的检测区域。所以最后所确定的标准品的最适稀释比例应落在这个区域中。基于以上原因,本研究最后确定的最佳稀释质量浓度为1 000,500,250,125,62.5,31.25,15.625 μg/L。
目前国内还没有定量检测牛初乳中sIgA的标准方法,本研究选择双抗夹心ELISA作为检测牛初乳中sIgA的方法。该方法简单、快速、灵敏性高、有较好的重复性、结果判断较客观。为检测工业产品中sIgA的含量提供了参考。
[1] 杨致邦.初乳sIgA研究进展[M].国外医学:流行病学,传染病学分册,2004,31(3):188-190.
[2] 曹劲松,王晓琴.牛初乳功能性食品的开发现状和前景[J].食品科学,1999(5):14-17.
[3] 高丽霞,郭爱萍.牛初乳中的活性成分及其开发利用[J].农产品加工学刊,2010(4):46-57.
[4] 周惠珍,龚志木,乔伯英,等.辣根过氧化物酶标记葡萄球菌A蛋白的简易过碘酸钠法[J].中国人民解放军军医进修学院学报,1984,04:171-173.
[5] 项开合.牛乳铁蛋白单克隆抗体的制备及双抗夹心ELISA方法的建立[D].吉林:吉林大学,2007.
[6] ZHANG S H,LI L S,OU Y X,et al.Use of Monoclonal Antibodies in Detection of Clostridium botulinum Type B Toxin by ELISA[J].Journal of Medical Colleges of PLA.1986(03):246-252.
[7] 桑卓奇.ABC-ELISA定量测定红细胞趋化因子受体及其意义[J].黑龙江医学,2007,31(6):504-604.
[8] 刘丽萍,孙丽洲.定量检测ProMBP双抗体夹心方法的建立[J].南京医科大学学报,2008,28(7):836-840.
[9] 张志强,何萍.双抗体夹心ELISA定量检测血清Cap43蛋白方法的建立与评价[J].中国现代医学杂志,2007,17(13):1561-1564.
[10] 白雪.牛朊蛋白双抗夹心ELISA方法的建立[D].吉林:吉林大学,2008.
Establishment of a sandwich ELISA for quantitive measurement of sIgA
ZHU Hong-yan1,ZHAO Hong-yu1,ZHOU Sheng-hua1,GAO Xue-jun2
1.Heilongjiang Kanpure biotechnology Co.Ltd.,Harbin 150000;2.Key Laboratory of Dairy Science Ministry of Education Northeast Agricultural University,Harbin 150030,China)
To establish an effective ELISA mathod for the determination of bovine colostrum sIgA.Rabbit was immunized by bovine colostrum sIgA to obtain the antiserum.Useing the purified antiserum as coating antibody.All the anti-sIgA were labeled with horseradish peroxidase by sodium oxidation method,and take the HRP labeled anti-sIgA for labeled antibody.The optimal concentrations of ELISA were defined by titration.For speciticity reproducibility and sensitivity experiment and measured the sIgA levels of bovine colostrum with this assay.Results a sandwich ELISA assay for detecting sIgA in bovine colostrum was established successfully.The assay result was linear over a concentration range of 15.625~1 000 μg/L with a limit of detection(LOD)of 15.625 μg/L.The coefficients of variation was 4.8%within assay and 6.5%between assay.
ELISA,sIgA,measurement
TS252.7
A
1001-2230(2011)03-0050-03
2010-11-08
朱洪艳(1983-),女,本科,主要从事蛋白纯化研究。通讯作者:赵红宇
