TiO2·Al2O3复合氧化物载体研究进展
2011-10-18郭长友沈智奇张志民
郭长友,沈智奇,张志民
(中国石油化工股份有限公司抚顺石油化工研究院,辽宁 抚顺 113001)
进展与述评
TiO2·Al2O3复合氧化物载体研究进展
郭长友,沈智奇,张志民
(中国石油化工股份有限公司抚顺石油化工研究院,辽宁 抚顺 113001)
TiO2·Al2O3多孔复合氧化物是新型的催化剂载体材料,因其在加氢精制工艺上能够显著增加催化剂的脱硫、脱氮活性而逐渐受到重视。本文综述了国内外关于TiO2·Al2O3多孔材料的制备方法,分析了制备方法对材料的比表面积、孔结构、表面酸性等载体性能影响的一般规律。通过对国内外研究者的TiO2·Al2O3合成方法的综合评述,指出了有待发展提高的方向。
TiO2·Al2O3多孔复合氧化物;加氢精制;催化剂载体
能源和环境问题一直是影响我国社会、经济可持续发展的核心问题。一方面,当前所用的石油、煤炭等化石能源在地球上的储量非常有限,且都是不可再生资源,必须提高利用效率;另一方面,随着人们对生存环境问题的重视,对能源产品质量的要求越来越高。因此,在充分开发原料潜力的同时,也必须提高产品的质量。
石油是当今社会的最主要能源之一,提高原油利用率的核心问题是在炼油过程中提高重质油的加工能力。由于重质油中有害元素,如硫、氮等含量高,相应化合物的惰性强,就目前的加氢精制工艺而言不易脱除,成为当前的主要技术难题[1]。解决问题的主要途径之一就是改进加氢精制催化剂,提高脱硫、脱氮工艺。传统的加氢精制工艺的催化剂载体为γ-氧化铝,研究发现:用氧化钛作为替代载体能够使催化剂的加氢脱硫活性增加 3~5倍。但是,氧化钛具有比表面积低和热稳定性能差等缺点,导致催化剂的初始活性很高、稳定性差、失活快。而γ-氧化铝载体具有高比表面积、热稳定性强等优点,是很理想的载体材料[2],恰好能够弥补氧化钛载体的劣势。所以将两种载体的优点相结合,通过一定的方法合成TiO2·Al2O3复合载体,将是氧化钛用作催化剂载体的主要发展方向。
自20世纪90年代,关于TiO2·Al2O3复合载体的研究工作相继出现大量的文献报道,内容包括制备方法、物化性质、催化剂的活性以及它们之间的关联关系等。但国内外都没有关于这方面的综述性文献,本文主要总结了国内外文献中TiO2·Al2O3复合载体的合成方法及性能特征,分析了影响复合载体的晶体结构、比表面积、孔结构和表面羟基、酸度等结构和性能的主要因素。根据复合载体的获得途径本文分成两部分,第一部分是钛表面改性氧化铝,用TiO2/Al2O3表示;第二部分是用化学方法“一锅”同时合成复合载体,用TiO2-Al2O3表示。
1 TiO2/Al2O3复合载体
TiO2/Al2O3复合载体是通过将氧化钛负载或者嫁接在γ-氧化铝晶粒表面,进行氧化铝载体的表面改性获得的。氧化铝载体经钛改性后能够改变催化剂中活性相与载体作用关系,以MoS2/Al2O3为例,其作用关系为 Mo-O-Al,载体经钛改性后变为Mo-O-Ti,由此实现了氧化钛与活性相之间直接相互作用,而载体的比表面积、孔结构和稳定性及强度等由氧化铝载体提供。
1.1 表面改性方法
氧化铝表面钛改性常用的方法有浸渍法、气相吸附法和表面沉淀法。
浸渍法是合成多相固体催化剂中负载活性相的传统方法,其特点是工艺简单、经济和负载相分散性好。此方法常被用来在氧化铝晶粒表面负载氧化钛进行载体改性[3-5],具体工艺过程为:用钛醇盐的醇溶液,或用Ti(SO4)2水溶液作为浸渍液,也有研究者[6]采用氧化钛溶胶作为浸渍液,用等体积浸渍或过量浸渍等方法,按需要的负载量与氧化铝粉或成型后氧化铝载体搅拌混合,在一定条件下干燥和焙烧后,获得TiO2/Al2O3复合载体。
气相吸附法是在化学气相沉积(CVD)和原子层沉积技术(ALD)的基础上发展起来的一种纳米材料表面改性技术,又称嫁接法。此方法由吸附与水解两步反应实现,首先利用多孔氧化铝的吸附特性吸附气相钛前体,用水蒸气使钛前体在氧化铝表面水解形成氧化钛。具体工艺过程为:首先将氧化铝粉末或成型载体装入固定床反应器内密封,在负压条件下,用氮气或其它惰性气体作为载气,将TiCl4或甲基钛蒸气引入反应器中进行表面吸附;吸附饱和后,只通入惰性气体去除未表面吸附的 Ti前体;再载入水蒸气,实现表面水解,之后通入惰性气体除去吸附水。此吸附-水解过程多次循环,获得的样品经焙烧后形成氧化钛层嫁接在氧化铝晶粒表面的复合载体。日本上智大学的Segewa研究组[7-14]在这方面进行了系统的研究工作。
表面沉淀法是将 Ti前体溶液与氧化铝粉末或成型载体混合后,通过改变溶液的pH值,使Ti前体在氧化铝表面上水解,形成沉淀。如在 TiCl4水溶液中加入氧化铝粉,搅拌1 h后,用稀氨水调整pH值至7左右(原溶液pH值为0.5~1.0),将形成的沉淀收集、洗涤。
除此之外,还有其它的氧化铝表面改性方法,如Jayasankar等[15]先制成钛溶胶,再将氧化铝粉末与钛溶胶混合后,在一定条件下凝胶,用溶胶-凝胶法合成了Al2O3@TiO2核-壳结构的复合氧化物。Yu等[16]用蒸气热方法在薄水铝石表面涂覆氧化钛,将薄水铝石粉末与四丁基钛在醇溶剂中混合,把溶液与水分别放在同一反应釜的两个腔内,密封后在180 ℃下反应,高温产生的水蒸气扩散到醇溶液中,使四丁基钛在薄水铝石表面水解。
Wei等[17]比较研究了浸渍法、气相吸附法和表面沉淀法改性对氧化铝载体性能的影响,结果显示:表面钛改性使氧化铝表面酸性降低(氨气吸附),而气相吸附法比其它两种方法使酸性降低的程度更明显,这是因为气相法改性使氧化钛在氧化铝表面单层分散性最好。3种方法改性对比表面积的影响规律不同,前两种方法改性后,随钛负载量增加,载体的比表面积降低。而表面沉淀法改性对原氧化铝载体的比表面积影响与焙烧温度有关。经500 ℃焙烧后,比表面积先增加,负载量在20%(质量分数)时达到最大值,后降低,在40%左右与原粉相当。焙烧温度升高,与前两种方法的影响规律趋同。XRD结果表明:比表面积增加是由TiO2细小颗粒引起的。温度升高,小颗粒聚集、长大,比表面积降低。这与 Gutierrez-Alejandre等[18]的实验结果一致,后者研究了Ti浸渍薄水铝石和氧化铝,发现对薄水铝石浸渍、焙烧后,产生的颗粒混合效应也使比表面积增加。而浸渍法使氧化钛在氧化铝表面近似单层分散,降低比表面积、孔容和孔径,但影响幅度很小。
1.2 表面改性理论
(1)表面羟基理论。用固体红外光谱法(FTIR)可以分析氧化铝表面的羟基(—OH)官能团的振荡吸收峰。根据Busca理论[19],红外吸收峰在3775 cm-1和3780 cm-1上对应于四面体Al3+离子上的羟基,在3730 cm-1吸收频率对应于八面体Al3+离子上的羟基,在3680 cm-1对应的是桥连的羟基。表面负载后,氧化铝的表面羟基与钛的前体发生缩水反应,形成Al—O—Ti键。Gutierrez-Alejandre等[18]研究结果显示:用浸渍方法在氧化铝表面负载上氧化钛后,FTIR方法表征高频羟基吸收峰强度降低,随氧化钛负载量增加,吸收峰强度进一步降低。表明四面体上的羟基更容易被氧化钛取代。此结果与Segawa研究组[12]用气相吸附法对氧化铝表面钛改性后的红外光谱研究结果相同。说明无论气相吸附还是浸渍法,负载原理是相同的。
(2)表面缺陷理论。在氧化铝表面存在许多晶体缺陷,如空位、台阶、扭结等高能量点,钛原子首先被吸附到这些能量的有利位置,Yang等[20]研究认为钛首先在氧化铝表面上的扭结位置吸附。王军等[21]及 Hu等[22]提出负载镶嵌理论,认为 Ti4+离子首先进入氧化铝表面的氧八面体间隙位置,形成镶嵌阳离子,多余的正电荷由O2-离子补偿。八面体间隙填满后,过剩的Ti4+离子才能形成氧化钛“分子”。
综上所述,Ti表面改性能够改变氧化铝的表面酸性和羟基等性能,而对载体的比表面积和孔结构影响不大,是获得复合载体的有效途径。从实验效果看,表面改性应首选气相吸附方法,但此方法的样品处理量小,需要负压条件,成本高。因而浸渍方法是不错的选择。另一方面,负载氧化钛的热稳定性和水热稳定性有待进一步考察。
2 TiO2-Al2O3复合载体
2.1 TiO2-Al2O3复合载体的合成方法
TiO2-Al2O3复合氧化物可以用经典的溶液化学方法,如溶胶-凝胶法、沉淀法、水热法和熔盐法等进行制备。
2.1.1 溶胶-凝胶法
溶胶-凝胶法是制备金属氧化物常用的一种溶液化学方法,被广泛地应用于TiO2- Al2O3复合载体的合成。此方法是将钛和铝的醇盐在醇溶剂中进行均匀的混合,用水作为水解剂,让两种醇盐共同发生水解-缩聚反应,形成由复合氢氧化物胶体粒子组成的溶胶。溶胶在一定条件下老化形成凝胶,经干燥、焙烧后就制成复合氧化物。典型的工艺过程为[23]:用回流方式将异丙醇铝溶于异丙醇中,冷却到室温后按需求的比例加入异丙醇钛,混合均匀。之后,在强力搅拌下滴加水的异丙醇溶液,用硝酸控制溶液为酸性条件,直至形成凝胶。
熊刚等[24]采用非醇盐的溶胶-凝胶法合成复合氧化物,用Ti(SO4)2作为钛源,在水溶液中用NaOH溶液沉淀形成 Ti(OH)4,再用硝酸溶液溶解形成Ti(NO3)4溶液。将Ti(NO3)4溶液与Al(NO3)3溶液搅拌混合,向混合溶液中加入聚乙二醇(PEG),继续搅拌均匀后,蒸发掉水分,形成凝胶。
TiO2-Al2O3复合载体也可以用混胶方法[25]制得。混胶法首先分别制成氧化铝和氧化钛的胶体溶液,再按需要的比例将两种胶体溶液混合,混合的胶体溶液经老化后形成凝胶。这种方法的优势在于允许前体溶解性质不同,换言之,可以用水溶胶和醇溶胶进行混胶。Choi等[26]采用薄水铝石溶胶与TiO2溶胶混胶后,经油滴成球工艺合成直径 1~2 mm的介孔复合氧化物球。
溶胶-溶液混合法则先制成铝溶胶,之后将TiCl4与铝溶胶溶液混合,再将溶液老化、凝胶,经干燥后获得复合粉末。
2.1.2 沉淀法
醇盐直接水解沉淀是合成复合载体的最简单方法,此方法很容易与溶胶-凝胶法相混淆,它们的主要区别在于水的加入量:前者加入的水是过量的,如文献[27-29]中所报道的加入水量是醇盐水解化学计量比的30倍;而后者,水的加入量约等于醇盐水解化学计量比。另外,前者形成的是白色絮状沉淀物。而后者形成的是透明胶体溶液。
中和沉淀法是将偏铝酸钠(NaAlO2)与 TiCl4分别配成水溶液,按需要比例混合,由于偏铝酸钠是碱性的,而 TiCl4是酸性的,所以混合后将发生方程式(1)所示的化学反应而形成沉淀。

反应生成的氧化铝与氧化钛比例是2∶1。如果复合氧化物所需求的比例发生改变,将会出现 Al多的情况,需要用酸中和,如硝酸;或者钛多,则需要用碱中和,如NaOH和氨水。此方法与生产氧化铝的硫酸铝法很相近,可以利用其工艺实现复合载体的连续生产,工艺流程为:在沉淀反应腔壁上同时引出三路管线,通过管线将碱性的偏铝酸钠溶液、酸性的 TiCl4溶液和酸或碱溶液(用于调整溶液 pH值)分别引进反应腔进行在线反应[30-31],形成的沉淀通过过滤方式收集、干燥和焙烧。在此基础上,蒋宗轩等[32]对该工艺进一步改进,采用TiCl4+AlCl3溶液替代TiCl4溶液,解决了TiCl4在水溶液中水解速度过快的问题。此方法与早期William等[33]采用的方法具有相似之处,后者采用Ti(SO4)2+Al2(SO4)3的硫酸溶液与铝酸钠溶液进行中和反应合成复合载体。
氨沉淀法:Viveros等[34]用TiCl4和 AlCl3作为金属源,将它们溶于冷水中(低于 10 ℃),用氨水作为沉淀剂,在强力搅拌下加入,调整溶液的pH值,获得沉淀。王春英等[35]采用Ti(SO4)2与硝酸铝混合后也用氨水沉淀,获得复合载体。
均相沉淀法:沉淀过程中,用尿素作为沉淀剂,室温下先与溶液混合均匀,温度升高到 90 ℃,尿素分解产生—OH,进行均相沉淀。
2.1.3 其它合成方法
水热/溶剂热方法是在纳米材料合成上广泛应用一种高温、高压合成方法。但其在TiO2-Al2O3复合载体的合成方面应用不多,只有Garcia- Benjume等[36],Mishra等[37]、Janes等[38]研究者报道了一些成果,但只是将其作为一种辅助的处理方法,而不是合成方法。
法国研究者Harle等[39]采用熔融硝酸钠作为反应介质的熔盐法合成TiO2-Al2O3复合载体,钛和铝源分别采用 TiOSO4·xH2O 和 Al2(SO4)3·18H2O,在反应前先经高温脱结晶水处理。将它们按一定比例与硝酸钠混合后,升温到400 ℃反应2 h。硫酸盐与硝酸钠反应过程如方程(2)所示。
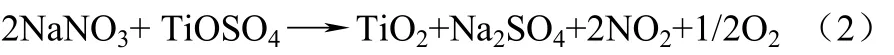
Kooli等[40]合成了一种有序层状氧化钛/氧化铝复合材料,通过先合成层状质子型钛酸盐,用四丁基氢氧化铵溶液进行脱层处理,用硝酸铝和四甲基氢氧化铵溶液制成Al13[AlO4Al12(OH)24(H2O)12]7+多聚阳离子柱化溶液。将前面的钛盐溶液加入到柱化液中,在80 ℃下搅拌12 h,就可以形成层状的复合材料。
利用现有的氧化铝生产工艺合成复合载体,因对工艺改动小,设备利用率高而受到工业催化剂研究者的青睐。Munoz-Lopez等[41]在工业pH值摆动法生产氧化铝工艺基础上,通过 H2SO4、TiOSO4溶液和偏铝酸钠溶液混合,pH值在2~8摆动6次,生产出氧化钛在氧化铝表面完好分散的复合载体。蒋绍洋等[42]在碳化法生产氧化铝的过程中,引入异丙醇钛;方维平等[43]在氢氧化铝浆液中用氨水沉淀钛盐的方法,获得的复合载体与Munoz-Lopez的pH值摆动法合成的载体具有相同的结构。
2.2 TiO2-Al2O3复合载体结构及稳定性
虽然作为催化剂载体,氧化钛和氧化铝的理想结构分别是锐钛矿和γ-氧化铝,但实际上它们都有不止一种晶体结构,这使复合载体的结构更加多样化。Janes等[38]研究结果显示:溶胶-凝胶法合成的复合氧化物是非晶结构的(XRD),非晶晶化最高温度达 800 ℃。晶化温度与氧化钛含量有关,氧化钛含量增加,晶化温度降低。晶化产物也随氧化钛含量不同而变化。氧化钛含量低时(10%,摩尔分数,下同),产物是γ-氧化铝;氧化钛含量增加时(25%),产物是金红石、锐钛矿和γ-氧化铝的混合物;含量在50%时,复合氧化物在500 ℃晶化,产物是锐钛矿,800 ℃焙烧后转化成金红石。Montoya等[44]所合成的复合氧化物中,氧化钛含量在50%时,非晶在800 ℃焙烧后直接转化成金红石氧化钛,没有发现锐钛矿形成。Gutierrez-Alejandre等[45-46]研究发现复合载体中氧化铝含量很低时(<10%),在氧化钛表面形成氧化铝单层,能阻止氧化钛颗粒长大和向金红石转变,起到提高氧化钛稳定性作用;氧化钛含量很低时(<10%),氧化钛固溶在氧化铝体相里,Ti4+离子占据氧化铝中氧八面体间隙位置。Stakheev等[47]研究认为Ti4+固溶延迟了氧化铝晶化,提高了氧化铝非晶的晶化温度。Montoya等[44]研究结果显示,升高焙烧温度,固溶到氧化铝的氧化钛以金红石结构析出、长大。Janes等[38]还研究了复合粉末的水热稳定性,结果显示:非晶态的复合氧化物经水热处理后出现相分离,形成薄水铝石和锐钛矿相。
Subramanian等[48]报道了一种溶胶-凝胶方法:首先用溶剂热方法合成锐钛矿结构的氧化钛溶胶,再与商业氧化铝混合、干燥,合成的复合氧化物。此复合氧化物中锐钛矿结构能够稳定到900 ℃,而通常方法合成的复合载体中,氧化钛在800 ℃就转变成金红石结构。Padmaja等[49]用铝溶胶-钛/冰乙酸溶液混合法合成复合载体,其实验结果显示,氧化钛的锐钛矿结构能够稳定到1000 ℃。
综合以上研究成果,可以看出:通常合成复合载体的结构是非晶态,焙烧温度较低时仍能保持非晶态,提高焙烧温度,非晶晶化。晶化产物是氧化钛相和氧化铝相的混合,没有出现新的晶态化合物。通过改变合成方法可以提高非晶晶化和活性氧化钛的稳定温度。
2.3 TiO2-Al2O3复合载体比表面积
TiO2-Al2O3复合载体的比表面积与合成方法、焙烧温度和氧化钛含量都密切相关。Linacero等[23]研究了溶胶-凝胶法合成的从氧化铝到氧化钛宽组分组成的复合载体,结果显示:复合载体的比表面积高于任一单组分氧化物,即在TiO2-Al2O3成分范围内,比表面积存在最大值。氧化钛摩尔分数为20%时(500 ℃焙烧),最大比表面积为361 m2/g,而此方法合成的氧化铝和氧化钛的比表面积分别为 296 m2/g和14 m2/g。Ramirez等[50]的实验结果显示:用醇盐直接水解沉淀法获得的复合载体经 550 ℃焙烧后,氧化钛含量为50%时,载体的比表面积达到最大值500 m2/g。Viveros等[34]用 TiCl4与AlCl3共沉淀合成复合载体,研究了氧化钛摩尔分数在7%、17%和50%时的物理吸附性能,载体的比表面积分别为340 m2/g、380 m2/g和395 m2/g(经500℃焙烧)。用相同合成方法获得的复合载体其比表面积也相差较大,如同样用铝酸钠与氯化钛共沉淀法合成载体,Grzechowiak等[31]实验结果显示:复合载体在氧化钛摩尔分数为 0、12%、24%和 56%时,比表面积分别为209 m2/g、304 m2/g、317 m2/g和343 m2/g。而Damyanova等[51]在氧化钛摩尔分数为0、21%和26%时,获得的载体比表面积分别为172 m2/g、235 m2/g和242 m2/g。Martin等[52]获得的实验结果是在氧化钛摩尔分数为0、8%、17%和22%时,对应比表面积分别为165 m2/g、156 m2/g、153 m2/g和138 m2/g。具体的差异可能与每个研究者的合成细节有关。蒋晓原等[53]详细地研究了共沉淀法合成过程中一些实验条件的改变对复合载体比表面积的影响,发现制备流程、溶液的pH值、反应温度和沉淀剂等都在一定程度上影响载体的比表面积。Montoya等[44]的实验结果显示,焙烧温度影响复合载体的比表面积,焙烧温度升高,比表面积下降。焙烧温度对钛含量高的载体影响幅度大,即载体钛含量越高,比表面积随温度下降越快。
这些方法合成的复合载体虽然比表面积高,但孔容低(≤0.5 mL/g),孔径小(≤5 nm),所以孔结构较差,亟需改善提高。
2.4 TiO2-Al2O3复合载体孔结构调变
通过改变实验条件可以改善复合载体的比表面积和孔结构等性能。Morán-Pineda等[54]的研究结果显示:在溶胶-凝胶过程中,改变溶液的pH值对复合载体的比表面积和孔结构都有一定的影响,在酸性条件(pH=3)下合成的复合载体的比表面积和孔径比碱性条件(pH=9)的更高,而且对孔径影响更显著。
Klimova研究组[55-56]在改善复合载体孔结构方面进行了系统研究。首先,在醇盐水解合成复合载体的过程中用碳酸铵溶液替代水,因为在溶液中形成了 NH4-CO32--Al化合物,起到调变复合载体的比表面积和孔结构的作用。以氧化钛含量为50%的载体为例,比表面积、孔体积和孔径分别从 233 m2/g、0.24 mL/g和3.9 nm增加到343 m2/g、0.87 mL/g和7.6 nm。另外,在反应过程中通过引入聚合物,如聚乙二醇(PEG)、聚丙醇(PPG)、聚丙烯酰胺(PAA)和聚乙烯醇(PVA)等作为扩孔剂,也能提高复合载体的比表面积,并改善孔结构。比表面积最高可达380 m2/g,孔体积可达0.73 mL/g,形成双孔道分布,平均孔径6.1 nm。聚合物的影响规律为:相同分子量的不同聚合物的加入对复合载体的比表面积、孔结构没有影响。随聚合物分子量增加,对比表面积增加量有限,主要增加孔径为20~100 nm的孔体积。聚合物比例增加,能够大幅增加比表面积和孔体积,但对孔径影响甚微[57]。
Mishra等[37]采用水热合成法,以无水硝酸铝与异丙醇钛为金属源,四丙基氢氧化铵(TPAOH)作为制孔剂,在温度180 ℃、静态密闭条件下,水热反应4天合成复合载体(TiO2/Al2O3=0.24),经600℃焙烧后,其比表面积为220 m2/g,孔体积为0.83 mL/g,孔分布是双孔道分布,平均孔径 6.7 nm。Escobar等[58]在溶胶-凝胶法合成复合载体时加入乙酸,可以增加孔体积至1.0 mL/g以上,孔径增加到10 nm以上。
Farag等[59]在溶胶过程引入离子液体,可以使复合载体的比表面积达到500 m2/g ,但孔结构需进一步改善。离子液体的优势是可以回收、反复使用。而且无挥发物,对环境污染小。
近来,Morris等[60]用嵌段共聚物P123作为模板剂,采用溶胶-凝胶+溶剂蒸发自组装方法,用硝酸作为催化剂,在无水乙醇溶液中合成了有序介孔TiO2-Al2O3复合材料,其中 TiO2摩尔分数可以从0~75%内调控。有序介孔尺寸为10 nm左右,孔体积能达到0.7 mL/g。比表面积最大可达438 m2/g。用相近的方法,Kim等[61]用盐酸作为催化剂,在异丙醇溶液中合成了有序介孔材料。相比前者,其介孔的有序化程度更高,孔径在6~7 nm,单组分TiO2的比表面积高达181 m2/g,随氧化铝含量增加,比表面积增大。
2.5 复合材料的表面酸性
复合载体的表面酸性较为复杂,早期研究认为无论是富氧化钛还是富氧化铝,表面主要以L酸为主[27,54,62]。Morán-Pineda 等[54]研究发现溶胶-凝胶法中溶液的pH值影响复合载体的L酸强度分布,碱性条件比酸性条件下获得的载体有更多的强酸点。
Walker等[63]的研究显示:复合载体表面既有L酸也有B酸,随复合载体中钛含量增加,载体的酸密度随之增加,酸密度增加主要是L酸引起的,因为B酸在钛含量为10%时已经达到最大值。Zhu等[64]系统研究了合成方法及钛含量、焙烧温度等对复合载体表面酸性的影响,结果显示随氧化钛含量的增加,总酸量、酸密度和酸强度都降低,但B酸的比例在增加。焙烧温度升高,总酸量和B酸比例都随之下降,酸强度增加。
从以上的研究结果可以得出,TiO2-Al2O3复合载体的表面酸性较为丰富,既有L酸,也有B酸。而且通过改变合成方法、化学组分和焙烧温度等实验条件,进行适当的调变,获得理想的表面性能。
3 结 语
综上所述,用氧化铝表面钛改性方法获得的复合载体的性能相对稳定,主要由氧化铝本身的性能决定。而“一锅法”同时合成的复合载体的结构及比表面积、孔结构和表面酸性等性能具有多样性特点,与合成方法、组分比例和焙烧温度等条件紧密相关。因此可以通过适当改变这些因素获得不同的载体性能,从而使TiO2·Al2O3复合载体在催化领域的应用空间越来越广阔。
虽然对TiO2·Al2O3复合载体的研究已经取得显著成果,为实现工业上的应用奠定了科学基础,然而,在此方面的科学和应用研究尚有诸多不足之处:①无论对表面改性还是“一锅法”合成的复合载体的微观结构研究尚显不够,特别是缺少高水平的基础研究工作;②复合载体强度,水热稳定性等作为催化剂的基本物理性质需要更多的理论和实践支持;③如何控制工业级的生产工艺,实现复合载体性能的控制,尚需大量的实验数据。
[1] Song C. An overview of new approaches to deep desulfurization for ultra-clean gasoline,diesel fuel and jet fuel[J].Catal. Today,2003,86:211-263.
[2] Trueba M T,Trasatti S P. γ-Alumina as a support for catalysts:A review of fundamental aspects[J].Eur. J. Inorg. Chem.,2005:3393-3403.
[3] Parrott S L,Kukes S G,Brandes K K. Hydrofining catalyst composition and process for its preparation:US,4687757[P]. 1987.
[4] Parrott S L,Kukes S G,Brandes K K. Hydrofining process:US,4734186[P]. 1988.
[5] Mayoral P R,Juarez J A,Solis J F R. Catalyst for the hydrodesulfurization of residua and heavy crudes:US,0123416 A1[P]. 2007.
[6] 胡晓丽,段宏昌,王海彦,等. NiMo/ TiO2-Al2O3催化二苯并噻吩加氢脱硫反应[J]. 精细石油化工进展,2007,8(1):36-39.
[7] Saih Y,Nagata A,Funamoto T,et al. Ultra deep hydrodesulfurization of dibenzothiophene derivatives over NiMo/TiO2-Al2O3catalysts[J].Appl. Catal. A:Gen.,2005,295(1):11-22.
[8] Saih Y,Segawa K. Ultradeep hydrodesulfurization of dibenzothiophene(DBT)derivatives over Mo-sulfide catalysts supported on TiO2-coated alumina composite[J].Catal. Surv. Asia.,2003,7(4):235-249.
[9] Saih Y,Segawa K. Tailoring of alumina surfaces as supports for NiMo sulfide catalysts in the ultra deep hydrodesulfurization of gas oil:Case study of TiO2-coated alumina prepared by chemical vapor deposition technique[J].Catal. Today,2003,86(1-4):61-72.
[10] Segawa K,Funamoto T,Watanabe M. Development of a new type of NiMo/TiO2-Al2O3catalysts for ultra deep HDS of gas oil[C]//Abstr.Paper. Am. Chem. Soc. Natl. Meeting,2005,230:2344-2345.
[11] Froment G F,Delmon B,Grange P.Hydrotreatment and Hydrocracking of Oil Fractions[M]. Amsterdam;Elsevier,1999:127,129-136.
[12] Segawa K,Katsuta M,Kameda F. TiO2-coated on Al2O3support prepared by the CVD method for HDS catalysts[J].Catal. Today.1996,29(1-4):215-219.
[13] Pophal C,Kameda F,Hoshino K,et al. Hydrodesulfurization of dibenzothiophene derivatives over TiO2-Al2O3supported sulfided molybdenum catalyst[J].Catal. Today,1997,39:21-32.
[14] Yoshinaka S,Segawa K. Hydrodesulfurization of dibenzothiophenes over molybdenum catalyst supported on TiO2-Al2O3[J].Catal.Today,1998,45:293-298.
[15] Jayasankar M,Ananthakumar S,Mukundan P,et al. Al2O3@ TiO2——A simple sol-gel strategy to the synthesis of low temperature sintered alumina-aluminium titanate composites through a core-shell approach[J].J. Solid State Chem.,2008,181:2748-2754.
[16] Yu X,Yu J,Cheng B,et al. Synthesis of hierarchical flower-like AlOOH and TiO2/AlOOH superstructures and their enhanced photocatalytic properties[J].J. Phys. Chem. C,2009,113:17527-17535.
[17] Wei Z B,Xin Q,Guo X X. Titania-modified hydrodesulphurization catalystsⅠ. Effect of preparation techniques on morphology and properties of TiO2-Al2O3carrier[J].Appl. Catal.,1990,63(1):305-317.
[18] Gutierrez-Alejandre A,Ramirez J,Val I J,et al. Activity of NiW catalysts supported on TiO2-Al2O3mixed oxides effect of Ti incorporation method on the HDS of 4,6-DMDBT[J].Catal. Today,2005,107-108:879-884.
[19] Busca G,Lorenzelli V,Escribano V S,et al. FT-IR study of the surface properties of the spinels NiAl2O4and CoAl2O4in relation to those of transitional aluminas[J].J. Catal.,1991,131:167-177.
[20] Yang X Y,Zhang K,Luo X H,et al. Influence of TiO2on surface-properties of Al2O3[J].Reac. Kinet. Catal. L.,1992,46(1):179-186.
[21] 王军,马刚,胡玉海,等. NiO在g-Al2O3及TiO2/g-Al2O3载体上的表面存在状态[J]. 无机化学学报,2001,17(1):43-49.
[22] Hu Y H,Liu T D,Shen M M,et al. Influence of titanium oxide on the surface interactions of MO(M = Cu and Ni)/gamma-Al2O3catalysts[J].J. Solid State Chem.,2003,170(1):58-67.
[23] Linacero R,Rojas-Cervantes M L,Lopez-Gonzalez J D. Preparation ofxTiO2·(1-x)Al2O3catalytic supports by the sol-gel method:Physical and structural characterization[J].J. Mater. Sci.,2000,35(13):3279-3287.
[24] Xiong G,Wang X,Lu L D,et al. Preparation and characterization of Al2O3-TiO2composite oxide nanocrystals[J].J. Solid State Chem.,1998,141(1):70-77.
[25] 段爱军,黄卫强,窦涛,等. 一种钛铝复合氧化物载体加氢脱硫催化剂及制备方法:中国,101199935[P]. 2006.
[26] Choi J,Kim J,Yoo K S,et al. Synthesis of mesoporous TiO2/γ-Al2O3composite granules with different sol composition and calcination temperature[J].Powder Technol.,2008,181:83-88.
[27] Lahousse C,Mauge F,Bachelier J,et al. Acidic and basic properties of titania-alumina mixed oxides-active-sites for Propan-2-ol dehydration[J].J. Chem. Soc.-Fara. Trans.,1995,91(17):2907-2912.
[28] Guevara-Lara A,Bacaud R,Vrinat M. Highly active NiMo/TiO2-Al2O3catalysts:Influence of the preparation and the activation conditions on the catalytic activity[J].Appl. Catal. A:Gen.,2007,328(2):99-108.
[29] Lecrenay E,Sakanishi K,Nagamatsu T,et al. Hydrodesulfurization activity of CoMo and NiMo supported on Al2O3-TiO2for some model compounds and gas oils[J].Appl. Catal. BEnviron.,1998,18(3-4):325-330.
[30] Mouret G.,Moze K,Muhr H,et al. Production of Al2O3-TiO2catalyst supports with controlled properties using aco-precipitation process[J].Powder Technol.,2009,1990:84-88.
[31] Grzechowiak J R,Wereszczako-Zielinska I,Mrozinska K. HDS and HDN activity of molybdenum and nickel-molybdenum catalysts supported on alumina-titania carriers[J].Catal.Today,2007,119:23-30.
[32] 蒋宗轩,李国强. 一种氧化铝-氧化钛双组分的制备方法:中国,1095689C[P]. 2002.
[33] William H Q,Shelton C. Hydrotreating catalyst:US,4465790[P].1984.
[34] Viveros T,Zarate A,Lopez M A,et al. Alumina support modified by Zr and Ti:Synthesis and characterization[J].Preparation Catal.,1995,91:807-815.
[35] 王春英,王攀,漆新华,等. SO42-/Al2O3-TiO2转化纤维素生成乙酰丙酸[J]. 化工进展,2009,28(1):126-129.
[36] Garcia-Benjume M L,Espitia-Cabrera M I,Contreras-Garcia M E.Hierarchical macro-mesoporous structures in the system TiO2-Al2O3,obtained by hydrothermal synthesis using Tween-20(R)as a directing agent[J].Mater. Charact.,2009,60(12):1482-1488.
[37] Mishra H K,Stanciulescu M,Charland J P,et al. Mesoporous titania-alumina mixed oxide:a preliminary study on synthesis and application in selective catalytic reduction of NOx[J].Appl. Surf. Sci.,2008,254:7098-7103.
[38] Janes R,Knightley L J. Synthetic routes to microfine biphasic titania-alumina powders[J].Dyes and Pigments,2003,56(2):111-124.
[39] Harle V,Vrinat M,Scharff J P,et al. Catalysis assisted characterizations of nanosized TiO2-Al2O3mixtures obtained in molten alkali metal nitrates——Effect of the metal precursor[J].Appl.Catal. AGen.,2000,196(2):261-269.
[40] Kooli F,Sasaki T,Rives V,et al. Synthesis and characterization of a new mesoporous alumina-pillared titanate with a double-layer arrangement structure[J].J. Mater. Chem.,2000,10(2):497-501.
[41] Munoz-Lopez J A,Toledo J A,Escobar J,et al. Preparation of alumina-titania nanofibers by a pH-swing method[J].Catal. Today,2008,133:113-119.
[42] 蒋绍洋,王刚,赵愉生,等. 一种含钛氢氧化铝的制备方法:中国,1251795C[P]. 2003.
[43] 方维平,苏晓波,张皓,等. 一种含钛氢氧化铝及其制备方法和用途:中国,1102432[P]. 1999.
[44] Montoya J A,Angel P,Viveros T. The effect of temperature on the structural and textural evolution of sol-gel Al2O3-TiO2mixed oxides[J].J. Mater. Chem.,2001,11:944-950.
[45] Gutierrez-Alejandre A,Trombetta M,Busca G,et al. Characterization of alumina-titania mixed oxide supports. 1. TiO2-based supports[J].Micropor. Mater.,1997,12(1-3):79-91.
[46] Gutierrez-Alejandre A,Gonzalez-Cruz M,Trombetta M,et al.Characterization of alumina-titania mixed oxide supports - part II:Al2O3-based supports[J].Micropor. and Mesopor. Mater.,1998,23(5-6):265-275.
[47] Stakheev A Y,Baeva G N,Telegina N S,et al. Scientific Bases for the Preparation of Heterogeneous Catalysts[M]. Amsterdam:Elesvier,2002,143:509-516.
[48] Subramanian V,Ni Z,Seebauer E G,et al. Synthesis of high-temperature titania-alumina supports[J].Ind.. Eng. Chem. Res.,2006,45:3815-3820.
[49] Padmaja P,Warrier K G K,Padmanabhan M,et al. High surface area sol-gel alumina-titania nanocatalyst[J].J. Sol. Gel. Sci. Technol.,2009,52:88-96.
[50] Ramirez J,Ruizramirez L,Cedeno L,et al. Titania alumina mixed oxides as supports for molybdenum hydrotreating catalysts[J].Appl.Catal. A Gen.,1993,93(2):163-180.
[51] Damyanova S,Spojakina A,Jiratova K. Effect of mixed titania-alumina supports on the phase-composition of NiMo/TiO2-Al2O3catalysts[J].Appl. Catal. A Gen.,1995,125(2):257-269.
[52] Martin C,Martin I,Rives V,et al. Catalytic activity of NiMo/TiO2-Al2O3systems in thiophene hydrodesulfurization[J].React. Kinet. Catal. L.,1995,54(1):203-208.
[53] 蒋晓原,林辉,李惠娟,等. 一种TiO2/g-Al2O3复合载体的制备方法:中国,101234358A[P]. 2008.
[54] Morán-Pineda M,Castillo S,Asomoza M,et al. Al2O3-TiO2sol-gel mixed oxides as suitable supports for the reduction of NO by CO[J].React. Kinet. Catal. L.,2002,76(1):75-81.
[55] Klimova T,Huerta Y,Cervantes M L R,et al. Control of porosity and surface area in TiO2-Al2O3mixed oxides supports by means of ammonium carbonate[J].Preparation Catal.Ⅵ,1995,91:411-420.
[56] Klimova T,Gonzalez H,Hernandez R,et al. Tuning of textural and structural characteristics of Al2O3-TiO2mixed oxide supports[J].Preparation Catal.Ⅶ,1998,118:807-815.
[57] Klimova T,Carmona E,Ramirez J. Organic polymers as pore-regulating agents in TiO2-Al2O3mixed oxide catalytic supports[J].J. Mater. Sci.,1998,33(8):1981-1990.
[58] Escobar J,de Los Reyes J A,Viveros T. Nickel on TiO2-modified Al2O3sol-gel oxides - effect of synthesis parameters on the supported phase properties[J].Appl.Catal. A Gen.,2003,253(1):151-163.
[59] Farag H,Al Zoubi M,Endres F. Sol-gel synthesis of alumina,titania and mixed alumina/titania in the ionic liquid 1-butyl-1-methylpyrrolidinium bis(trifluoromethylsulphonyl)amide[J].J. Mater. Sci.,2009,44(1):122-128.
[60] Morris S M,Horton J A,Jaroniec M. Soft-templating synthesis and properties of mesoporous alumina-titania[J].Micropor. Mesopor.Mater.,2010,128(1-3):180-186.
[61] Kim J Y,Kang S H,Kim H S,et al. Preparation of highly ordered mesoporous Al2O3/TiO2and its application in dye-sensitized solar cells[J].Langmuir,2010,26(4):2864-2870.
[62] Nakabayashi H. Properties of acid sites on TiO2-SiO2and TiO2-Al2O3mixed oxides measured by infrared-spectroscopy[J].Bull. Chem. Soc.Japan,1992,65(3):914-916.
[63] Walker G S,Williams E,Bhattacharya A K. Preparation and characterization of high surface area alumina-titania solid acids[J].J.Mater. Sci.,1997,32(21):5583-5592.
[64] Zhu J F,Zhu Y Q. The influence of preparation conditions of Al2O3-TiO2upon acid sites properties[J].Chinese J. Inorg. Chem.,1999,15(4):429-434.
Research progress of TiO2·Al2O3composite support
GUO Changyou,SHEN Zhiqi,ZHANG Zhimin
(Fushun Research Institute of Petroleum and Petrochemicals,SINOPEC,Fushun 113001,Liaoning,China)
Porous composite oxide of TiO2·Al2O3is a new type of catalyst support,which has attracted increasing attention due to its capability to improve catalytic activity for hydrodesulfurization(HDS)and hydrodenitrogenation(HDN)of hydrotreating catalyst. This paper reviews the studies on the synthesis of porous TiO2·Al2O3and analyzes influence factors of catalyst support properties,such as textural property and surface acidity etc,in the synthesis process.
porous composite oxide of TiO2·Al2O3;hydrotreating;catalyst support
TQ 426.65
A
1000-6613(2011)07-1482-07
2011-03-07;修改稿日期:2011-05-06。
及联系人:郭长友(1979—),男,工程师,主要研究方向为多孔纳米材料的表面性能及改性。E-mail cyguo4321@yahoo.com.cn。
