巴西“功能与健康声称产品管理办法”解析
2011-10-17佘遥张海峰
佘遥 张海峰
北京林业大学 何颖敏

巴西的功能与健康声称产品包含功能与健康食品、补充剂、生物活性物质与益生菌三大类。巴西功能与健康声称产品的管理机构是巴西国家卫生监督局(National Health Surveillance Agency),简称ANVISA。ANVISA对每个产品逐一展开功能评价,功能食品与新成分技术与科学委员会(Technical and Scientific Committee on Functional Food and Novel Ingredients)(简称CTCAF)为ANVISA提供科学咨询。本文对巴西“功能与健康声称产品管理办法”进行解析。
1 功能与健康声称产品概述
在拉丁美洲的国家中,巴西是唯一对允许声称功能与健康的产品(以下统称为功能与健康声称产品)制定了较完善的监管法规的国家。巴西制定了“功能与健康声称”的定义,并允许产品使用这两种声称。对于声称,有一定的限制,如:健康声称仅允许声称“保持健康”或“减少患病风险”,而不允许声称“预防”和“治疗”。那些声称了“预防”和“治疗”的产品,按药品管理。在巴西,食品和药品通过预期用途、说明形式和目标人群严格区分。食品与具有药理学功能草药的混合物被认为属于药品或草本药剂,也按药品管理。
功能与健康食品属于食品范畴,而非药品,可作为日常饮食的一部分,并可声称其有益于健康。补充剂仅指矿物质、维生素或两者的混合物。介于食品和药品之间的产品统称为生物活性物质,生物活性物质与益生菌也属于功能与健康声称产品,并有专门的法规管理。三类功能与健康声称产品的属性及形态见附表。功能与健康声称产品在注册前需要基于风险分析开展安全性评估,并基于学界一致认同的科学论证(如:文献、新研究结果等)证实其有效性。经过审评后可予以注册上市。ANVISA对每个产品逐一审评。功能与健康声称应符合公共健康政策,应是真实、易懂、不产生歧义的,部分声称需提供功效的有效时间、不适宜人群等信息。
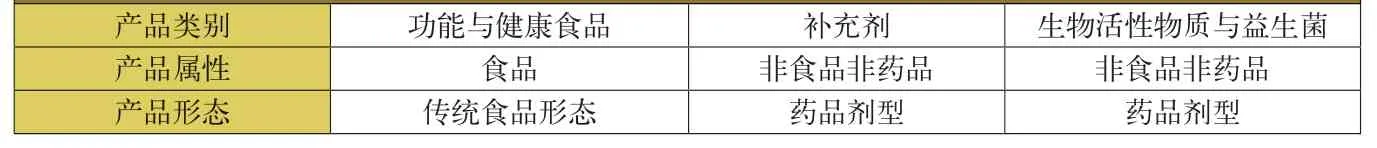
附表 三类功能与健康声称产品的属性及形态
2 功能与健康声称产品的发展历程
20世纪90年代早期,大量非食品范畴的产品向巴西卫生系统申请批准为食品。后此类产品的申请数量逐年增长,并在各种媒体上宣传。基于安全角度考虑,巴西卫生系统反对将此类产品归为食品管理。但当时大量产品已经在市场上经营销售,且以药品的形态(如片剂、胶囊)出现,自称“膳食补充剂”、“天然产物”或“植物性药材”,声称具有预防或治疗疾病的功能。其中,某些产品是由草药提取物混合制成的,这些草药提取物中含有活性很强的药用成分,如:安非他命(麻黄碱)和生物碱类,存在较大的安全风险。与此同时,以ω-3脂肪酸、植物甾醇、纤维素和低聚糖等原料制成的,声称具有健康功能的产品,也大量流入市场。
2.1 监管体系的建立 为建立功能与健康声称产品的监管体系,巴西政府、学术机构和行业代表于1998年开始,开展了长达1年的科学论证。1999年,ANVISA结合社会各界的建议,制定了“功能与健康声称产品管理办法”,将功能与健康食品和补充剂纳入其中,并给出了制定“功能与健康食品管理办法”的大致原则,即:功能与健康食品是一种可以声称功能的传统意义上的食品,而不是一种新的食品类型;功能与健康食品应有益于健康,不可与国家营养和卫生政策相悖;产品的安全性和有效性应经过科学论证;声称应是真实的,不应在读音或写法上误导消费者。
2.2 安全性与有效性的评价 为评估功能与健康声称产品的安全性和有效性,ANVISA建立了功能食品与新成分技术与科学委员会(Technical and Scientific Committee on Functional Food and Novel Ingredients),简称CTCAF。CTCAF的成员来自于高校或研究机构,其在食品科学、营养学和毒理学等领域拥有丰富的工作经验。依据需要评估产品的数量,CTCAF每1~2月开一次专家会,必要时也会邀请特定行业的专家参会。CTCAF对每个申请逐一开展安全性与有效性审评,并向ANVISA提出审批建议。同时,CTCAF也会对之前已审评过的申请开展复审。CTCAF要求产品的声称必须易于理解,并且不得明示或暗示有预防、治疗或根治疾病的作用。
在开展技术审评工作的同时,ANVISA不断改进法规,CTCAF也发表声明称已经批准的几个功能存在误读的情况。因此,在管理办法出台5年后,ANVISA决定对已批准的功能与健康食品开展复审。复审的结果是许多产品声称功能的许可被取消,还有一部分修改了功能的声称。此外,通过复审,ANVISA将经证实的具有特定功能的成分或益生菌汇总,编制了“巴西功能与健康声称许可表”,许可声称功能的产品使用相对应的原料。由于食物基质会影响功效成分的生物利用度,因此,在某些情况下使用目录中的原料时,还需提供其他资料,证明其功效性后才能声称相对应的功能。如:往橙汁中添加植物甾醇类物质时应提供人体试食研究结果,以证明植物甾醇类物质在橙汁饮料中的功效性,并应在上市后追踪调查。使用了相关的原料,是否需要声称相应的功能,可由生产商或经销商自由选择。许可表所记录的功能与对应的成分仅在一段时间内是有效的,自2007年6月起,ANVISA开展了对该表的修订与升级工作。
3 功能与健康食品的管理
1999年4月30日,卫生部下属的巴西国家卫生监督局制定了4个办法,涵盖风险评估、新资源食品或成分的注册及功能或健康声称的功效性评价。
3.1 功能与健康食品的申报 申报功能与健康食品时,生产商和经销商有义务提供所有能证明产品安全性和有效性的材料。在申报材料中,必须提供一份用葡萄牙语写的科学性报告,包含以下内容:产品或成分名称;功能或健康声称;推荐日服用量及适宜人群;原料来源、工艺说明;矿物质、植物性药材、动物性原料的种类及来源(若使用则应提供);化学结构和分子特征描述(如有则提供);产品研发预期等。此外,申报材料中还应提供产品或成分的功能学评价方法,重金属、致病菌毒素、农药和兽药残留等试验报告,可作为该产品或成分安全性的应用科学证据等。证实该产品或成分安全性的应用科学证据包含以下资料:营养学、生理学、毒理学动物试验报告,生化试验报告,流行病学研究结果,有效的临床统计研究和人体安全食用历史信息。报告还应包含:该产品或该成分在其他国家的食用情况,应当是其他国家管理部门或委员会证实其安全性后同意食用的。周刊、互联网或书籍上的文章是不能作为科学证据的,只有发表在学术期刊上的文章或论文才是有效的。每一件产品都要进行审评,所有可证实其安全性的科学证据都应该作为附件提交。英文或西班牙语的科学证据不用翻译,其他语言的一律翻译成葡萄牙语。发展至今,巴西已批准19种功效成分及对应的9项功能、10种益生菌所对应的1项功能。其他的食品也可以申报功能与健康声称,前提是该食品中含有一种成分或营养素,人食用该食品后,该成分或营养素能发挥某种功效。
此外,以药品剂型销售的不含功能声称的食品(如:脱水甜菜根),必须在标签上声明“卫生部警告:该产品无任何科学证据能证实其具有预防、治疗或治愈疾病的功能”。此外,功能与健康声称的产品或成分的广告内容应与标签上声称的内容一致。
3.2 功能声称和健康声称的范畴 从巴西法律体系中可以看出,巴西认为功能声称是指营养或非营养成分在身体生长发育、形成和维持过程中对人体组织器官所发挥的其他作用;而健康声称则是指暗示、建议或陈述食品或成分对健康的影响。功能声称和健康声称都可以涉及维持身体健康、对生理机能所起的作用、营养或非营养成分和降低得病风险。声称不得涉及预防或治疗疾病。巴西法规允许声称营养成分或非营养成分在生长、发育和维持正常身体机能方面所起的作用,对于那些功能已经被科学论证广泛接受的营养成分,无需在标签上证明或分析其有效性。而消费者对该类产品的性质产生了混淆,为更好地解释这句话,ANVISA制定了一份说明文件。ANVISA认为,在标签上声称功能的食品不应作为常规饮食的部分,也不鼓励消费者过多食用。
为取得预期效果,ANVISA于2004年在其网站上发布了名为“功能已经被科学论证并被接受的营养成分的标签制定原则”的指导文件,文件中声明了使用功能声称应遵从的条件。具体包括:声称的功能必须与该食品中自身含有的营养成分有关,该营养成分的含量至少应与相关法规明确规定的含量相等;声称的功能应详细、客观地描述;该产品不能替代符合饮食习惯的传统饮食,并且传统食品不得以胶囊剂、片剂等药品形态出现。此外,文件还规定了功能声称的产品或成分的广告内容应与标签上声称的内容一致,正确且易懂。如果满足以上4点,则无需在标签上证明或分析其有效性。需要强调的是,无论是营养成分还是非营养成分,只要与植物性药材有关或用于药品中,则一概不认为属于食品范畴。该指导文件再次强调了功能与健康声称产品必须逐个品种审批。除了证实其安全性和有效性外,还要告诉消费者,日常饮食也可以获得该品种的功效。标签所示的内容应是科学的,不可相悖于营养与健康政策。证明的范围、类型和数量因声称不同而异。一些发表在科学著作上的研究报告,可以影响一种声称能否继续存在。
4 补充剂的管理
巴西对补充剂有专门的规范进行管理。与其他国家不同,在巴西,补充剂仅指矿物质、维生素或两者的混合物。该规范将补充剂定义为“一种当无法有效地从常规饮食中摄取或需要补充维生素、矿物质时,为消费者提供维生素、矿物质的食物。”按日服用量服用的补充剂,应提供巴西推荐日摄入量的25%~100%。补充剂不能替代常规食品,也不能作为正餐单独食用。产品可以是固体、半固体、液体或粉末等形式。
补充剂仅可声称原料维生素、矿物质已证实的功能,包括:维生素矿物质对人体生长发育所起的作用等。禁止明示或暗示具有预防、治疗或根治疾病的作用,或改变生理机能的作用。标签上必须注明“孕妇、乳母与3岁以下婴幼儿请按医嘱食用”。根据这些规定,补充剂可分类为:①以单一维生素或复合维生素为原料的产品;②以单一矿物质或复合矿物质为原料的产品;③以维生素矿物质复合物为原料的产品;④以有专门质量标准和鉴别方法的天然维生素矿物质为原料的产品。
5 生物活性物质与益生菌的管理
在其他一些国家,保健药大多指那些含有除基本营养素之外有益于健康成分的食品,而在巴西的法规中没有保健药的概念。巴西用以界定食品和药品的原则之一是产品的形态,食品(包括功能与健康食品)不能以药品的剂型出现。ANVISA认为,“具有功能或健康声称的单独的生物活性物质和益生菌”类的产品应和功能与健康食品区分开来。经过长期的探讨与研究后,巴西于2002年1月制定了审批生物活性物质与益生菌的办法。
5.1 生物活性物质与益生菌的定义 生物活性物质定义为“营养成分和那些具有特定代谢或生理活性的非营养成分”。“单独的”指从来源中提取出来的提取物。这些物质被归为7类:类胡萝卜素、植物甾醇、黄酮类、磷脂、有机硫化合物、多元酚和益生菌。益生菌定义为“能够提高肠道微生物平衡从而有益于人体健康的活菌”。
5.2 生物活性物质与益生菌的管理 类似于功能与健康食品,生物活性物质与益生菌在上市前也应先注册。因为许多商家热衷于此类产品,所以必须要保证其安全性。对于绝大多数人群而言,无需通过医嘱食用此类产品应该是安全的,但特定人群除外。在日服用量不超过RDA,且不影响摄入其他成分时,可以在产品中加入维生素和矿物质。剂型可以是片剂、胶囊剂、粉剂、颗粒剂、溶液或混悬液。生物活性物质与益生菌必须提供功能或健康声称的作用方式和健康功效。益生菌类产品必须保证在标签所示的贮藏期内保证益生菌的生理性质是稳定的。
6 前景展望
巴西“功能与健康声称产品管理办法”侧重于验证产品的安全性和有效性,并随着科技发展和国家健康政策改进不断更新。
食品科学技术的发展促使巴西科学家与健康专家不断研究对人类健康有益的成分或食品。虽然已对安全性和有效性进行了广泛的研究,但研究的深度、类型和数量还有所欠缺。预计在不久的将来,基因组学和蛋白质组学将应用于证明安全性和有效性的研究中,这些新的研究可促进功能与健康声称产品的发展。此外,科学家和监管者将研究更科学的评估方法,促进功能与健康声称产品的发展。
