TGF-β1及WTp53在乳腺癌组织中的表达及其临床意义
2011-10-10杨廷桐
王 媛,王 坦,王 玉,杨廷桐
研究表明乳腺癌的发生是基因调控失衡的结果,其生物学特性与多种癌基因的作用密切相关,TGF-β1有促进肿瘤侵袭,转移,上皮间叶转化(EMT)[1],血管增生以及免疫抑制等多种作用。野生型p53(wt-p53)具有显著地肿瘤抑制作用,而突变型p53(mp-53)则具有致癌的作用。目前有关TGF-β1,wt-p53在乳腺癌的研究中极少报道。本研究运用血清学和免疫印迹技术分别检测了TGF-β1,wt-p53基因在乳腺癌组织中的表达,并探讨其临床意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 2010-03~2011-04笔者所在医院手术切除的标本,选取资料完整、病理组织学确诊的乳腺癌48例,其中淋巴结转移的31例,年龄31~62岁。并选取正常乳腺组织和癌旁组织作为对照。
1.1.2 主要试剂 兔抗人TGF-β1,p53多克隆一抗,羊抗兔辣根过氧化物酶标记的二抗,TGF-β1分子量为23 kD,wp-53分子量为53 kD,β-actin分子量为42 kD。均购自武汉博士德生物工程有限公司,显色剂购自北京中杉生物技术有限公司。ELISA检测试剂盒购自深圳晶美生物工程有限公司。
1.2 方法 受试者抽取清晨空腹外周静脉血3 ml,-4℃冰箱保存待检测。采用ELISA法分别检测TGF-β1,p53含量,严格按试剂盒说明进行操作。
1.2.1 组织中总蛋白提取及电泳 将液氮低温保存的乳腺组织,腺癌及癌旁组织剪碎后各取100 mg,分别加入500 μl蛋白裂解液,4℃,15 000 r/min 匀浆后,2000 r/离心 15 min,上清移入另一管中,20 000 r/离心15 min,弃上清,取沉淀重新悬浮于200 μl匀浆缓冲液中,加蛋白提取液,充分混匀,沸水加热变性10 min,应用蛋白分析试剂测定蛋白浓度。向加样槽中加入各个样品及蛋白标志物各25 μl,电压75 V,电泳30 min。电泳完毕后取出凝胶,用电转膜仪将蛋白质转移至硝酸纤维素膜,加封闭液封闭,室温加第一抗体,二抗,显色。
1.2.2 半定量结果分析 利用天能图像分析系统对显色结果拍照,记录电泳条带净光密度和强度值,以目的基因与内参比值确定其含量计算其表达的相对丰度。
2 结 果
2.1 血液中TGF-β1,p53在正常人和乳腺癌患者中的含量比较 见表1。
表1 不同人血液中 TGF-β1,wt-p53 含量(±s,μg/L)

表1 不同人血液中 TGF-β1,wt-p53 含量(±s,μg/L)
正常人与乳腺癌患者相比,P<0.01
组别 n TGF-β1 wt-p53正常人 15 6.46±0.31 6.84±0.24乳腺癌患者 48 12.58±0.22 3.23±0.11Ⅰ~Ⅱ期 31 11.17±0.25 3.81±0.34Ⅲ~Ⅳ期 17 13.36±0.31 2.43±0.27
2.2 免疫印迹结果 TGF-β1在相对分子量23 kD处;wtp53在相对分子量53 kD处;β-actin在相对分子量 42 kD处;分别出现特异性条带(图1)。电泳条带光密度值计算:目的基因/β-actin.正常腺体,炎症和癌旁组织的 TGF-β1、wtp53表达无显著性差异 (P>0105);乳腺癌组织中TGF-β1、wt-p53表达与正常乳腺组织和癌旁组织相比有显著性差异(P<0.01);已有淋巴结转移者 TGF-β1、p53 表达与无淋巴结转移者相比有显著差异(P<0.01)。见图1,表2。
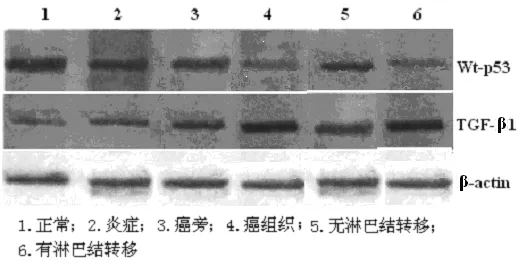
图1 Western免疫印迹TGF-β1,p53表达
3 讨 论
TGF-β1具有肿瘤抑制基因和癌基因的双重角色,在信号转导通路中的异常与肿瘤的发生、肿瘤细胞的浸润及转移密切相关[2],TGF-β1在肿瘤的发生过程中激活上皮细胞周围基质,形成肿瘤相关基质,对具有促癌作用的基质环境的形成起着关键作用,并诱导促进上皮细胞向间叶转化,使上皮细胞更具有活动能力,在细胞基质间自由移动极富有侵袭性[3]。近年国外研究显示在胃癌,结直肠癌等肿瘤中发挥重要作用[4]。
表2 不同组织中TGF-β1、wt-p53蛋白产物光密度比值(±s)
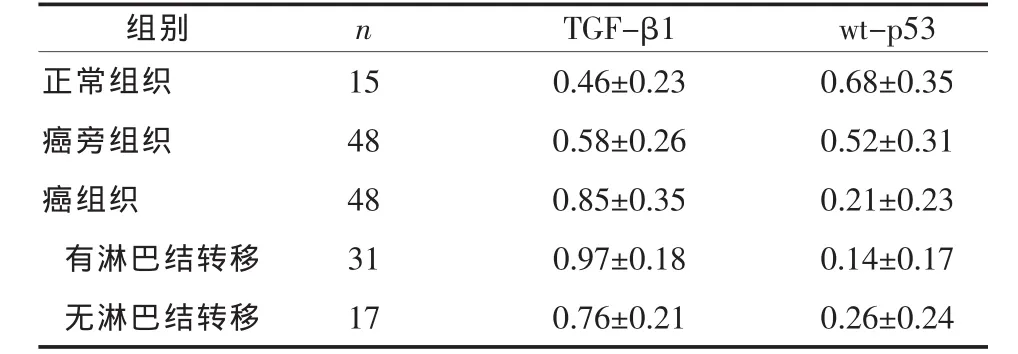
表2 不同组织中TGF-β1、wt-p53蛋白产物光密度比值(±s)
正常与癌旁比较P>0.05;正常与癌组织和有淋巴结转移相比P<0.01;有无淋巴结转移相比P<0.01
?
本实验发现无论是在血清中还是在组织中TGF-β1的含量乳腺癌患者和乳腺癌组织中均比正常人和正常乳腺组织显著增高,而且有淋巴结转移者表达更高,推测TGF-β1的高表达与乳腺癌的发展相关,与乳腺癌更具有侵袭能力的生物学行为相关。TGF-β1可诱导促进乳腺癌细胞向间叶细胞转化(EMT),增强了乳腺癌细胞的运动能力侵袭能力[5]。肿瘤侵袭转移是多基因参与多步骤完成的复杂病理过程,但肿瘤细胞粘附能力减弱和运动能力增强是其转移的首要条件和基础。Yao等[6]在对卵巢癌细胞系的研究中发现TGF-β1参与卵巢癌细胞的上皮-纤维原细胞-成纤维细胞的转变过程中 使其逐渐获得了迁移特性。
p53基因(Wt-p53)定位于17q13.1上,编码由393个氨基酸残基组成的蛋白质p53蛋白,是一种抑癌基因,细胞凋亡过程被认为有赖于Wt-p53基因的存在[7]。Wt-p53则通过调节bcl-2,Caspase,Bax等基因表达,启动细胞凋亡控制程序,在50%的肿瘤细胞中存在p53突变,是基因改变频率最高的目标基因。Wt-p53基因发生突变时可产生突变型p53蛋白 (mt-p53),mt-p53可抑制Wt-p53活性或使之失活,而且p53突变体失去了诱导凋亡的功能从而引起细胞的转化和癌变[8]。mt-p53起着原癌基因的作用稳定存在并在肿瘤细胞核内积累而引起细胞恶性增殖[9],抑制细胞凋亡并促进细胞恶性转化。在肺癌卵巢癌等组织中p53以突变型为主,子宫颈癌组中以Wt-p53为主,且表达显著降低。Wt-p53半衰期短易失活,因此p53失活快是增加患子宫颈癌风险的原因之一[10]。在本实验中Wt-p53的表达随着乳腺癌的发展与转移在血液和组织中越来越低。因此Wt-p53得缺失可能是乳腺癌生物学行为演变的一种发生机制,Wt-p53的缺失与乳腺癌进展相关。这一结论与Qian等在对前列腺癌的研究中所得的结论相符[11]。
本研究从血清学和免疫印迹的角度探讨了TGF-β1,Wt-p53与乳腺癌发展转移的关系。证明了TGF-β1升高和Wt-p53降低是乳腺癌发生,侵袭转移的危险信号,可作为乳腺癌生物学行为和预后判断的潜在指标。也可成为乳腺癌复发的血清学指标。以后注重在乳腺癌中TGF-β1调控机制和通路方面的研究。
[1]周庚寅,蔡永萍.上皮间叶转化的研究进展[J].郑州大学学报(医学版),2010,45(3):353-356.
[2]Bac Ds,Blazanin N,Licata M,et al.Tumor suppresson and oncogene actions of TGFbeta1 occurearly in skin carcinogencs and arc mediated by Smad3[J].Mol Carcinog,2009,48(5):441-453.
[3]Wang KS,Hu ZL,Li JH,et al.Enhancementofme-Tastatic and invasivecapacity of gastriccancer cells by Transforming growth factor-beta1[J].Acta Biochim Biophys Sin,2006,38(3):179-186.
[4]Coban S,Yksel O,Kokar MC,et al.Thesignifi-cance of serumtrans forming growth factor betaindetecting of gastrican dcoloncancers[J].Hepatogastrol enterology,2007,54(77):14722-1476.
[5]Haase VH.Oxygen regulates epithelial-to-mesenchymal transition:insights into molecular mechanisms and relevance to disease[J].J Kidney Int,2009,76(5):492-9.
[6]Yao Q,Qu X,Yang Q,et al.CLIC4 mediates TGF-beta1-induced fibroblast-to-myofibroblast transdifferentiation in ovarian cancer[J].Oncol Rep,2009,22(3):541-548.
[7]Nayak SK,Pancsar PS,Kumar H.p53-induced apoptosis and inhibitors of p53[J].Curr Med Chem,2009,16(21):2627-2640.
[8]Adhikari AS,Iwakuma T.Mutant p53 Gain of on cogenic function in vivo evidence mechanism of action and clinical implications[J].Fukuoka Igaku Zasshi,2009,100(6):217-228.
[9]Karim S,Ali A.Correlation of p53 over-expression and alteration in p53 gene detected by polymerase chain reaction-single strand conformation polymorphism in adenocarcinoma of gastric cancer patients from India[J].World J Gastroenterol,2009,15(11):1381-1387.
[10]Crinelli R,Bianchi M,Menotta M,et al.Ubiquitin over-expression promotes E6AP autodegradation and reactivation of the p53/MDM2 pathway in HeLa cells[J].Mol Cell Biochem,2008,318:129-145.
[11]Qian I,Hinrasawa K,Bostwick DG,et al.Loss of p53 and cmyc overrcpicsentation in stage T(2-3)N(1-3)M(O)prostate cancer ate potential markers for cancer progression[J].Mod Pathol,2002,15(1):35-44.
