环介导等温扩增技术快速检测食品中变形杆菌的研究
2011-10-09张胜凯马晓燕张先舟钱翔宇王小丽王润鑫
张胜凯,马晓燕,张先舟,王 羽,钱翔宇,王小丽,王润鑫,张 伟
(河北农业大学食品科技学院,河北保定071001)
环介导等温扩增技术快速检测食品中变形杆菌的研究
张胜凯,马晓燕,张先舟,王 羽,钱翔宇,王小丽,王润鑫,张 伟*
(河北农业大学食品科技学院,河北保定071001)
采用环介导等温扩增(LAMP)技术,快速检测食品中的变形杆菌。以变形杆菌(CMCC49027)的atpD基因作为靶序列,设计内、外引物,通过肉眼观察白色沉淀,判断检测结果。共对11株致病菌进行特异性实验。结果表明,变形杆菌为阳性,其他10株菌为阴性。采用FTA滤膜制备模板进行LAMP反应,其方法的灵敏度为6.4×102CFU/mL。利用LAMP技术直接检测人工污染的肉制品中的变形杆菌,其检出限为3.6×103CFU/g。本实验所建立的快速检测变形杆菌的LAMP检测方法具有较高的特异性和敏感性,能够满足变形杆菌快速检测的需要。
LAMP,环介导等温扩增,快速检测,变形杆菌
变形杆菌是一种食源性条件致病菌,容易污染肉类、动物内脏和蛋类等动物性食品以及凉拌菜、剩饭菜和豆制品[1],可引起急性胃肠炎或发生组胺中毒,导致机体抵抗力下降,进而导致脑膜炎、腹膜炎、败血症、尿路感染、呼吸道感染、风湿关节炎等疾病[2-3]。近年来有关变形杆菌引起食物中毒的事件逐渐增多。从1996年至今,已有200多篇关于变形杆菌引起食物中毒的报道[4]。食物中变形杆菌的检测方法,主要有基于生化特征进行鉴定的传统分离培养法[5]、尿素酶试纸法[6]、全自动微生物分析系统检测法[7]和基于分子生物学的PCR法 。传统分离培养法是目前国内外检测变形杆菌属的标准方法,但操作繁琐、费时费力,分离鉴定到属至少需要48~72h。尿素酶试纸法操作简便、快速,能够在几分钟内鉴别变形杆菌属,且成本低廉,但准确性、可靠性较差。全自动微生物分析系统检测法继承了前两种方法的优点,但仪器价格昂贵、成本高,一般单位难以承受。PCR法检测准确、快速、敏感,但需要昂贵的PCR仪不利于在基层实验室推广应用。因此需要发展一种快速简便的检测方法来实现对变形杆菌进行检测。环介导等温扩增(Loop-mediated isothermal amplification,LAMP)是 Notomi等在 2000年开发的一种新颖的恒温核酸扩增方法,其原理是针对目的基因的6个区域设计4条特异引物,利用一种链置换DNA聚合酶(Bst DNA polymerase)在等温65℃左右,几十分钟,即可实现核酸的高效扩增[8-9]。4条引物对靶序列的6个特异序列区域的识别,保证了LAMP扩增的高度特异性。LAMP不需要模板的热变性[10],长时间温度循环,在等温条件下扩增,不会因改变温度而造成时间的浪费。有无肉眼可见的焦磷酸镁的白色沉淀[11-12],成为判断核酸是否扩增的最简单的方法。LAMP将成为可以替代PCR的核酸扩增的新技术。

表1 引物序列与目的扩增产物大小
1 材料与方法
1.1 材料与仪器
BstDNA聚合酶、Taq DNA聚合酶、dNTP、10×Loading buffer、DNA Marker DL100、DL2000,LAMP 引物等 购自或合成于上海生工生物工程有限公司;营养肉汤培养基、营养琼脂培养基等 购自北京路桥公司;肉及肉制品 购自当地超市;变形杆菌、腊样芽孢杆菌、金黄色葡萄球菌、弗氏弧菌、小肠结肠耶尔森氏菌、大肠杆菌O157:H7、副溶血弧菌、鲍氏志贺氏菌、肠炎沙门氏菌、单核增生李斯特氏菌及宋内志贺氏菌 购自中国医学细菌保藏中心。
电热恒温水浴锅、高速冷冻离心机SIGMA3K30
德国西格马公司;PCR扩增仪 Whatman T Gradient基因扩增仪,德国Biometra公司;恒温培养箱、凝胶成像系统KodakEDAS290 美国柯达公司;电泳仪DXY-33A型 北京市六一厂;微量移液器0.1~1 000L,lBIOHIT芬兰;FTA滤膜 购自Whatman公司,使用时用Harris打孔器打成直径2.00mm的圆片。
1.2 实验方法
1.2.1 纯菌培养 变形杆菌接种于新鲜无菌的营养肉汤培养基中,37℃培养12h。用生理盐水将菌悬液按照100~108倍稀释。采用稀释平板法,测定其纯培养物活菌数为6.4×108CFU/mL;同时从每个稀释度菌液中取1mL直接用FTA滤膜法提取变形杆菌基因组DNA,作为模板,进行LAMP实验。
1.2.2 人工污染肉及肉制品 在人工污染变形杆菌前,样品均按国标法检测证实不含有变形杆菌。然后将变形杆菌人工污染到样品中:取25g样品加入225mL生理盐水匀浆,然后对匀浆液人工污染不同浓度的变形杆菌,人工污染的匀浆液中变形杆菌的浓度依次为100~108CFU/mL,直接提取人工污染的肉及肉制品中变形杆菌的DNA。人工污染样品中变形杆菌 DNA的提取:取10mL的样品匀浆以1000r/min离心10min,然后吸取上清液加入另一个灭菌的离心管中以14000r/min离心10min。弃上清,沉淀用500μL的生理盐水悬浮,加入0.25倍体积的乙酸乙酯,振荡混匀2min,然后以14000r/min离心10min。弃去上清,沉淀用500μL的TE缓冲液溶解。再用FTA滤膜法提取溶液中变形杆菌基因组DNA,直接进行LAMP检测,确定检出限。
1.2.3 模板DNA的制备 本研究采用FTA滤膜法[13]进行DNA的提取:取1mL过夜培养的菌悬液加到离
心管中,加入直径为2.00mm的FTA滤膜片,56℃干燥。干燥后的FTA滤膜片用FTA缓冲液洗涤两次,再用TE缓冲液洗涤两次,最后再将FTA滤膜置于56℃干燥,干燥后的FTA滤膜即可作为反应的模板。
1.2.4 引物设计 为了检测变形杆菌,针对变形杆菌(CMCC49027)GenBank中atpD基因,运用引物设计 软 件 (https://primerexplorer.jp/lamp3.0.0/index.html)在线进行LAMP引物设计。引物设计的原则如 notomietal[8]所述。设计的4条引物是:两条外引物(F3和B3),两条内引物(FIP和 BIP)。扩增基因组中的位置从146至337区域191bp目的基因片断。引物的名称和具体序列见表1。FIP由F1的一个互补序列和正向序列F2构成。BIP由B1的一个互补序列和正向序列B2构成。每条引物在基因组中具体的位置如图1所示。

图1 每条引物在基因组中的位置
1.2.5 LAMP反应 25μL的反应体系由内引物(FIP和 BIP)各 1.6μm,外引物(F3 和 B3)各 0.2μm,1.4mmol/L dNTP,2mmol/L MgSO4,10 × Bst DNA 聚合酶反应缓冲液(New England Biolabs,MA)(20mmol/L Tris - HCl(pH8.8),10mmol/L KCl,10mmol/L(NH4)2SO4,2mmol/L MgSO4,0.1%Triton X-100),8U的Bst DNA聚合酶大片段(New England Biolabs,Beverly,MA),1.5μLDNA 模板和用灭菌双蒸水补足体系。LAMP反应过程是首先在64℃水浴锅中反应20min,然后将其放入80℃水浴锅中,水浴10min终止反应,通过肉眼观察有无白色焦磷酸镁沉淀。此外,取扩增产物5μL与1μL的lodding buffer混合均匀,进行1.5%琼脂糖凝胶电泳,观察梯形条带,以证实是否发生了LAMP反应。
2 结果与分析
2.1 LAMP反应的肉眼可视结果
反应结果如图2所示,A管未发生LAMP反应,没有产生白色沉淀;而B管发生了LAMP反应,产生了白色沉淀。
2.2 LAMP用于纯培养变形杆菌的检测实验
2.2.1 LAMP检测敏感性实验结果 过夜培养的变形杆菌的菌悬液,经计数可知,起始菌液的浓度为
6.4 ×1 08CFU/mL,10倍梯度稀释菌液,进行LAMP检测变形杆菌的灵敏度实验如图3所示。LAMP方法,在稀释到106倍(6.4×102)时出现梯形条带。而稀释到107倍(6.4×101)时未出现梯形条带。即检测变形杆菌的灵敏度达到6.4×102CFU/mL,相应的琼脂糖凝胶电泳图如图3所示。

图2 LAMP反应的可视结果

图3 LAMP检测变形杆菌的灵敏度
2.2.2 LAMP检测特异性实验结果 利用LAMP对1株变形杆菌和11株其它致病菌进行特异性检测,扩增产物在2%的琼脂糖凝胶上进行电泳,其琼脂糖凝胶电泳图如图4所示。由图4可知,进行LAMP扩增,只有变形杆菌扩增出特异性片段,而其它10株致病菌的扩增结果均显示为阴性。可见该方法具有较好的特异性。
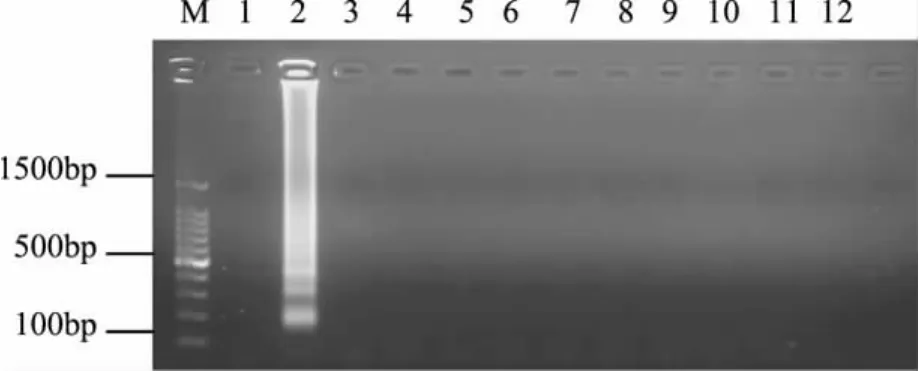
图4 LAMP反应的特异性实验结果
2.3 LAMP检测人工污染样品检出限的实验结果
经细菌计数可知,过夜培养的变形杆菌的菌悬液浓度为3.6×108CFU/mL,即人工污染样品中变形杆菌的原始浓度为3.6×108CFU/g。按1.2.2方法处理样品提取DNA,进行LAMP检测人工污染样品中的变形杆菌的检出限实验结果如图5所示。采用LAMP方法,在稀释到105倍(3.6×103)时能出现梯形条带;稀释到106倍(3.6×102)时不能检测到变形杆菌,电泳无梯形条带,即检测人工污染样品中的变形杆菌的检出限是3.6×103CFU/g,其琼脂糖凝胶电泳图如图5所示。

图5 LAMP检测样品中变形杆菌检出限
3 讨论
变形杆菌是引起泌尿系统感染的常见致病菌,是从局部或全身感染中分离的肠杆菌科常见细菌,1991年伦敦皇家医院和最近法国医院调查中,肠杆菌科中变形杆菌的感染率分别为15%和8.3%,成为肠杆菌科中继大肠杆菌之后(64.4%)位居第二位的致病菌[14]。目前,我国有关标准中只有卫生部发布的变形杆菌引发食物中毒诊断的行业标准《WS/T9-1996变形杆菌食物中毒诊断标准及处理原则》,缺少相应的预防监测标准和检测方法。由于变形杆菌为条件致病菌,国家标准《食品卫生检验方法微生物学部分》GB/T4789系列标准中未规定该菌的标准检验方法,在食品卫生日常监督检测中,该菌成为盲点,评价也没有依据,导致食物中毒事件屡屡发生。由于被变形杆菌污染的食品无任何感官上的变化,所以极易引起食物中毒,我国每年由于变形杆菌引起的食物中毒事件很多。
本研究以变形杆菌的atpD基因作为靶序列,采用LAMP方法,检测肉及肉制品中的变形杆菌,表现出较高的灵敏度。本研究探索了一种更为稳定、快捷的分子检测样品中变形杆菌的新技术。
LAMP方法是一种新型的恒温核酸扩增技术。它依赖于能够识别靶DNA上6个特定区域的4条引物和一种具有链置换活性的DNA聚合酶,在恒温条件下扩增核酸,保证了扩增的高特异性和高效率。另外,核酸大量生成时,从dNTPs中析出的焦磷酸根离子与反应体系中的Mg2+结合,产生肉眼可见的扩增反应副产物—白色焦磷酸镁沉淀。结果鉴定简单,非常适用于高通量的快速检测。
从研究结果中我们可以看到,LAMP技术能快速检测肉及肉制品中的变形杆菌,该方法灵敏度高、特异性好、耗时短、费用低,能够弥补传统分离培养法和全自动微生物分析系统检测法的缺陷,为食品中变形杆菌的快速检测构建了一个技术平台。并且这种方法所使用的技术简单,操作快捷,结果容易判断,也不需要任何类似PCR的昂贵设备,因而具有极大的应用价值,有望取代PCR而成为核酸扩增检测食品中病源微生物的主要手段。
[1]张文冶.新编食品微生物学[M].北京:中国轻工业出版社,1995:271-272.
[2]Zunino P,Sosa v,Allen A G,et al.Proteus mirabilis fimbriae(PMF)are important for both bladder and kidney colonization in mice [J].Mircrobiology,2003,149(11):3231-3237.
[3]Rashid T,Ebringer A.Rhenmatoid arthritis is linked to Proteus-the evidence[J].Clininal Rhenmatology,2007,26(7):1036-1043.
[4]刘秀梅.食源性疾病监控技术的研究[J].中国食品卫生杂志,2004(1):3-9.
[5]朱丽萍,何新元.食物中毒病原菌奇异变形杆菌的分离和鉴定[J].中国卫生检验杂志,2000,10(2):2221.
[6]张金枝.尿素酶快速试纸法用于变形杆菌的鉴别[J].洛阳医专学报,1999,17(4):271-272.
[7]黄愈玲,刘俊华,李秀珍.全自动细菌分析仪系统在检测引起食物中毒病原菌的应用[J].中国卫生检验杂志,2002,12(5):554-5551.
[8]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):E63-e63.
[9]Eiken Chemical Co Ltd.The principles of LAMP method.http://loopamp.eiken.co.ip/e/tech/index.html.
[10]Nagamine K,Watanabe K,Ohtsuka K,et al.Loop-mediated isothermal amplification reaction using a no denatured template[J].Clinical Chemistry,2001,47(9):1742-1743.
[11]YasuyoshiMori,TsuyoshiHirano,TsugunoriNotomi.Sequence specific visual detection of LAMP reactions by addition of cationic polymers[J].BMC Biotechnology,2006,6(3).
[12]Mori Y,Nag amine K,Tomita,et al.Detection of loopmediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochemical and Biophysical Research Communications,2001,289(1):150-154.
[13]Dana D P,Grace J,Ruth N.Rapid method for screening died blood samples on filter paper for Human Immunodeficiency Virus Type DNA[J].Journal of Clinical Microbiology,1999,37(2):350-353.
[14]Nicolas - chained,M H H Chardon L Avril,et al.Susceptibility of Enterobacteriaceae to betalactams and fluoroquinolones:Afrench multicenter study[J].Clin Infect,1997,3(supply2):74-75.
Rapid detection of Proteus.vulgaris in food samples by loop-mediated isothermal amplification
ZHANG Sheng-kai,MA Xiao-yan,ZHANG Xian-zhou,WANG Yu,
QIAN Xiang-yu,WANG Xiao-li,WANG Run-xin,ZHANG Wei*(Institute of Food Science and Technology,Agricultural University of Hebei,Baoding 071001,China)
A loop-mediated isothermal amplification(LAMP)technology rapidly detected Proteus.vulgaris in food samples.The sequences of atpD of Proteus.vulgaris(CMCC49027)was as target sequences,used to design outer primers and inner primers.The results of detection were judged through visible to the naked eye of the white precipitate.There were 11 bacterial amplified by LAMP method in order to evaluate the specificity of primers.The result of only Proteus was positive and those of other strains were negative.The sensitivities of LAMP assays using the FTA filters as templates were 6.4×102CFU/mL.The detection limits of LAMP assays obtained from artificially inoculated meet samples were 3.6×103CFU/g.The results showed that the LAMP method developed in this experiment with high specificity and sensitivity,the developed LAMP method can meet the demands of rapid and simple detection of Proteus.vulgaris.
LAMP;Loop-mediated isothermal amplification;rapid detection;Proteus.vulgaris
TS207.4
A
1002-0306(2011)06-0384-04
2011-02-22 *通讯联系人
张胜凯(1982-),男,在读硕士,从事有害微生物检测及控制的研究。
河北省自然科学基金(C2008000216)。
