鱼鳞胶原蛋白提取过程中的脱钙工艺条件优化
2011-10-09何建林徐长安宋晓红欧徽龙张怡评易瑞灶
唐 旭,何建林,徐长安,宋晓红,欧徽龙,张怡评,易瑞灶
(1.国家海洋局第三海洋研究所,福建厦门361005;2.厦门大学海洋系,福建厦门361005)
鱼鳞胶原蛋白提取过程中的脱钙工艺条件优化
唐 旭1,何建林1,徐长安1,宋晓红2,欧徽龙2,张怡评1,易瑞灶1
(1.国家海洋局第三海洋研究所,福建厦门361005;2.厦门大学海洋系,福建厦门361005)
研究了海鱼鱼鳞胶原蛋白提取过程中的脱钙工艺条件优化。采用L9(34)正交实验,考察了酸浓度、温度、时间等因素对鱼鳞脱钙工艺的影响,并使用离子色谱法考察了各种工艺条件对鱼鳞胶原蛋白在脱钙过程中溶出的影响。确定了鱼鳞胶原蛋白提取过程中的脱钙优化工艺,即温度18℃,酸浓度0.7mol/L,时间24h。放大实验至原料2kg规模,得脱钙率为99.4%,适合规模化生产。
鱼鳞,胶原蛋白,脱钙工艺,优化
胶原蛋白是一种白色、不透明、无支链的三螺旋纤维蛋白质,它主要存在于动物的皮、骨、软骨、牙齿、肌键、韧带和血管中,是结缔组织极其重要的结构蛋白质,起着支撑器官、保护机体的作用。胶原蛋白是哺乳动物体内含量最多的蛋白质,占体内蛋白质总量的25%~30%[1]。其提取制品已广泛应用于医药、保健、食品加工、化妆品等众多领域[2-4]。由于近年来生态环境受到严重污染,陆生哺乳动物疫病爆发,尤其是疯牛病、口蹄疫等疾病流行,使得源自于牛、猪等动物皮、骨中提取的胶原蛋白的安全性受到质疑与限制,世界各国都在开发更安全的鱼鳞胶原蛋白,来满足人们对其安全、生态与健康的需求[5]。
鱼鳞是鱼皮真皮层的变形物,占鱼体重量的1%~5%。有关研究表明,鱼鳞含丰富的蛋白质、卵鳞脂和多种矿物质,其中有机物占 41%~55%[6],而蛋白质占70%,主要为胶原蛋白和角蛋白等硬蛋白。除了含有丰富的胶原蛋白,鱼鳞中还含有大量的无机钙盐,主要以羟基磷灰石形式存在,黏附在胶原纤维的表面[7]。由于含有羟基磷灰石,使得直接提取鱼鳞胶原蛋白产率低、生产周期长[8-9]。因此,鱼鳞胶原蛋白的提取,一般需要先将钙质脱除,以便于胶原蛋白脱离羟基磷灰石的束缚而溶出,易于提取。而且,钙含量越低,所提取的胶原蛋白质量越好[10]。通常,选择作为脱钙试剂的有盐酸[10-14]、EDTA[13-16]、柠檬酸[5,17]。本工作拟通过综合考虑成本、操作等因素,选择盐酸作为鱼鳞脱钙试剂,设计进行正交实验,优化鱼鳞胶原蛋白提取过程中的脱钙工艺条件,并进行了放大实验。
1 材料与方法
1.1 材料与仪器
美国红鱼鱼鳞 购自福建漳州东山,经洗涤、脱脂、干燥备用;其他化学试剂 均为分析纯,汕头西陇化工厂有限公司。
电子天平 METTLER TOLEDO AL104型;离子色谱 美国Dionex ICS-3000型离子色谱;色谱柱氨基酸分析柱 (DIONEX Am inopac PA-10 2×250mm);马弗炉 日本Yamato,FM-36;DHG-9240A型烘箱、DEF-6050型真空干燥箱 上海恒一科学仪器公司;坩埚,酸式滴定管。
1.2 实验方法
1.2.1 离子色谱条件 流动相:250mmol/L氢氧化钠-1mol/L醋酸钠-水,梯度洗脱;柱温:30℃;流速:0.25m L/m in;进样量:25μL。
1.2.2 脱钙方法 取脱脂后洗涤干燥备用的鱼鳞50g置于1000m L烧杯中,按料液比1∶10加入500m L水;加入盐酸溶液,达到实验浓度,在不同实验温度下搅拌;反应结束后,脱钙液取样待测,鱼鳞用清水洗涤10次,晾干;再置于27℃下真空干燥24h,称重待测。
1.2.3 正交实验 在鱼鳞脱钙工艺中,有诸多影响因素。根据文献报道[10-13]以及本实验室初步实验结果,最终选定温度、酸浓度和时间为主要影响因子,通过L9(34)正交实验,确定最佳鱼鳞脱钙工艺条件。具体影响因子及实验水平见表1。鱼鳞的量为50g,料液比为 1∶10。

表1 正交实验因素水平表
1.2.4 钙滴定实验(高锰酸钾法[18])
1.2.4.1 高锰酸钾滴定液的配制[19]称取高锰酸钾约3.2g,加水 1000m L,煮沸 15m in,冷却,密封,静置2d,G3砂芯漏斗过滤,摇匀。
1.2.4.2 标定[19]根据《中华人民共和国药典》(2005年版 二部)方法进行标定。依此法测得KMnO4滴定液的浓度为0.02188mol/L。
1.2.4.3 鱼鳞钙离子滴定 称取脱脂前与脱脂后的鱼鳞,置于马弗炉550℃灰化5h,加入1∶4盐酸溶液5m L,水浴蒸干。再加入1∶4盐酸溶液溶解并移入25m L容量瓶中。去离子水多次洗涤坩埚,洗涤液合并移入容量瓶,冷却后用去离子水定容。
准确吸取样液1m L移入15m L离心管中,加入甲基红指示剂1滴。4%草酸铵溶液2m L,1∶4醋酸溶液0.5m L,摇匀,用1∶4氨水溶液调节样液至微蓝,再用醋酸调至微红,放置1h后离心15min,倾去上清液,倾斜离心管并用滤纸吸干管口残留溶液,向离心管中加入2%氨水溶液10m L,离心20m in,吸去上清液。往沉淀中加入2mol/L硫酸溶液5m L,摇匀。70~80℃水浴,使沉淀完全溶解。高锰酸钾滴定液滴至微红,30s不褪色为终点。
1.2.4.4 钙含量与脱钙率计算 计算公式如下:
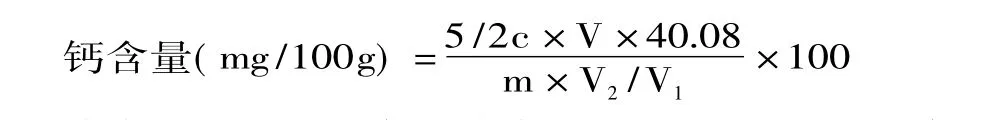
式中:c-KMnO4溶液浓度,mol/L;V-KMnO4溶液耗用体积,m L;V1-用于测定的样液体积,m L;V2-样液定容总体积,m L;m-样品质量,g;40.08-钙的摩尔质量,g/mol。

1.2.5 脱钙液羟脯氨酸含量测定 为考察脱钙条件是否会使鱼鳞胶原蛋白溶出,使用离子色谱法[20]检测脱钙液中羟脯氨酸的含量。取离心后的鱼鳞脱钙液1m L,加入6mol/L盐酸9m L,置于110℃烘箱中水解12h,稀释200倍后,使用离子色谱法检测。
2 结果与讨论
2.1 正交实验
根据鱼鳞胶原蛋白变性温度的测试可知,鱼鳞胶原蛋白的变性温度在28℃左右[10]。为了减少蛋白变性的可能,一般不选择超过20℃的条件[21]。因此选取4、10、18℃三种温度,考察不同温度状态对鱼鳞脱钙反应的影响。
脱钙工艺通常使用酸溶液进行反应,但如果酸过强,将会造成鱼鳞胶原蛋白溶出以及对其造成破坏[22],本文采用稀盐酸溶液作为脱钙试剂,综合文献报道[10-13]以及实验室前期工作,选择 0.4、0.8、1.2mol/L三种盐酸浓度,考察使用不同酸浓度对鱼鳞脱钙反应的影响。
根据文献报道[10-13],设计了 8、12、24h 三种脱钙反应时间,考察时间对脱钙反应的影响。
按脱钙实验影响因素和水平的设计进行正交实验,结果见表2。

表2 脱钙正交实验结果
由表2中的结果可以看出,极差最大的因素是酸浓度,温度和时间因素的影响相同,这可能是因为经脱钙后的鱼鳞中钙离子含量很低,在检测方法的检测限以下。酸浓度对鱼鳞脱钙影响最大,由于上述原因造成的误差,使得0.8mol/L和1.2mol/L的均值一样,说明这两种浓度的脱钙影响效果无差别,考虑到成本的因素,选择0.8mol/L作为脱钙液的酸浓度。直观分析表明,最优组合为 A3B2C3,即温度18℃,酸浓度0.8mol/L,时间24h。
为了使结果更为优化,随后又进行了0.5~0.8mol/L浓度更为细化的对比实验,见表3。

表3 0.5~0.8mol/L不同浓度脱钙率的比较实验
从表3中的结果可以看出,0.8mol/L浓度对应的脱钙率高于0.5mol/L时的脱钙率,与表2中正交实验结果一致。随着浓度从0.5mol/L增加到0.8mol/L,脱钙率也随之增加。0.7mol/L时的脱钙率与0.8mol/L时的相比,相差无几。从成本的因素考虑,最终确定脱钙工艺条件为盐酸浓度0.7mol/L,温度18℃,时间24h。
2.2 离子色谱法检测
为考察不同条件对鱼鳞脱钙过程中胶原蛋白溶出的影响,使用离子色谱法对6mol/L盐酸水解后的脱钙液进行检测,均未发现明显的羟脯氨酸离子峰,说明鱼鳞在表2以及表3中的实验条件下脱钙,均不会造成胶原蛋白的溶出。
2.3 规模放大实验
根据表2、表3实验结果所确立的条件,将鱼鳞脱钙工艺规模放大至原料2kg,总体积20L,经最终钙含量滴定以及离子色谱检测实验得知,在该优化条件下所得的脱钙率为99.4%,脱钙液中未检测到明显的羟脯氨酸,即未造成胶原蛋白的溶出。
3 结论
鱼鳞中除了含有丰富的胶原蛋白,还含有大量的无机盐,主要以钙盐形式存在,为提高鱼鳞胶原蛋白的提取率以及质量,一般需要先将钙质脱除。经过正交实验得出优化的脱钙工艺条件:温度18℃,酸浓度0.7mol/L,脱脂时间24h。放大实验所得结果也说明,该脱钙条件优良,适合规模化生产。
[1]蒋挺大,张春平.胶原蛋白[M].北京:化学工业出版社,2001:125.
[2]刘学旭,王坤余,丁运萍,等.胶原-葡甘聚糖-硫酸软骨素复合膜对全层皮肤损伤修复的实验研究[J].生物医学工程学杂志,2005,22(5):1004-1006.
[3]唐传核,彭志英.胶原的开发及利用[J].肉类研究,2000(3):41-43.
[4]王学川,任龙芳,强涛涛,等.胶原蛋白的研究进展及其在化妆品中的应用[J].日用化学工业,2005,35(6):388-391.
[5]王信苏,汪之和.草鱼鱼鳞胶原蛋白的提取[J].现代食品科技,2006,22(4):148-150.
[6]张俊杰,曾庆孝.鱼鳞的开发利用前景[J].中国水产,2004(5):74-75.
[7]Toshiyuki Ikoma,Hisstoshi Kobayashi,Junzo Tanaka,et al.Microstructure,mechanical,and biomimetic properties of fish scales from Pafrusmajor [J].Journal of Structural Biology,2003,142:327-333.
[8]刘小铃,许时婴.鸡骨明胶生产中浸酸工艺的控制[J].食品工业科技,2004,25(8):109-111.
[9]王彩理.鱼鳞制胶及其综合利用[J].齐鲁渔业,2002,19(3):40-41.
[10]张俊杰,曾庆孝.鱼鳞盐酸脱钙过程中胶原蛋白含量的变化[J].食品与发酵工业,2004,30(4):40-43.
[11]SSankar,S Sekar,R Mohan,et al.Preparation and partial characterization of collagen sheet form fish(Lates calcarifer)scales[J].International Journal of Biological Macromolecules,2008,42:6-9.
[12]刘庆慧,王彩理,刘丛力.鱼鳞胶原蛋白研究[J].海洋水产研究,2000,21(3):57-61.
[13]Takeshi Nagai,Masami Izumi,Masahide Ishii.Fish Scale collagen.Preparation and partial Characterization[J].International Journal of Food Science and Technology,2004,39:239-244.
[14]张俊杰,段蕊,陈璐.鲤鱼鳞酸溶性胶原蛋白提取的研究[J].水产科学,2006,25(12):640-643.
[15]王吰,刘剑虹,李可伟.胃蛋白酶法提取草鱼鳞胶原蛋白的工艺研究[J].食品研究与开发,2007,28(4):134-136.
[16]张颖洁,曾庆孝,叶凤鳞,等.EDTA微波快速脱钙法在鱼鳞脱钙中的应用[J].食品工业,2007(1):42-44.
[17]钟朝辉,李春美,梁晋鄂,等.鱼鳞胶原蛋白提取工艺的优化[J].食品科学,2006,27(7):162-166.
[18]大连轻工业学院,华南理工大学,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,2006:105.
[19]国家药典委员会.中华人民共和国药典(2005年版 二部)[M].北京:化学工业出版社,2005:附录162.
[20]Hong Dai,Zongcai Zhang,Subo Fan,et al.Analysis of hydroxyproline in collagen of pig skin tissue by low pressure ion chromatography separation and conductivity detection[J].Journal of the Society of Leather Technologists and Chmists,2006,15(4):55-58.
[21]张俊杰,段蕊,潘秀楼.鲤鱼鱼鳞酶溶性胶原蛋白提取工艺的应用[J].淮海工学院学报,2006,15(4):55-58.
[22]潘杨,许学勤.酸碱法提取鱼鳞胶的工艺研究[J].食品科技,2008(3):183-186.
Optim ization of decalcification process during extracting collagen from scale of sea fish
TANG Xu1,HE Jian-lin1,XU Chang-an1,SONG Xiao-hong2,OU Hui-long2,ZHANG Yi-ping1,YIRui-zao1
(1.Third Institute of Oceanography,State Oceanic Administration,Xiamen 361005,China;2.Department of Oceanography,Xiamen University,Xiamen 361005,China)
Optim ization of decalcification process during extracting collagen from scale of sea fish was investigated.Orthogonal experimentmethod was applied to estimate the effect of acid concentration,temperature and time on the decalcification of fish scale.Ion chrom atography was app lied to observe the effect of factors on the dissolution of collagen from scale while decalcifying.Optim ized process of collagen extraction from sea fish scale was confirmed.Tem perature was 18℃,acid concentration was 0.7mol/L and the tim e was 24h.The process was carried out at large scale,the result indicated it was perfect for plant scale w ith decalcification rate at 99.4%.
sea-fish scale;collagen;decalcification process;optim ization
TS201.1
B
1002-0306(2011)06-0326-03
2010-06-02
唐旭(1974-),男,博士,副研究员,研究方向:海洋天然产物化学,有机化学。
国家海洋局第三海洋研究所科研基本业务费[HE08102(1)];国家科技支撑计划[HT080601(2)]。
