玉米干磨酒精生产期间原料内呕吐毒素和赤霉烯酮的去向
2011-10-09余元善邱礼平唐语谦
余元善,邱礼平,吴 晖,* ,唐语谦
(1.华南理工大学轻工与食品学院,广东广州510641;2.广东食品药品职业学院,广东广州510520)
玉米干磨酒精生产期间原料内呕吐毒素和赤霉烯酮的去向
余元善1,邱礼平2,吴 晖1,*,唐语谦1
(1.华南理工大学轻工与食品学院,广东广州510641;2.广东食品药品职业学院,广东广州510520)
测试了几株工业上常用的酒精酵母在酒精发酵过程中转化赤霉烯酮(ZEN)和呕吐毒素(DON)的能力。结果表明:所测试的五株酒精酵母都具有转化ZEN成赤霉烯醇(ZOL)的能力,转化产物中两种构型的ZOL都有,两种构型的比例因不同的菌株而有明显的差异,但所有的五株酵母都不具有转化DON的能力。同时,使用人为添加有1μg/mL ZEN和1μg/mL DON的优质玉米为原料,以安琪牌超级酒精酵母为发酵菌种,模拟玉米干磨酒精生产工艺,在发酵结束后,发酵醪被分成三部分,即酒精、酒糟离心液和湿酒糟。HPLC分析结果表明:酒精中基本检测不到两种真菌毒素及其代谢物,ZEN及其代谢物主要分布在湿酒糟,而DON主要分布在酒糟离心液中。另外,从两种真菌毒素及其代谢物总的含量看,在整个工艺生产过程中,两种真菌毒素及其代谢物基本上没有发生降解。
玉米酒精生产,呕吐毒素,赤霉烯酮,转化
随着国家对燃料酒精需求的增加,我国每年都有大量玉米被用于生产燃料酒精。目前,玉米酒精的生产主要有两种生产工艺—干磨和湿磨。湿磨工艺首先将玉米分离成淀粉、麸皮、胚芽等,虽然它能够提高玉米利用率,但相比干磨法来说,需要更大的成本投资,所以国内外大部分玉米酒精厂都采用干磨工艺。在干磨玉米酒精生产工艺中,粉碎后的玉米粒与水混合调成一定浓度的浆液,浆液经糖化处理后,添加一定比例的酒精酵母进行厌氧发酵。发酵后的成熟醪经精馏后生成一定浓度的酒精,非挥发性的蒸馏残渣经离心后生成湿糟和酒糟离心液两部分。酒糟离心液蒸发浓缩后与湿糟混合,干燥制成的产品常称为dried distillers’grains and solubles(DDGS)。DDGS中含有较高的蛋白质、多种维生素等成分,一般作为动物饲料添加剂出售[1-2]。但是DDGS在作为动物饲料添加剂时,残留在DDGS中的真菌毒素对动物的健康构成了严重的威胁[3]。真菌毒素是农作物被真菌污染产生的一类有毒性或致癌性的次级代谢产物。玉米在生长、收获和储藏期间很容易被各种真菌污染,污染后的玉米粒上常含有不同浓度的各种真菌毒素。在玉米粒中,主要检测出的有伏马菌素(Fumonisin)、黄曲霉毒素(aflatoxin,AFN)、呕吐毒素(deoxynivalenol,DON)、玉米赤霉烯酮(zearalenone,ZEN)和赭曲霉毒素A(ochratoxin A,OTA)等真菌毒素[4]。在玉米粒中,玉米赤霉烯酮和呕吐毒素两种毒素的含量比较高,对动物的危害最突出,并且猪对它们也特别敏感。玉米赤霉烯酮及其衍生物都能对家禽(或畜)的生殖系统造成形态或功能上的变化,特别是雌性动物[5]。DON能够抑制动物体内蛋白质和核酸的合成,造成动物食欲减退,生长缓慢。高剂量能引起动物发生严重的呕吐反应[6]。本研究的目的是调查几株工业上常用的酒精酵母是否具有转化赤霉烯酮和呕吐毒素的能力,并且确定玉米干磨酒精生产期间原料内呕吐毒素和赤霉烯酮的去向,从而为综合开发玉米酒精糟(DDGS)提供参考依据。
1 材料与方法
1.1 材料与仪器
酿酒酵母(Saccharomyces.cerevisiae) 来源见表1,所有的菌株都培养在麦芽汁琼脂斜面上,4℃低温保藏,并定期接种转代;DON和ZEN 自己从禾谷镰刀菌(Fusarium graminearum)的小麦培养物中萃取和纯化;α-ZOL和β-ZOL的标准品 Sigma公司;各种真菌毒素的标准储备液 用70%甲醇水溶液溶解并稀释到所需浓度;甲醇 色谱级;超纯水 美国Milli-Q Academic Water system制备;优质玉米粒 从郊区农村收购;耐高温α-淀粉酶和糖化酶 当地酶试剂公司;微生物培养基 广州环凯微生物试剂有限公司;其它试剂 均为国产分析级。

表1 酵母菌株种类
氮吹仪 Organomation Associates,Inc;PuriToxSR TC-M160真菌毒素多功能净化柱 Trilogy Analytical Laboratory;Waters公司高效液相色谱检测系统 配置有 Waters 700 controller,Waters 2996 photodiode array detector和Waters 717 plus autosampler;实验室小型玻璃精馏装置,锤式粉碎机,高压蒸汽灭菌锅,低速离心机,恒温水浴锅,恒温气浴摇床,显微镜,旋转蒸发仪等。
1.2 实验方法
1.2.1 玉米糖化醪的制备[1,8]将从郊区收购的优质玉米粒用75%酒精浸泡5min后,自来水漂洗,55℃烘干,以除去玉米粒表面残留的大部分真菌毒素。烘干后的玉米粒用粉碎机粉碎至颗粒大小平均1mm左右。300g粉碎后的玉米粉与1000g水混合成玉米粉浆,并调节玉米粉浆的pH至6.0。接着,在121℃高压蒸汽灭菌锅中蒸煮15min,待其冷却到80~90℃后,按3U/g干淀粉的比例添加耐高温α-淀粉酶,为了使玉米淀粉充分液化成糊精,90℃保持30min。液化后的玉米粉浆冷却到60℃左右后,调节其pH到4.5,加入1.0g糖化酶(5万U/g酶粉),糖化3.5h后即成玉米糖化醪。待玉米糖化醪冷却到30℃左右时,就可用于酵母酒精发酵。
1.2.2 酒精酵母种子液的制备 向250mL摇瓶中添加50mL麦芽汁培养液体,6层纱布封口,115℃高压蒸汽灭菌15min。然后,分别从各株酒精酵母麦芽汁琼脂斜面上挑取一环菌体接入250mL摇瓶中,将摇瓶放入恒温气浴摇床中,28℃,200r/min培养,培养30h后作为种子液使用。
1.2.3 酒精酵母对ZEN和DON转化能力实验 在无菌操作条件下,分别向若干个15mL的螺盖塑料管中添加10mL新鲜制备的玉米糖化醪,根据实验要求,向各管中添加不同量的ZEN标准储备液,混合后静置1h。然后,向各管中添加一定量的酒精酵母种子液,使发酵前的酵母数量达到1×107个/mL,28℃静置培养。酵母细胞数量的计数采用显微镜血球板计数法。
按实验要求,定期取出每个浓度组的发酵醪,4000r/min离心5min,将上清液转入另一塑料管中。接着,向沉淀残渣中加入10mL甲醇,旋涡混合5min,4000r/min离心5min,将上清液也转入同一塑料管中。混合两次离心上清液,取其中部分液体过真菌毒素净化柱,滤过液用HPLC检测。对于较低浓度组,为了提高检测的准确度,离心上清液用旋转蒸发仪在50℃下蒸发干,加入15mL三氯甲烷在水槽式超声波仪中溶解蒸发残渣。将溶解有蒸发残渣的三氯甲烷相转入另一塑料管中,用氮吹仪在50℃蒸发干,用3mL 50%甲醇水溶液溶解,并通过真菌毒素净化柱净化,滤过液用HPLC检测。DON的转化实验也采用同样的方法。
1.2.4 玉米干磨酒精生产中各部分产品内呕吐毒素和赤霉烯酮及其代谢物含量分布研究 将500mL新鲜制备的玉米糖化醪(分别含有1μg/mL的ZEN和DON)在无菌条件下加到1L的三角瓶中,同时接入适量的Y1酵母种子液(初始酵母细胞浓度达到1×107个/mL),30℃静止培养。培养60h后,发酵结束。发酵结束后,发酵成熟醪采用实验室小型玻璃精馏柱精馏分离出酒精,非挥发性的蒸馏残留物即酒精糟用低速离心机4000r/min,离心5min。合并所有的离心上清液即为酒糟离心液,固体沉淀即为湿酒糟。
酒精部分用0.22μm的滤膜过滤后直接用HPLC检测其中呕吐毒素和赤霉烯酮及其代谢物的含量。取20mL酒糟离心液,用20mL正己烷萃取2次,弃去正己烷层。被正己烷萃取后的酒糟离心液采用1.2.3中的方法浓缩、净化。为了测定湿酒糟中两种毒素及其代谢物的含量,称取20g湿酒糟到一塑料管中,用40mL甲醇提取两次,每次旋涡混合5min,4000r/min离心5min。将两次离心上清液合并,合并后的离心液体也采用1.2.3中的方法浓缩、净化。净化后的滤液直接用HPLC检测。
1.2.5 液相色谱分析检测条件[9]在实验中,根据ZEN及其代谢物和DON及其代谢物的极性和紫外吸收的差异,采用不同的色谱条件分别检测。ZEN和其代谢物的分离检测采用Waters XTerraRMS C18分离柱(4.6mm×150mm,5μm),流动相为60%甲醇水溶液,流速1.0min/mL,柱温40℃,紫外检测器检测波长274nm;DON和其代谢物的分离检测采用Waters XTerraRMS C18分离柱(4.6mm ×150mm,5μm),流动相为20%甲醇水溶液,流速0.8min/mL,柱温40℃,紫外检测器检测波长220nm。为了增加分离柱的使用时间,在其前面安装有Waters XTerraRC18保护柱(5μm)。
1.2.6 数据分析和统计 实验中每个不同的处理重复三次,结果取三次的平均值。
2 结果与讨论
2.1 酒精酵母对ZEN转化的研究
在10mL玉米糖化醪(添加有5μg/mL ZEN)中接种各种酵母发酵后,比较不同发酵时期的发酵醪中ZEN的色谱分离图,可以发现两个新的物质峰生成,通过比较两个新物质峰的紫外吸收图谱和添加ZOL标准品进行色谱分离等方式,可以确定两个新物质峰分别是α-ZOL和β-ZOL。图1显示了Y1酵母不同发酵时期的发酵醪中ZEN的色谱分离图的变化。

图1 Y1酵母不同发酵时期发酵醪中ZEN的色谱分离图的变化
在实验中所研究的5株菌株都具有转化ZEN成ZOL的能力,转化产物中两种构型的ZOL都有,两种构型的比例因不同的菌株而有明显的差异。表2列出了五株酵母菌株分别在10mL添加有5μg/mL ZEN的玉米粉糖化醪中发酵72h后ZEN及其代谢物的高效液相色谱检测结果。

表2 10mL的玉米粉糖化醪中(含有5μg/mL ZEN)被五株酵母分别发酵72h后ZEN及其代谢物的含量(μg)
在研究中,我们向玉米粉糖化醪中添加了不同浓度的 ZEN(0.5、1.0、2.5、5.0、10.0、15.0μg/mL),用 5株酵母分别发酵72h后,比较了发酵醪中ZEN及其代谢物的含量。发现随着玉米糖化醪中ZEN浓度的增加,各株酵母对ZEN的转化率(发酵后ZEN的含量与发酵前ZEN含量的比值)明显下降,0.5μg/mL浓度组中,各株酵母对ZEN的转化率普遍在75%~80%之间,而15μg/mL各株酵母对ZEN的转化率普遍下降到65%左右,但产物中ZOL两种构型的比例基本保持不变。可以推断,几株酒精酵母对ZEN的转化速率可能受到产物ZOL浓度的抑制。
2.2 酒精酵母对DON转化的研究
在20mL玉米糖化醪(添加有10μg/mL ZEN)中接种各种酵母发酵后,比较不同发酵时期的发酵醪中呕吐毒素的色谱分离图,发现各个不同时期的发酵醪中呕吐毒素含量基本一致,所研究的五株酵母对DON均无转化能力。图2显示了Y1酵母不同发酵时期发酵醪中呕吐毒素的色谱分离图的变化。
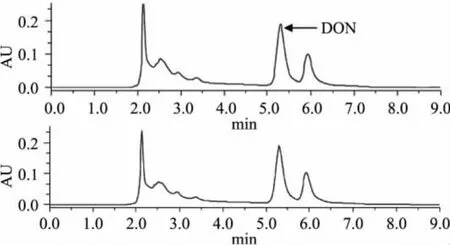
图2 Y1酵母不同发酵时期发酵醪中呕吐毒素的色谱分离图的变化
2.3 呕吐毒素和赤霉烯酮及其代谢物在玉米干磨酒精生产后各产品中含量分布研究
500 mL(分别含有1μg/mL的ZEN和DON)玉米糖化醪经Y1酵母(安琪牌超级酒精酵母)发酵72h后,发酵成熟醪经过精馏后,产生了酒精、酒糟离心液和湿酒糟三部分,我们分别检测了各个部分中DON和ZEN及其代谢物的含量,结果见表3。

表3 在玉米酒精发酵成熟醪各部分分离物中两种真菌毒素及其代谢物的含量
从表3可知,酒精中检测不出两种毒素及其代谢物;DON在酒糟离心液体和湿酒糟中的浓度差异不明显,湿酒糟对DON没有很强的吸附作用,90%以上的DON分布在酒糟离心液中;ZEN及其代谢物在湿酒糟中的含量是酒糟离心液中的30倍以上,湿酒糟对ZEN及其代谢物具有很强的吸附力,ZEN及其代谢物(85%~88%左右)主要富集在酒精糟中,这可能与酵母细胞壁成分有关。很多研究报道酵母细胞壁多糖成分对ZEN具有很强的吸附力[10]。
在整个玉米酒精生产过程中,除了ZEN发生转化外,两种真菌毒素在总的含量上变化很小,在整个工艺生产过程中,两种真菌毒素及其代谢物基本上没有发生降解。
3 结论
在玉米糖化醪的酒精发酵中,我们研究的五株酒精酵母都能把ZEN转化为ZOL,并且都具有很高的转化率。转化产物中β-ZOL的雌激素活性跟ZEN差不多,特别是α-ZOL的雌激素活性比ZEN高3~4倍,这就要求我们国家的质检部门在检测酒精糟等酵母转化副产物中ZEN的含量时要特别重视ZOL含量的测定。
ZEN和DON两种毒素及其代谢物在湿酒糟和酒糟离心液中分布不均匀,我们在对湿酒糟和酒糟离心液综合利用时,可以考虑将两者分开单独处理。
[1]Bothast R J,Schlicher M A.Biotechnological processes for conversion of corn into ethanol[J].Appllied Microbiology and Biotechnology,2005,67(1):19-25.
[2]谢林,吕西军.玉米酒精生产新技术[M].北京:中国轻工业出版社,2001.
[3]Wu F,Munkvold G P.Mycotoxins in ethanol co-products:modeling economic impacts on the livestock industry and management strategies [J].Journal of Agricultural and Food Chemistry,2008,56(11):3900-3911.
[4]Ouanes- Ben O Z,El Golli E,Abid- Essefi S,et al.Cytotoxicity effects induced by Zearalenone metabolites,α-Zearalenol and β - Zearalenol,on cultured Vero cells [J].Toxicology,2008,252(1):72-77.
[5]Zinedine A,Soriano J M,Molto J C,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:An oestrogenic mycotoxin [J].Food and Chemical Toxicology,2007,45(1):1-18.
[6]Pestka J J.Deoxynivalenol:Toxicity,mechanisms and animal health risks[J].Animal Feed Science and Technology,2007,137(4):283-298.
[7]Bata A,Lasztity R.Detoxification of mycotoxin-contaminated food and feed by microorganisms [J].Trends in Food Science &Technology,1999,10(7):223-228.
[8]李大鹏,凌相阳,臧秀玲.耐高温酒精活性干酵母在玉米酒精生产中的应[J].酿酒,2005,132(11):44-45.
[9]张艺兵.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006.
[10]Yiannikouris A,Poughon L,Cameleyre X,et al.A novel technique to evaluate interactions between Saccharomyces cerevisiae cell wall and mycotoxins:application to zearalenone[J].Biotechnology Letters,2003,259(10):783-789.
[11]Takahashi-Ando N,Ohsato S,Shibata T,et al.Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene from Clonostachys rosea[J].Applied and Environmental Microbiology,2004,70(6):3239-3245.
[12]Russell R K,Ralph E M D L,et al.Transformation of Deoxynivalenol(Vomitoxin)by Rumen Microorganisms [J].Journal of Agricultural and Food Chemistry,1984,32(7):1181 -1183.
[13]He P,Young L G,Forsberg C.Microbially detoxified vomitoxin- contaminated corn for young pigs [J].Journal of Animal Science,1993,71(4):963-967.
[14]Young JC,Zhou T,Yu H,et al.Degradation of trichothecene mycotoxins by chicken intestinal microbes[J].Food and Chemical Toxicology,2007,45(1):136-143.
Fate of deoxynivalenol and zearalenone during dry grind corn ethanol production
YU Yuan-shan1,QIU Li-ping2,WU Hui1,*,TANG Yu-qian1
(1.College of Light Industry & Food,South China University of Technology,Guangzhou 510641,China;2.Guangdong Food and Drug Vocational College,Guangzhou 510520,China)
The transformation of zearalenone and deoxynivalenol by five alcohol yeasts and its fate during dry grind corn ethanol production were researched.All five alcohol yeasts can transform zearalenone into zearalenol,the ratio of α-zearalenol and β-zearalenol produced by five alcohol yeasts was different,but all five alcohol yeasts didn’t have the ability to transform deoxynivalenol.After corn saccharified mash added 1μg/mL ZEN and 1μg/mL DON was fermented by Angel brand super alcohol yeast,was separated into three fractions,including ethanol fraction,thin stillage and wet stillage.No mycotoxins and its metabolites could be detected in the ethanol fraction.Wet stillage have strong adsorption to ZEN and its metabolites,but weak adsorption to deoxynivalenol,so that the great proportion of ZEN and its metabolites concentrates in wet stillage,and deoxynivalenol mostly distributes in thin stillage.In addition,according with the total contents of two mycotoxins and its metabolites,they almost did not degraded during dry grind corn ethanol production.
corn ethanol production;deoxynivalenol;zearalenone;transformation
TS201.1
A
1002-0306(2011)06-0208-04
2010-06-12 *通讯联系人
余元善(1983-),男,博士生,研究方向:食品质量与安全。
国家重点基础研究发展计划(973计划)(2009CB118601)。
