超滤法浓缩菊糖果转移酶的初步研究
2011-10-09周榴明沐万孟
杭 华,赵 萌,周榴明,沐万孟,缪 铭,江 波
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
超滤法浓缩菊糖果转移酶的初步研究
杭 华,赵 萌,周榴明,沐万孟,缪 铭,江 波*
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
超滤浓缩的菊糖果糖转移酶粗酶根据用途可直接使用或进一步纯化,采用截留分子量为10kDa的Pellicon-2盒式超滤膜包,对菊糖果糖转移酶超滤浓缩进行了初步研究。结果表明,酶解菊糖产物为DFAIII;酶收率85%以上,膜通量减少至3.2L/m2·h;单位体积酶活(U/mL)增加8.5倍,比酶活达到6.7U/mg;再生后,膜通量可以恢复95%以上。
菊糖果糖转移酶,超滤,浓缩
膜分离技术是一种新型高效、精密的分离技术,采用半透膜的分离方法,具有分离过程不发生相变化、高效分离、设备简单、节能、常温操作、无污染等优点,可用于生物活性物质如酶的浓缩和分离[1]。利用超滤技术浓缩酶液,在低温下操作,酶活损失少,操作简单,易于实现大规模的工业化生产[2]。菊糖果糖转移酶(Inulin Fructotransferase EC2.4.1.93,即Inulase),该酶能催化菊糖转化为2个果糖基组成的环状二糖,即双果糖酐III,又称二果糖二酐[3]。双果糖酐Ⅲ是近年发现的一种新型天然功能性甜味剂,易溶于水,甜度是蔗糖的一半,热值为蔗糖的一半[4];具有促进矿物元素和黄酮类物质的吸收、增进骨骼生长、利于排尿、改善便秘、预防结肠癌及抑制蛀牙等功能,因而在食品和医药领域中应用潜力广泛[5]。发酵液经板框过滤除去菌体得到粗酶液的酶活不高,若直接用无机盐(硫酸铵)对滤液进行盐析沉淀,不仅使无机盐用量大幅度增加,还增加操作的复杂性和劳动量。因此,在进行无机盐沉淀之前对粗酶液进行浓缩是非常必要的。本实验考虑到Inulase的分子特性,采用超滤技术来提高酶的浓度,去除发酵液中的一部分小分子的杂质,同时探讨超滤对酶活的影响。
1 材料与方法
1.1 实验材料
超滤装置 Pellicon超滤器,滤膜为Pellicon-2盒式超滤膜包,40mm×300mm尺寸,有效过滤面积0.5m2,美国密理博Millipore公司。
1.2 实验方法
1.2.1 实验前洗膜方法 进口液(in)=Feed;循环液口(out)=Retentate;透过液口(p)=Permeate;进口压力=Pin;循环口压力=Pout;透过口压力=Pp;1Psi=0.07bar。
冲洗:打开循环液阀门,将循环液管和透过液放入废液容器,排空系统中的储存液,用少量纯水冲洗进液口管头;清洗膜面(不加压清洗):在干净的容器中加入至少20L纯水,调节泵速至Pin=5~15Psi并稳定,测定循环液管流出液体积不小于6L或中性;清洗膜孔(加压清洗):提高泵速至进口压力达到Pin=15~20Psi,调节循环阀至循环口压力至 Pout=10Psi,稳定后冲洗至透过液管流出液体积达到35L以上或中性为止;正常水通量测定:通过泵速和循环阀调节 Pin=10Psi,Pout=5Psi,测定透过液口1min透过的水的体积。
1.2.2 超滤方法 采用本实验室黄色节杆菌的同批发酵液,经板框离心除去菌体后,上清液利用布氏漏斗抽滤,滤液进行超滤,超滤的发酵液体积为10L,进口压力20~25Psi,循环口压力 5~10Psi,压力差控制在10Psi,料液温度在40℃以下。
1.3 测定方法
1.3.1 菊糖果糖转移酶酶活测定方法[6]反应体系(1mL):0.5mL 10%的菊糖溶液,0.45mL 0.1mol/L柠檬酸钠缓冲液(pH5.5),0.05mL酶液;充分混合后,60℃反应10min,100℃下灭酶活5min,10000r/min 离心10min,取上清液检测。
HPLC 检测条件:糖柱(Waters Sugur-PakTM 1,6.5mm×300mm);流动相:超纯水;示差折光检测器(Shodex RI101);柱温:80℃;流速:0.4mL/min;进样量:10μL。
酶活力单位定义:在上述检测条件下,每分钟生成1μmol DFAIII所需要的酶量定义为1个单位酶活(即1U)。
酶的收率:酶液浓缩一定倍数后的酶活与未浓缩酶液总酶活的比值。
1.3.2 蛋白含量测定方法 采用福林酚法(参见中华人民共和国专业标准ZBX 66030287)。
1.3.3 膜通量的测定 用量筒接滤出液,同时用秒表计时,用滤出液体积除以相应时间和膜面积表示。
2 结果与讨论
2.1 菊糖果糖转移酶酶解产物-DFAⅢ
由1.3.1的方法,菊糖在菊糖果糖转移酶作用下,生成物主要有DFAIII和少量的低聚果糖,见图1。结果表明,6.392min为菊糖的峰,7.197、7.643、8.372min为低聚果糖峰(分别对应蔗果四糖、蔗果三糖、蔗果二糖),9.748min为DFAIII的峰,菊糖转化率达到80%以上。

图1 酶解产物的HPLC图谱
2.2 截留分子量为10kDa的Pellicon-2盒式超滤膜包的分离效果
Inulase分子质量为30kDa以上,因此以10kDa的Pellicon-2盒式超滤膜包进行超滤的实验,结果见表1。结果表明,Inulase透过率小于2%,大部分酶仍存在于浓缩液中;因此采用10kDa的Pellicon-2盒式超滤膜包对该酶进行超滤是可行的。

表1 超滤中Inulase透过情况
2.3 超滤时间对膜通量的影响
随着超滤的进行,透过的液体增多,由于浓度差极化在膜表面上形成浓缩的凝胶层,使膜通量逐渐降低。因此本实验研究了菊糖果糖转移酶液的膜通量随超滤时间的变化关系,结果见图2。在超滤60min以前,膜通量下降迅速,主要因为膜表面物其他物质,阻力较小;由于大分子物质(如蛋白质)在膜表面沉淀而使阻力迅速增加,因此膜通量下降非常快。60~90min阶段,沉淀在膜表面的大分子物质逐渐加厚,膜的阻力增加,通量变化不大。90~120min阶段,膜通量下降速率较快,120min后,通量趋向于稳定,膜通量值很小,降低至3.2L/m2·h。说明膜污染较严重,需要进行清洗。在该浓缩条件下,浓缩倍数与时间的关系见图3。浓缩至2~4倍,需要时间长是因为透过液的体积多(占浓缩前酶液体积75%);浓缩至6~10倍,需要时间逐渐变短,因为膜通量稳定,透过液的体积也在逐渐变少(占浓缩前酶液体积15%)。

图2 膜通量随时间变化曲线
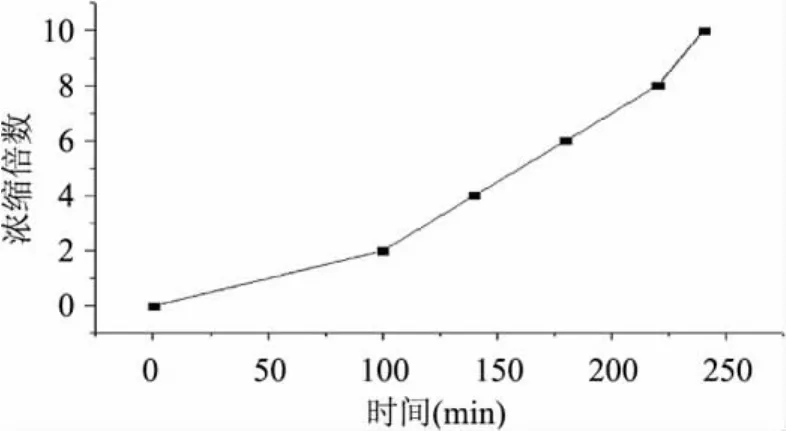
图3 浓缩倍数随时间变化曲线
2.4 超滤浓缩倍数对Inulase酶活的影响
采用10kDa的Pellicon-2盒式超滤膜包进行浓缩,菊糖果糖转移酶液在超滤过程中的酶活随浓缩倍数的变化情况如图4所示。菊糖果糖转移酶的酶活随着浓缩倍数的提高而增加,浓缩10倍后,单位体积酶活提高8.5倍,由于发酵液的浓度较小,增大浓缩倍数,提高酶活单位,有利于后续的工艺生产。
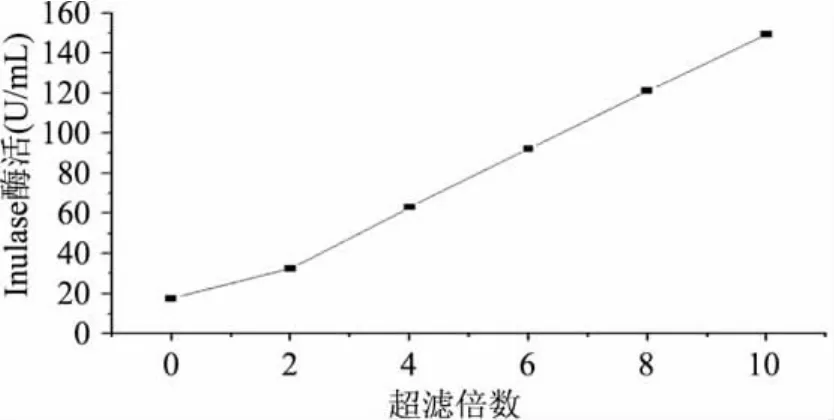
图4 超滤倍数对酶活的影响
2.5 超滤倍数对Inulase比酶活的影响
由于在超滤过程中,发酵液中的总蛋白也会随着浓度的变化而变化,因此采用测定酶活力和总蛋白的含量,利用两者的比值即比活力来反映超滤过程对酶活的影响。实验结果如图5所示,浓缩到2倍时,比酶活的变化最大,随着浓缩倍数的增加,比酶活的变化不是很大,比酶活从4.3U/mg增加到6.7U/mg。原因是开始浓缩时,小于10kDa的小分子的蛋白透过膜包,使总蛋白的量减少;浓缩倍数再增大,对总蛋白量的影响不大。
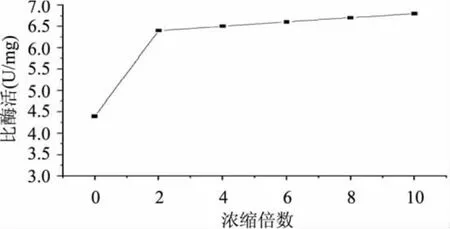
图5 浓缩倍数对比酶活的影响
2.5 膜包的清洗与再生
由于浓度差极化、膜的污染等原因而使膜包通量迅速下降,甚至堵塞膜孔,可以通过定期清洗恢复膜包的分离功能[7]。本实验采取以下步骤:
清洗:a.水洗:程序和步骤同1.2.1的冲洗,可用40~45℃ 的热水;b.碱洗:在容器中加入 40~45℃0.1mol/L NaOH 20L,开放循环液口和透过液口,启动泵,调节泵速至Pin=20~25Psi,调节循环阀门至Pout=5Psi,当容器中NaOH剩下10L时,将循环液和透过液管一起放入容器中,全循环30min后,停泵排空系统中的碱液;c.水洗:程序和步骤同1.2.1的冲洗;d.水通量测定:通过泵速和循环阀调节Pin=10Psi,Pout=5Psi,测定透过液口1min透过的水的体积。
保存:将0.1mol/L NaOH打入系统中保存,进口压力15Psi,循环口压力5Psi,直到透过液口的pH为碱性,并维持1~2min,关闭所有阀门;或将膜堆从不锈钢夹具上拆下来,用密封袋,注入相应浓度的NaOH保存液密封保存。
膜通量恢复是指超滤一次后再生膜通量与超滤前膜通量的比值。通过实验测得膜通量与再生次数的关系见图6,膜包再生5次,膜通量从12L/m2·h降低至10.1L/m2·h,说明清洗后膜孔中仍含有极少量的杂质;因此,超滤后要及时再生,膜通量可以恢复95%以上。
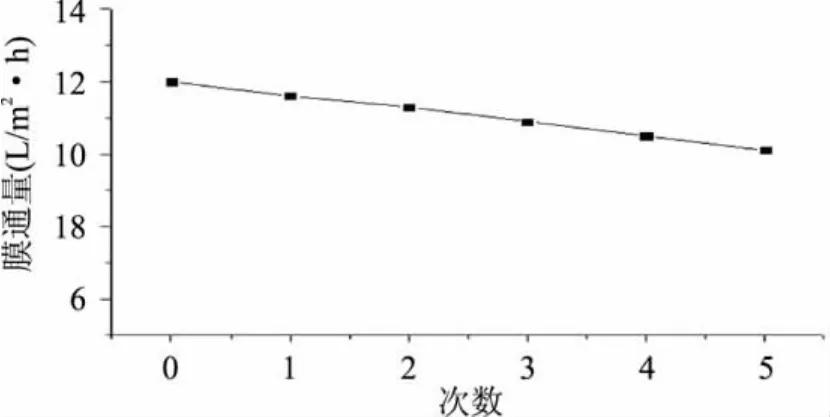
图6 膜通量与再生次数的关系
3 结论
采用分子量10kDa的膜包进行超滤,酶活的收率能达到85%~93%,损失率为10%。通过对超滤过程中酶活力和比活力变化的分析,浓缩倍数提高到10倍,酶活力增加8.5倍,而比活力变化不是很大;因此提高浓缩倍数便于用硫酸铵沉淀粗酶,也有利于大规模的利用酶反应生产DFAIII;或进一步纯化该酶,进行酶学性质研究。采用蒸馏水和0.1mol/L NaOH清洗膜包后,膜通量可以恢复95%以上。
[1]谷大建,徐巍.膜分离技术的应用及研究进展[J].中国药业,2008,17(6):58-59.
[2]李占生.超滤技术在酶的浓缩中的应用[J].天津纺织工学院学报,1996,15(2):57-59.
[3]CHO CHUL-MAN,SANG-OK LEE,JI-SOOK HWANG,et al.Purification and Characterization of an Inulin Fructotransferase from Flavobacterium sp.LC-413[J].Journal of Microbiology and Biotechnology,1997,7(2):121-126.
[4]Katsuichi Saito,Fusao Tomita.Difructose Anhydrides:Their Mass- Production and PhysiologicalFunctions[J].Biosci Biotechnol Biochem,2000,64(7):1321-1327.
[5]赵萌,沐万孟,张涛,等.新型食品添加剂双果糖酐III的研究进展[J].食品与发酵工业,2008,34(8):123-126.
[6]PARK,JEONG-BOK,YONG-JIN CHOI.Purification and characterization of Inulin Fructotransferase(Depolymerizing)from Arthrobactersp.A-6[J].JournalofMicrobiology and Biotechnology,1996,6(6):402-406.
[7]祝生杰.超滤器的膜污染控制与处理[J].膜科学与技术,1997,17(2):1-4.
Inulin fructotransferase concentration by ultra-filtration method
HANG Hua,ZHAO Meng,ZHOU Liu-ming,MU Wan-meng,MIAO Ming,JIANG Bo*
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Inulin fructotransferase concentrated through ultra-filtration could be utilized directly and further purified.Pellicon-2 ultra-filtration membrane bag with molecular weight cut off(MWCO)of 10kDa was investigated in order to concentrate inulase solutions.Results indicated that DFAIII was the enzymatic hydrolysis product.And after concentration,85%enzyme yield was obtained,while membrane flux decreased to 3.2L/m2· h.Furthermore,concentration resulted in an unit volume enzyme activity(U/mL)fold of 8.5 and increased inulase specific activity to 6.7U/mg.Through regeneration,membrane flux could be recovered to over 95%of original level.
inulin fructotransferase;ultra-filtration;concentration
TS201.2+5
A < class="emphasis_bold">文章编号:1002-0306(2011)06-0201-03
1002-0306(2011)06-0201-03
2010-06-17 *通讯联系人
杭华(1977-),男,在读博士研究生,研究方向:食品生物技术。
