乳酸和乳酸铀对红曲霉突菌株合成代谢色素及橘霉素的影响
2011-10-09吴吉林朱明军梁世中钟海雁林亲录
周 波,吴吉林,朱明军,梁世中,钟海雁,林亲录,*
(1.中南林业科技大学食品科学与工程学院,湖南长沙410004;2.吉首大学城乡资源与规划学院,湖南张家界427000;3.华南理工大学生物科学与工程学院,广东广州510006)
乳酸和乳酸铀对红曲霉突菌株合成代谢色素及橘霉素的影响
周 波1,吴吉林2,朱明军3,梁世中3,钟海雁1,林亲录1,*
(1.中南林业科技大学食品科学与工程学院,湖南长沙410004;2.吉首大学城乡资源与规划学院,湖南张家界427000;3.华南理工大学生物科学与工程学院,广东广州510006)
主要研究了乳酸和乳酸钠对红曲霉突变菌株代谢合成红曲色素和橘霉素的影响。实验结果表明,添加一定量的乳酸和乳酸钠都有利于红曲色素(包括黄色素和红色素)的合成代谢,有利于黄色素合成代谢的最适乳酸或乳酸钠添加量在0.01~0.05mL/30mL之间,而有利于红色素合成代谢的最适乳酸或乳酸钠添加量在0.05~0.1mL/30mL之间,红曲霉突变菌株利用乳酸或乳酸根作为其生长的底物和红曲色素合成代谢的底物。乳酸或乳酸盐本身对红曲霉突变菌株合成代谢橘霉素没直接的影响,其形成的发酵pH环境直接影响了橘霉素的合成代谢。
乳酸,乳酸钠,红曲色素,橘霉素,红曲霉突变菌株
红曲是一种具有东方色彩的传统产品,在我国已有数千年的应用历史。红曲色素作为一种天然色素,其安全性高,经急性毒性实验、慢性毒性实验以及致突变性实验都证明其无毒,也无致畸变作用,故红曲色素现已广泛应用于各种食品中[1]。在食品安全问题日益受到关注的今天,由此类天然色素取代人工合成色素的前景广阔。红曲色素属于聚酮类色素,由6种结构相近的成分组成,安卡红曲黄素(Ankaflavine)与红曲素(Monascin)为黄色素,橙色素为红斑红曲素(Rubropunctatine)与红曲玉红素(Monascorubrine),红斑红曲胺(Rubropunctamine)与红斑玉红胺(Monascorubramine)为红色素。其中黄色素作为一类主要的食用色素的品种,通常占市场需求量的60%以上,故红曲黄色素的开发研究具有广阔的前景及重大的经济效益。日本目前已实现了红曲黄色素的工业化生产,产品名为日本天然No393。红曲黄色素在国内已有市售产品,黄色素色价不到30个色价单位或黄色素色价能达到80以上色价单位,但黄色素色调不到1[1-2]。而国外的专利和文献报道,选育出的菌株液态发酵的黄色素色价高或黄色素色调水平较高;黄色素色调能达到3~4,但黄色素色价不到60色价单位左右[3],黄色素色价达到100色价单位左右,但是黄色素色调不到1.5[4]。泰国在这方面的研究较为突出,他们通过诱变得到单产黄色素的菌株,经过二十多年的研究取得不错的成绩[5-9],但据证实还没有实现工业化生产。虽然红曲霉菌合成代谢红曲色素和橘霉素的机理还没完全研究清楚,但是影响它们合成的关键酶都是聚酮合成酶,红曲霉菌合成代谢的红曲色素和橘霉素都是通过聚酮化合物衍生而成[10]。红曲色素是一类聚酮化合物,以乙酰CoA为基本构成单位聚合得到生色基团,生色基团再与脂肪酸聚合成不同的红曲色素。红曲橘霉素与青霉橘霉素的合成代谢途径不同之处在于前者是以四酮体化合物为代谢分支点,后者是以五酮体化合物为代谢分支点[10]。本实验通过物理化学诱变获得一株高产黄色素的红曲霉突变菌株(Monascus anka mutant MYM2)[11],对其合成代谢黄色素的特性进行了一定的研究,并且也证实其合成代谢的黄色素就是Ankaflavine与 Monascin[12-15]。在本文中,根据红曲色素和橘霉素合成代谢的相关报道[10]和本文中所用实验菌株的实际情况,来研究乳酸对红曲霉突变菌株合成代谢黄色素和橘霉素的影响,希望提高红曲霉突变菌株黄色素的合成代谢量。
1 材料与方法
1.1 材料与仪器
红曲霉突变株菌(Monascus anka mutant MYM2)
华南理工大学生化工程研究室保存;所用化学试剂 除玉米粉是从超市购买外,其余均从广州市化学试剂厂购买,均为分析纯;斜面种培养基 麦芽汁琼脂培养基(麦芽汁由珠江啤酒有限公司提供);种子培养基(g/L) 玉米粉30,硝酸钠3,FeSO4·7H2O 0.01,磷酸二氢钾4,pH6.0;发酵培养基(g/L) 氯化铵15,可溶性淀粉70,葡萄糖20,玉米浆10,KH2PO45,初始pH4.0。乳酸和乳酸钠浓度根据实验设计需要变化,培养基均在121℃饱和蒸汽灭菌20min。
紫外可见分光光度计 2802SUV/VIS,上海尤尼科斯科学仪器有限公司;全温摇床 C25KC型,美国New Brunswick Scientific公司;生化培养箱 SPX-250B-Z型,上海博迅实业有限公司医疗设备厂;电子天平 ER-180A型,日本A&D公司;液相色谱
Aglient 1100,美国安捷伦科技有限公司;超声波细胞破碎机 Scientz IID,宁波新芝生物科技股份责任有限公司。
1.2 种子培养和发酵方法
斜面种在32℃下培养2~3d;种子液在32℃,160r/min培养2~3d;摇瓶发酵条件为250mL三角瓶装30mL培养基,160r/min,32℃下培养7d,所有发酵实验均三个平行,计算平均值。
1.3 分析方法[16]
1.3.1 胞外色价测定 取一定体积的发酵液,4000r/min离心20min,上清液经定性滤纸过滤,滤液经稀释至适当倍数,用分光光度计在波长410nm下测定其OD410值,此值乘以稀释倍数即为胞外黄色素色价;在波长510nm下测得OD510乘以稀释倍数即为胞外红色素色价。
1.3.2 胞内色价测定 离心后的菌体沉淀用70%乙醇抽提1h,然后4000r/min离心20min,上清液过滤,滤液经稀释至适当倍数,测定其OD410,此值乘以稀释倍数即为胞内黄色素色价;测得的OD510值乘以稀释倍数即为胞内红色素色价。
1.3.3 总黄色素色价的计算 总黄色素色价(U/mL)=胞外黄色素色价+胞内黄色素色价
1.3.4 色调的计算 色调 =黄色素色价/红色素色价
1.3.5 细胞干重(DCW)的测定 吸取5mL发酵液,4000r/min离心20min,去上清液,沉淀用蒸馏水洗涤,4000r/min离心20min,去上清液,重复三次后沉淀于80℃烘箱中烘至恒重。
1.3.6 橘霉素的检测 5mL发酵液用5mL 95%乙醇抽提1h,通过超声波细胞破碎机破碎后于4000r/min离心20min,离心上清液通过滤纸过滤,滤液再用0.45μm有机系膜过滤,吸取滤液20μL来进行橘霉素色谱检测。HPLC检测条件:Aglient 1100的高效液相,柱为 Eclipse XDB reverse C18柱(250mm ×4.6mm,5μm颗粒大小),柱温28℃,检测器为紫外检测器(λ=254nm);流动相(用色谱纯磷酸来调pH至2.5)为乙睛 ∶水(35∶65,v∶v),流动相流速为1.0mL/min[17]。橘霉素测定标准曲线为:y=27.11x-70.647(稀释倍数为100~300),其中y为峰面积,x为橘霉素浓度(mg/L)。
2 结果与分析
2.1 乳酸对红曲霉突变菌株代谢合成黄色素的影响
随着乳酸添加量的增加,胞外、胞内和总黄色素色调都呈现下降趋势(见表1)。但是乳酸的添加对于黄色素合成代谢的影响不同,0.01~0.1mL之间乳酸添加量较有利于黄色素(尤其是胞内黄色素)的合成代谢,当乳酸添加量为0.01mL和0.05mL时,胞内黄色素色价比未添加乳酸发酵时分别高出26.38%和26.96%,总黄色素色价比未添加乳酸发酵时分别高出21.44%和27.04%(见表2)。在一定浓度范围内,添加乳酸也有利于红色素的合成代谢,红色素合成代谢的情况与黄色素的基本一致(见表2和表3)。当添加0.05、0.1、0.5mL乳酸时,胞内红色素色价和总红色素色价比未添加乳酸发酵时的要高,胞内红色素色价分别高出31.53%、64.64%和26.06%,总红色素色价分别高出32.88%、61.70%和41.14%。这说明一定量的乳酸有利于红曲霉突变菌株合成代谢红曲红色素和红曲黄色素。

表1 乳酸对红曲黄色素色调的影响
乳酸添加量在0.01~0.1mL之间时,细胞干重虽然有所增加,但不很明显,如当乳酸添加量为0.01、0.05、0.1mL时,细胞干重比未添加乳酸发酵时分别高出2.10%、5.40%和13.20%(见表4),这说明乳酸对红曲霉突变菌株的生长没明显有利影响,发酵液最终pH随着乳酸添加量(0.01~1mL)的增大而上升,且上升幅度较大(1.86~6.24),这说明在发酵过程中,红曲霉突变菌株利用乳酸来作为菌生长或合成代谢产物的底物,乳酸被利用后的某些产物导致了发酵液pH上升,这还有待进一步的研究。而当乳酸添加量为5mL时,细胞干重非常小,那是因为乳酸添加过多,造成极低pH发酵环境,抑制了红曲霉突变菌株的生长。
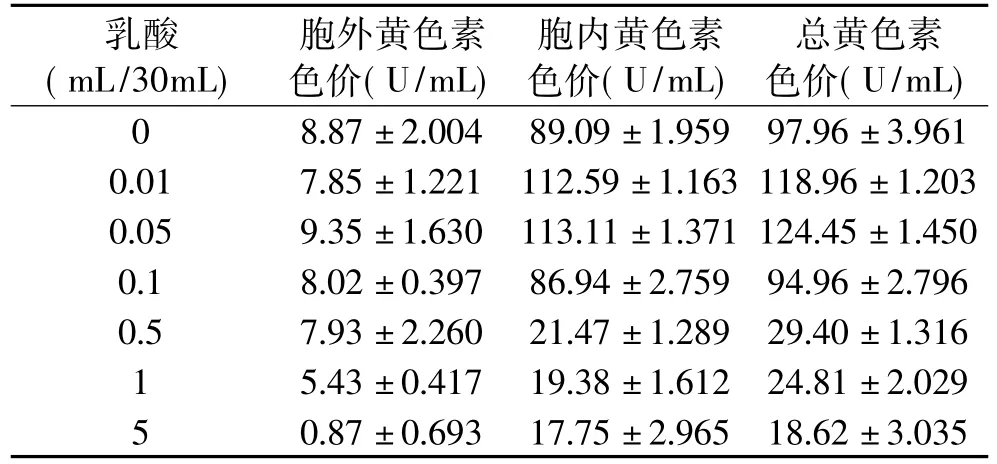
表2 乳酸对红曲黄色素代谢合成的影响
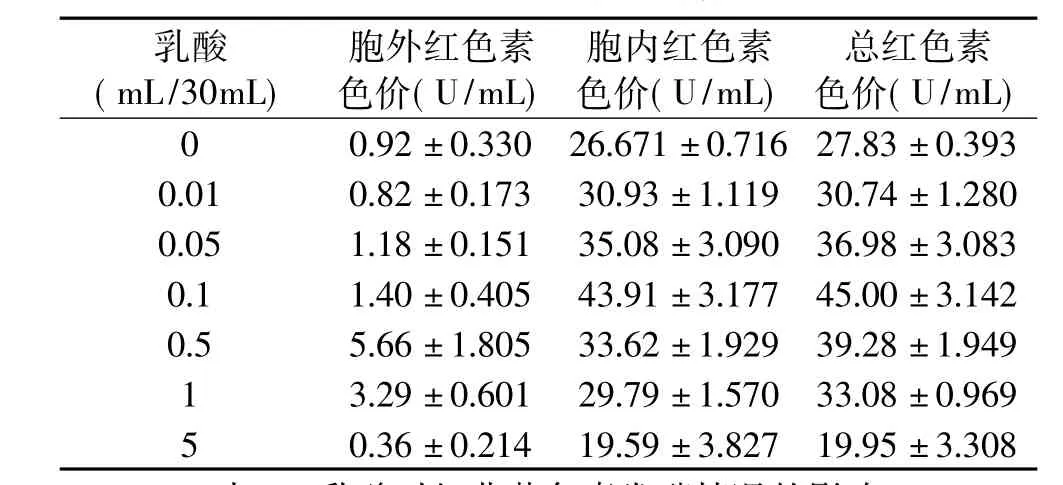
表3 乳酸对红曲红色素代谢合成的影响

表4 乳酸对红曲黄色素发酵情况的影响
乳酸添加量在0.05mL以下时,橘霉素的合成代谢量与没添加乳酸时相比,差异不明显,当添加量为0.1mL时,橘霉素合成代谢量高出没添加乳酸发酵时的72.22%,但继续增加乳酸添加量时,在发酵液中检测不到橘霉素的存在(见表4)。本文实验中,橘霉素的合成代谢的变化情况与已报道的一致[13]:发酵液pH环境维持在3~5之间时能促进橘霉素的合成代谢,发酵液pH环境过高或过低反倒消除了橘霉素的合成代谢。乳酸添加量为5mL时检测不到橘霉素的存在,是因为红曲霉突变菌株生长不正常所造成的。这在一定程度上说明乳酸本身可能没有参与橘霉素的合成代谢。
根据以上实验结果,认为乳酸可以作为红曲霉突变菌株生长的底物及其红曲色素合成代谢的一种底物,并且乳酸影响橘霉素的合成代谢是因为其形成的发酵液pH环境而不是乳酸本身参与橘霉素的合成代谢,但是这还有待进一步实验证明。
2.2 乳酸钠对红曲霉突变菌株代谢合成黄色素的影响
在乳酸实验研究中,乳酸对红曲霉突变菌株生长影响不明显的可能原因之一是因为乳酸形成的pH环境造成的,为此选择乳酸钠作进一步的实验验证。
从表5得知,乳酸
钠添加量在0.05mL以下时,黄色素色价相对于未添加乳酸钠而言都有所提高,但不明显,胞内黄色素色价增加量不超过5%,总黄色素色价增加量不超过 6%。而乳酸钠添加量在0.05mL以上时,对胞内黄色素色价和总黄色素色价有不利影响。

表5 乳酸钠对红曲黄色素代谢合成的影响
乳酸钠添加量为0.1mL时,胞内红色素色价和总红色素色价都有明显提高,相对于未添加乳酸钠而言分别高出122.67%和117.79%,再增加乳酸钠添加量时,胞内红色素代谢合成量下降(见表6)。
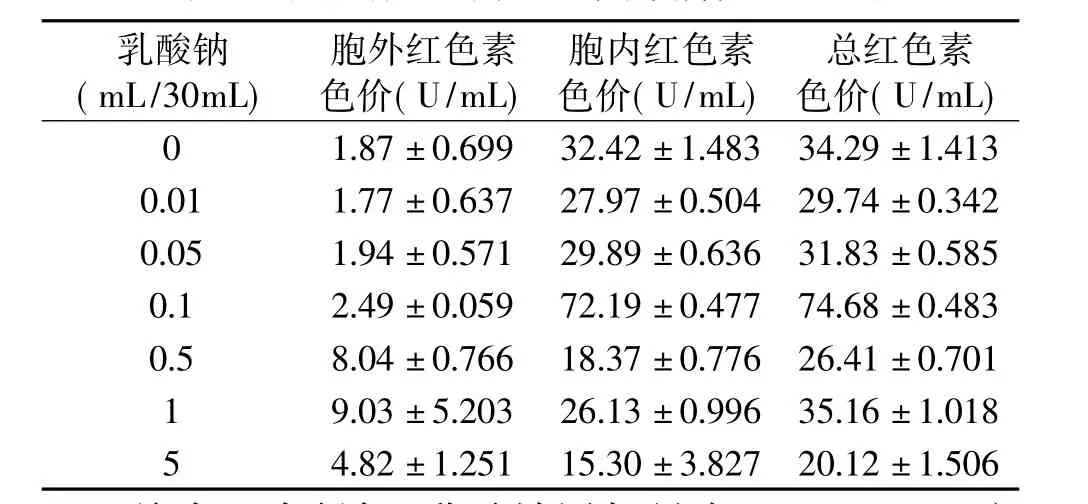
表6 乳酸钠对红曲红色素代谢合成的影响
从表7中得知,乳酸钠添加量在0.01~0.1mL之间,细胞干重有所提高,分别高出对照组5.23%、20.24%和10.60%,说明此浓度范围内添加乳酸钠有利于菌的生长,但过多乳酸钠的添加不利于菌的生长,如5mL乳酸钠的添加。因为乳酸钠为强碱弱酸盐,随着乳酸钠添加量的提高,红曲霉突变菌株消耗乳酸根而导致发酵环境pH上升,从而不利于红曲霉突变菌株的生长。随着乳酸钠添加量的增加,橘霉素的合成代谢量提高,如当乳酸钠添加量为0.1mL时,橘霉素的合成代谢量高出未添加乳酸钠时的52.63%,但是继续增加乳酸钠时,在发酵液中就检测不到橘霉素的存在(见表7),这是因为随着乳酸钠添加量的增加,发酵环境的pH上升,消除了橘霉素的合成代谢。这说明一定量的乳酸钠能促进橘霉素的合成代谢也能消除橘霉素的合成代谢,但都跟发酵液 pH的高低有关,而非乳酸钠本身[13]。

表7 乳酸钠对红曲黄色素发酵情况的影响
3 结论
乳酸和乳酸钠的实验结果表明,在本文研究范围内,添加一定量的乳酸和乳酸钠都有利于红曲色素(包括黄色素和红色素)的合成代谢,有利于黄色素合成代谢的最适乳酸和乳酸钠添加量在0.01~0.05mL/30mL之间,有利于红色素合成代谢的最适乳酸添加量在0.05~0.1mL/30mL之间,而乳酸钠的最适添加量为0.1mL/30mL。红曲霉突变菌株可以利用乳酸或乳酸根作为菌生长的底物和红曲色素合成代谢的底物。乳酸或乳酸盐本身对红曲霉突变菌株合成代谢橘霉素没任何直接的影响,而是其造成的发酵pH环境影响了橘霉素的合成代谢。
[1]唐秋琳,赵海,王忠彦,等.一株产黄色素红曲霉Monascus HB-5的生物学特性研究 [J].食品科技,2006(7):47-51.
[2]马美荣,方慧英,王正祥,等.红曲霉单产黄色素突变株的选育[J].微生物学通报,2001,28(4):66-69.
[3]Chen Yen-Lin,Hwang Ing-Er,Lin Ming-Chih,et al.Monascus purpureus mutant and its use in preparing yellow pigment.UPT.No 6635467.
[4]Chul SS,Hyung JK,Moon JK,et al.Morphological change and enhanced pigment production of Monascus when cocultured with Saccharomyces cerevisiae or Aspergillus oryzae[J].Biotechnology and Bioengineering,1998,59(8):576-581.
[5]Yongsmith B,Chaisrisook C,Chimanage P,et al.Papers of the symposium on Monascus culture and application[C].Toulouse France,1998(9):115-126.
[6]Yongsmith B,Krairak S,Bavavoda R.Production of yellow pigments in submerged culture of a mutant of Monascus sp.[J].J Fermen Bioeng,1994,78:223-228.
[7]Yongsmith B,Kitprechavanich V,Chitradon L,et al.Color mutants of Monascus sp.Kb9 and their comparative glucoamylase on rice solid culture[J].J Mol Catal B:Enzymatic,2000,10:263-272.
[8]Somchai Krairak,Kouji Yamamura,Ryoichi Irie,et al.Maximizing yellow pigment production in fed-batch culture of Monascus sp.[J].Journal of Bioscience and Bioengineering,2000,90(4):363-367.
[9]Yongsmith B,Tabloka T,Yongmanitchai W,et al.Culture conditions for yellow pigment formation by Monascus sp.KBlO grown in cassava medium [J].World J Microbial Biotechnol,1993,9:85-90.
[10]Hassan Hajjaj,P Blanc J.Biosynthetic pathway of citrinin in the filamentous,fungus Monascus ruber as revealed by 13C nuelear magnetic resouance[J].Appled and Environmental Microbiology,1999,1:311-314.
[11]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1909-1914.
[12]Bo zhou,Jufang Wang,Yuewu Pu,et al.Optimization of culture medium for yellow pigments production with Monascus anka mutant using response surface methodology[J].European Food Research and Technology,2009,228(6):895-901.
[13]周波,朱明军,王菊芳,等.铵盐对红曲黄色素、红色素及桔霉素代谢合成的影响[J].重庆工学院学报:自然科学版,2009,23(1):46-53.
[14]周波,杨玲,崔思颖,等.响应面法提高红曲黄色素色调[J].华南理工大学学报:自然科学版,2008,36(11):91-95.
[15]周波,浦跃武,朱明军,等.氮源对红曲霉突变菌株产黄色素的影响[J].现代食品科技,2008,24(2):123-127.
[16]中华人民共和国国家标准.食品添加剂 红曲米[S].GB.4926-1985.
[17]Xu Ganrong,Chen Yun,Yu Huiling.HPLC fluorescence method for determination of citrinin from Monascus cultures[J].Archiv fur Lebensmittelhygiene,2003(4):82-84.
Effect of lactic acid and sodium lactic acid on the pigments and citrinin production by Monascus anka mutant
ZHOU Bo1,WU Ji-lin2,ZHU Ming-jun3,LIANG Shi-zhong3,ZHONG Hai-yan1,LIN Qin-lu1,*
(1.School of Food Science and Engineering,Central South University of Forestry and Technology,Changsha 410004,China;2.College of Resources and Planning Sciences,Jishou University,Zhangjiajie 427000,China;3.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
The effect of lactic acid and sodium lactic acid on Monascus pigments and citrinin production by Monascus anka mutant MYM2 were researched.The results indicated that lactic acid and sodium lactic acid were beneficial for Monascus pigments(including red and yellow pigments)production by Monascus anka mutant,the best addition concentration of lactic acid or sodium lactic acid for yellow pigments production was between 0.01mL and 0.05mL per 30mL cultures,but for red pigments production,it was between 0.05mL and 0.1mL per 30mL cultures.Lactic acid and lactic acid ion could be used as substrates for Monascus pigments production and growth of Monascua anka mutant MYM2.It was the pH of cultures established by the lactic acid or sodium lactic acid directly influenced the citrinin production by Monascus anka mutant MYM2.
lactic acid;sodium lactic acid;Monascus pigments;citrinin;Monascus anka mutant
TS201.3
A
1002-0306(2011)04-0185-04
2010-03-26 *通讯联系人
周波,男,研究方向:微生物发酵工程。
