低温果胶酶的纯化及酶的化及酶学性质的研究
2011-10-09王伟,李锋,张磊,茆军
王 伟,李 锋,张 磊,茆 军
(1.新疆农业大学食品科学学院,新疆乌鲁木齐830052;2.新疆农业大学化工学院,新疆乌鲁木齐830052;3.新疆农业大学教务处,新疆乌鲁木齐830052;4.新疆农业科学院微生物研究所,新疆乌鲁木齐830091)
低温果胶酶的纯化及酶的化及酶学性质的研究
王 伟1,李 锋2,张 磊3,茆 军4
(1.新疆农业大学食品科学学院,新疆乌鲁木齐830052;2.新疆农业大学化工学院,新疆乌鲁木齐830052;3.新疆农业大学教务处,新疆乌鲁木齐830052;4.新疆农业科学院微生物研究所,新疆乌鲁木齐830091)
进行了低温果胶酶产生菌的筛选,并对低温果胶酶的酶学性质、纯化及动力学常数进行了研究。结果表明:该酶最适酶反应温度25℃,最适酶反应pH为5.8;酶液的pH稳定范围在5~6.4;在25℃保温3h,酶活降至50.5%,在35℃保温2h,酶活降至55.1%,在45℃保温1.5h,酶活降至48.7%,在55℃保温1h,酶活降至43.1%;金属离子Mg2+、Ca2+、Mn2+、Zn2+、Fe2+、Na+对低温果胶酶有激活作用,而Ba2+、Hg2+、Cu2+、Fe3+、Pb2+对低温果胶酶有强烈的抑制作用;当以果胶为底物时,该酶的动力学常数Km为27.86mg/mL,Vmax为152.13μmol/(min·mL);采用不同的处理方法均可使低温果胶酶得到纯化,但40%~85%的硫酸铵分级沉淀纯化效果最好。
低温果胶酶,最适酶反应温度,最适酶反应pH,分离纯化
果胶,化学名聚半乳糖醛酸,主要是由D-半乳糖醛酸以α-1,4糖苷键连接形成的直链状聚合物,是植物体中一类复杂的胶体性多糖类,是植物细胞壁的组成成分,填充在植物的细胞壁之间,具有使细胞粘合在一起的作用[1]。果胶经果胶酶分解后,植物细胞便分离。果胶酶是分解果胶质的多种酶的总称,果胶酶可分为两大类:解聚酶和果胶酯酶[2-4]。果胶酶主要运用于果汁提取、果汁澄清、果酒澄清与过滤、果实脱皮、纺织工业麻类脱胶、畜牧业的饲料添加剂及中药营养液的深加工等。面对当今世界社会发展的重大问题(如粮食短缺、资源枯竭、生态环境恶化),本实验开展了低温果胶酶的研究,旨在利于节约能源,保护环境,并在降低生产成本等方面发挥积极作用。
1 材料与方法
1.1 材料与仪器
菌种 由实验室从采集的土样中分离得到;富集培养基 牛肉膏0.5%,NaCl 0.5%,K2HPO40.1%,KH2PO40.03%,橘皮粉2%,pH7;初筛平板培养基果胶0.1%,牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,K2HPO40.1%,KH2PO40.03%,琼脂2%,pH7;基础发酵培养基 橘皮粉2%,硫酸铵0.2%,酵母膏0.5%,K2HPO40.2%,MgSO40.2%,NaCl0.1%,MnSO40.00025%,FeSO40.00075%,pH7;种子培养基 麦芽膏0.3%,蛋白胨0.5%,酵母膏0.3%,葡萄糖1.0%,pH6.5。
541 7R型高速冷冻离心机,FA2104型电子天平,LDZX-40BI型高压灭菌锅,GKC型数显控温水浴锅,THZ-82恒温振荡器,SW-CJ-IC型超净工作台,DHG-9140A型恒温培养箱。
1.2 实验方法
1.2.1 技术路线 采样→富集培养→初筛→复筛→酶学特性研究
1.2.1.1 初筛 将富集培养液稀释涂布于初筛平板上,25℃培养6d左右,加1%(W/V)的十六烷基三甲基溴化铵,静置,菌落周围出现透明圈的为产果胶酶的菌株。
1.2.1.2 复筛 将初筛后得到的菌株接入液体种子培养基,摇瓶培养15h后接种于液体发酵培养基上,在温度为25℃,150r/min恒温振荡器培养96h,取粗酶液测定果胶酶活性。
1.2.1.3 酶活力的测定 依据文献[5],以Sigma公司的桔子果胶为底物,用次亚碘酸法定量测定,所生成的半乳糖醛酸量表示果胶酶的活力。酶活力的定义为:在pH5.8,25℃下,1h酶促化果胶分解生成1mg游离半乳糖醛酸所需的酶量定义为一个酶活性单位。
1.2.2 低温果胶酶酶学性质研究
1.2.2.1 低温果胶酶最适酶反应温度的测定 在pH为3.5的条件下,取不同温度,分别测定粗酶液的酶活力,确定最适酶反应温度。
1.2.2.2 低温果胶酶的温度稳定性 将酶液在不同温度下分别放置30min,在pH为3.5,温度为25℃的条件下,测定残余酶活力,确定酶活稳定温度范围。
1.2.2.3 低温果胶酶热稳定性 将酶液分别置于不同温度下,每隔30min测定残余酶活力,确定酶热稳定性曲线。
1.2.2.4 低温果胶酶的最适酶反应pH 分别配制不同pH的缓冲液,在25℃条件下,分别测定粗酶液的酶活力,确定最适酶反应pH。
1.2.2.5 低温果胶酶的稳定pH范围测定 用不同pH的缓冲液与粗酶液分别按4∶1体积混合,4℃保存12h。分别测定酶活力,确定最适酶反应pH范围。
1.2.2.6 金属离子对低温果胶酶酶活力的影响 将不同金属盐用pH为5.8的柠檬酸-柠檬酸纳缓冲液溶解,配制成物质量浓度为2mmol/L的含金属盐的缓冲液,在25℃分别测定粗酶液的活力。
1.2.2.7 低温果胶酶的动力学常数的测定[6]采用Lineweave-Burk双倒数法作图,求得Km与Vmax。
1.2.3 低温果胶酶粗酶液的纯化 将粗酶液分别采用硫酸铵一次沉淀法、SephadexG2-100凝胶过滤法和DEAE52-cellulose离子交换层析法进行分离纯化,并分别测定酶液中蛋白质的含量和酶活力。
2 结果与分析
2.1 果胶酶产生菌的筛选
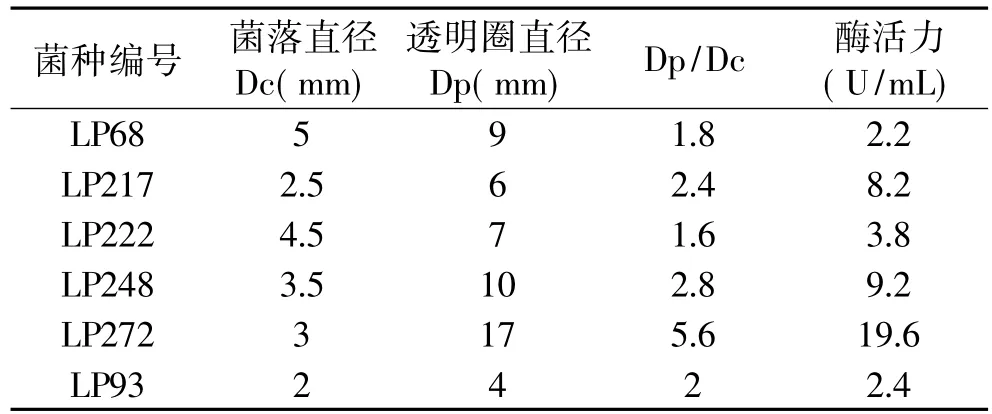
表1 低温果胶酶产生菌筛选结果
从采集的土样中经过富集培养、初筛,挑选在筛选平板上生长速度快并产生明显透明圈,且H/C(H为透明圈直径,C为菌落直径)大的菌株摇瓶发酵进行复筛。最后得到6株产酶特性较佳的菌株,其中一株生长较快,经反复培养产酶特性稳定,菌种定名为LP272,并以其为研究菌株进行果胶酶酶学特性的初步研究。
2.2 菌株LP272的生化鉴定
菌株LP272经生化鉴定仪鉴定后,结果如表2。

表2 菌株LP272生化鉴定结果
通过VITEK32自动鉴定仪测定,其结果为指甲隐球酵母(Cryptococcus nuiguttulatus)。
2.3 低温果胶酶酶学性质研究
2.3.1 低温果胶酶最适酶反应温度的测定 结果如图1。
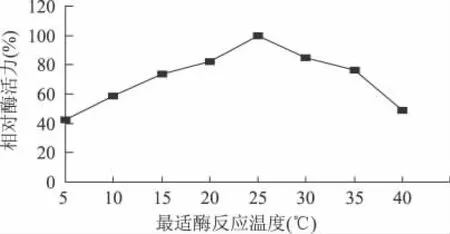
图1 最适酶反应温度曲线
由图1可知,菌株LP272所分泌的低温果胶酶的最适酶反应温度为25℃,且为低温果胶酶。该酶在不同温度下进行反应时,呈现出较为典型的钟形曲线。
2.3.2 低温果胶酶的温度稳定性 结果如图2。
由图2可知,菌株LP272所分泌的低温果胶酶在25℃以下保存时,酶活性变化不大。在30℃的条件下保存30min,酶活力仍然保留了95.2%,即使当温度达到50℃时,酶活性还保留了65%,这一现象说明菌株LP272所分泌的低温果胶酶对常温有一定的抵抗能力。
2.3.3 低温果胶酶的热稳定性 结果如图3。
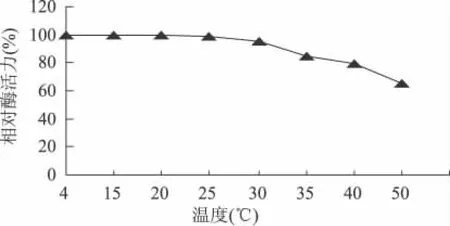
图2 酶的温度稳定性曲线

图3 酶的热稳定性曲线
由图3可知,菌株LP272所分泌的低温果胶酶,在25℃保温3h,酶活力降低至50.5%;35℃保温2h,酶活力降低至50.1%;45℃保温1.5h,酶活力降低至48.7%;55℃保温1h,酶活力降低至43.1%。
2.3.4 低温果胶酶最适酶反应pH的确定 结果如图4。
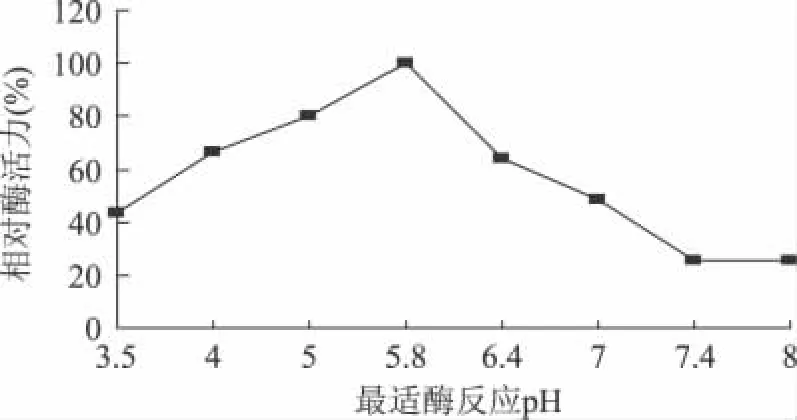
图4 最适酶反应pH曲线
由图4可知,菌株LP272所分泌的低温果胶酶在酶反应pH为5.8时酶活力最高。当pH小于5.8时,随着缓冲液酸性的减弱,酶活力逐渐变大;但当pH大于5.8时,酶活力显著减小,当缓冲液显碱性时,酶活力继续下降。2.3.5 低温果胶酶的稳定 pH范围测定 结果如图5。
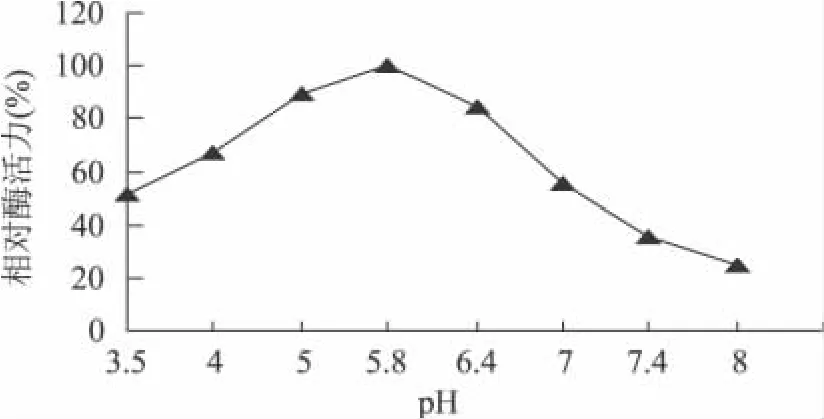
图5 酶的稳定pH范围曲线
由图5可知,菌株LP272所分泌的低温果胶酶pH稳定范围在pH5~6.4,当pH达到7.0时,酶活力保留了55.7%,pH达到8.0时,酶活力只保留了25.1%,说明碱性环境不利于低温果胶酶的保存。
2.3.6 金属离子对低温果胶酶酶活力的影响 结果如图6。
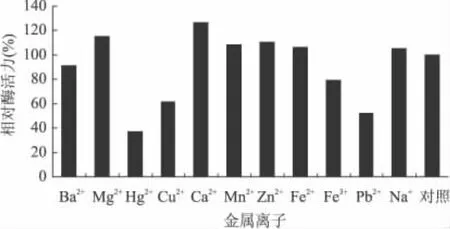
图6 金属离子对酶活力的影响
由图 6可知,Mg2+、Ca2+、Mn2+、Zn2+、Fe2+、Na+对低温果胶酶有激活作用,其作用大小的顺序为Ca2+> Mg2+>Zn2+>Mn2+>Fe2+>Na+,而 Ba2+、Hg2+、Cu2+、Fe3+、Pb2+对低温果胶酶有强烈的抑制作用,其作用大小的顺序为Hg2+>Pb2+>Cu2+>Fe3+>Ba2+。
2.3.7 低温果胶酶的动力学常数 将果胶分别配制成浓度为5、10、15、20、30mg/mL,在25℃、pH5.8的条件下,测定酶活力,利用Lineweave-Burk双倒数法作图求出低温果胶酶的动力学常数,结果如图7。
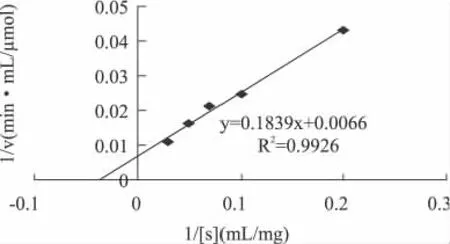
图7 以果胶为底物的Lineweave-Burk图
利用公式:1/V=1/Vmax+(Km/Vmax)·(1/[S]),求出低温果胶酶的动力学常数,当以果胶为底物时,Km为27.86mg/mL,Vmax为152.13μmol/(min·mL)。2.3.8 低温果胶酶的分离纯化 结果如表3。
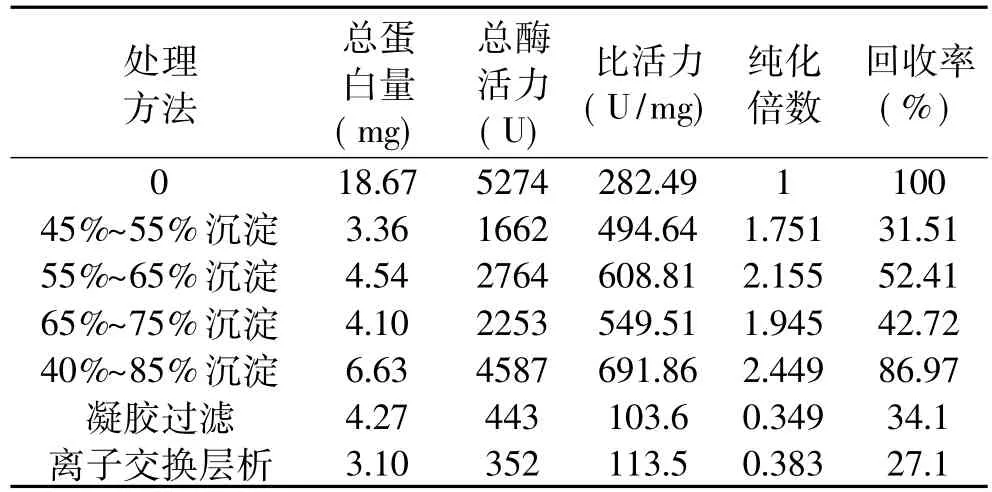
表3 分离纯化结果
由表3可知,采用不同的处理方法均使低温果胶酶得到纯化。但综合纯化倍数、比活力及回收率三项指标,40%~85%的硫酸铵分级沉淀纯化效果最好,纯化倍数为2.449倍,比活力为691.86U/mg,回收率为86.97%。
3 结论
从采集的土样中筛选到一株产低温果胶酶的菌株LP272,经鉴定该菌属于指甲隐球酵母。其产生的低温果胶酶最适酶反应温度为25℃,最适酶反应pH为pH5.8;粗酶液在25℃保温3h,酶活降至50.5%,在35℃保温2h,酶活降至50.1%,在45℃保温1.5h,酶活降至48.7%,在55℃保温1h,酶活降至43.1%;该酶的pH稳定范围在pH5~6.4;金属离子 Mg2+、Ca2+、Mn2+、Zn2+、Fe2+、Na+对低温果胶酶有激活作用,而Ba2+、Hg2+、Cu2+、Fe3+、Pb2+对低温果胶酶有强烈的抑制作用;当以果胶为底物时,该酶的动力学常数Km为27.86mg/mL,Vmax为152.13μmol/(min·mL);采用不同的处理方法均使低温果胶酶得到纯化,但40%~85%的硫酸铵分级沉淀纯化效果最好。
[1]郭爱莲,张红莲,冯琛.某些物质对细菌Xg-02果胶酶活性的影响[J].西北轻工业学院学报,2001,19(1):18-21.
[2]张树政.酶制剂工业(下)[M].北京:科学出版社,1984:625-634.
[3]江洁,刘晓兰,等.果胶酶活性分光光度测定方法的研究[J].齐齐哈尔大学学报,1998,14(1):63-66.
[4]Alkorta L,Garbisu G,Llama MJ,et al.Industrial application of pectic enzymes:a review[J].Process Biochem,1998,33:21-28.
[5]郭爱莲,王少辉,刘忠.产果胶酶芽孢杆菌Xg-01的分离、筛选及发酵条件的研究[J].西北大学学报:自然科学版,1997(2):53-56.
[6]Ullah A H J.Prep Biochem[J],1998,18:443-458.
Study on purification and characteristics of the cold adapted pectinase
WANG Wei1,LI Feng2,ZHANG Lei3,MAO Jun4
(1.College of Food Science,Xinjiang Agricultural University,Urumqi 830052,China;2.College of Chemical Engineering,Xinjiang Agricultural University,Urumqi 830052,China;3.Academic Affairs Office,Xinjiang Agricultural University,Urumqi 830052,China;4.Institute of Microbiology,Xinjiang Academy of Agricultural Science,Urumqi 830091,China)
The strain producing cold adapted pectinase was screened,and the characteristics of cold adapted pectinase,purification and kinetic constant were studied.The results showed that:the optimal temperature and pH for the enzyme reaction was 25℃ and 5.8,the enzyme was stable at pH5~6.4,after 3h at 25℃,the enzyme activity was 50.5%,at 35℃for 2h,the enzyme activity was 55.1%,at 45℃ for 1.5h,the enzyme activity was 48.7%,at 55℃ for 1h,the enzyme activity was 43.1%.The metal ion Mg2+,Ca2+,Mn2+,Zn2+,Fe2+,Na+enhanced the cold adapted pectinase activity,but the metal ion Ba2+,Hg2+,Cu2+,Fe3+,Pb2+inhibited the cold adapted pectinase activity strongly.The kinetic constant of the cold adapted pectinase was Km value 27.86mg/mL and Vmax 152.13μmol/(min·mL)when pectin(sigma)as a substrate.The cold adapted pectinase was purified by ammonium sulfate salted out and the optimal range of ammonium sulfate saturation was 40%~85%.
cold adapted pectinase;the optimal temperature for the enzyme reaction;the optimal pH for the enzyme reaction;purification
TS201.2+5
A
1002-0306(2011)04-0162-04
2009-10-10
王伟(1978-),男,讲师,研究方向:微生物发酵工程。
