坛紫菜藻红蛋白的规模化制备
2011-09-29李春霞严岱原倪静郭子叶蔡春尔何培民
李春霞,严岱原,倪静,郭子叶,蔡春尔,何培民
上海海洋大学 水产与生命学院,上海 201306
坛紫菜藻红蛋白的规模化制备
李春霞,严岱原,倪静,郭子叶,蔡春尔,何培民
上海海洋大学 水产与生命学院,上海 201306
为了优化坛紫菜粗提工艺以减轻纯化的压力,研究了我国主要经济红藻之一坛紫菜藻红蛋白大规模制备方法。实验采用“溶胀+组织捣碎”法破碎坛紫菜叶状体细胞,对比了多次硫酸铵梯度盐析对破碎液中藻红蛋白的影响,并进一步用羟基磷灰石层析制备藻红蛋白,最后对所得蛋白做了光谱和电泳鉴定。结果表明,经过 4次盐析,藻红蛋白吸收光谱纯度达到0.9 (A564/A280),每次的最佳盐析浓度分别为15%、50%、10%和40%;7 kg阴干紫菜经过4次盐析和1次羟基磷灰石层析后可获得507.82 mg藻红蛋白 (A564/A280>3.2),为进一步研究规模高效分离纯化藻红蛋白提供了参考。
坛紫菜,藻红蛋白,梯度盐析,羟基磷灰石层析
Abstract:We developed large-scale preparation of phycoerythrin from Porphyra haitanensis, a main economic red algae in China. Firstly, P. haitanensis thallus was broken by using “swelling and smash” method. Then times of grads ammonium sulfate precipitation applied to the crude extraction were compared. Desalted solution was further purified with one-step chromatography using hydroxyapatite and properties on spectrum and molecular weight were identified finally. The results indicated that after four times of ammonium sulfate precipitation (15%, 50%, 10% and 40%), the absorption spectrum purity of P. haitanensis achieved 0.9(A564/A280), and 507.82 mg phycoerythrin (A564/A280>3.2) was obtained from 7 kg fresh algae after further hydroxyapatite chromatography. This research provides a potential way for preparation of phycoerythrin in large sclae.
Keywords:Porphyra haitanensis, phycoerythrin, step-precipitation, hydroxyapatite chromatography
藻胆蛋白为藻类吸收、传递光能的天线色素, 存在于蓝藻、红藻、隐藻和甲藻中,包括藻红蛋白(PE)、藻蓝蛋白 (PC)、别藻蓝蛋白 (APC) 和藻红蓝蛋白 (PEC)[1]。藻胆蛋白颜色鲜艳,并具有抗癌、抗病毒、抗氧化、促进血细胞再生等功效,在食用天然色素、保健食品、生物化学、荧光免疫和细胞学实验检测试剂等方面应用广泛[2-4]。
藻胆蛋白制备的常规方法主要包括藻体破碎,蛋白粗提和蛋白纯化3个步骤[5],不同方法使用效果因原料而异[6],且纯化阶段成本高、时间长、产率低,是制约整个流程的瓶颈。广泛的应用价值和繁琐的制备工艺使得该类蛋白的价格一直居高不下[7]。
坛紫菜Porphyra haitanensis含有丰富的PE,又是我国最主要的栽培经济藻类之一,还是唯一原产自我国的紫菜。因此从坛紫菜中提取纯化PE,具有原料、价格上的优势。本研究旨在通过优化坛紫菜PE粗提工艺以减轻纯化的压力,并尝试大规模制备较高纯度的PE。
1 材料与方法
1.1 原料
坛紫菜叶状体于2010年1月采自我国3大紫菜产区之一福建省福鼎市。藻体用清洁海水洗净,10 ℃下阴干后,密封置于−20 ℃冰箱保存备用。
1.2 仪器与药品
Supra 22k高速冷冻离心机为Hanil Science公司产品;Ultrospec 2000紫外分光光度计为Pharmacia Biotech公司产品;EPS 601电泳仪为 Amersham Biosciences公司产品;F-4500荧光分光光度计为Hitachi公司产品。
常规化学药品 (试剂纯) 购自国药集团。
1.3 藻胆蛋白破碎液的制备
称取400 g冻干坛紫菜,加2 000 mL磷酸钠缓冲液 (pH 6.8,含1 mmol/L EDTA) 浸泡,4 ℃存放36 h,组织捣碎。捣碎液在4 ℃、10 000×g离心20 min,取上清,为藻胆蛋白破碎液。
1.4 硫酸铵第1次盐析
取藻胆蛋白破碎液75 mL,分3管,每管25 mL,分别加至15%、20%、25%饱和度。4 ℃静置8 h,10 000×g离心 20 min,取上清液测量体积和吸光值。确定最佳盐析饱和度,将剩余捣碎液用该饱和度盐析。
1.5 硫酸铵第2次盐析
取第1次盐析上清80 mL,分4管,每管20 mL,分别加至45%、50%、55%、60%饱和度。4 ℃静置8 h,10 000×g 离心20 min,沉淀用适量缓冲液溶解后测体积和吸光值。确定最佳盐析饱和度,将剩余第1次盐析液用该饱和度盐析。
1.6 硫酸铵第3次盐析
取第2次盐析溶解液60 mL,分3管,每管20 mL,分别加至5%、10%、15%饱和度。4 ℃静置8 h,10 000×g离心20 min,取上清液测量体积和吸光值。确定最佳盐析饱和度,将剩余第 2次盐析液用该饱和度盐析。
1.7 硫酸铵第4次盐析
取第3次盐析的上清80 mL,分4管,每管20 mL,分别加至35%、40%、45%、50%饱和度。4 ℃静置8 h,10 000×g离心20 min,取沉淀,沉淀用适量缓冲液溶解后测体积和吸光值。确定最佳盐析饱和度,将剩余第3次盐析液用该饱和度盐析。
1.8 坛紫菜藻红蛋白大规模制备
取7 kg阴干坛紫菜捣碎,参照上述盐析梯度制备盐析液,再用Sephadex G-25脱盐,上样于预平衡的自制羟基磷灰石层析柱,缓冲液梯度洗脱,洗脱液测纯度和产率。
1.9 坛紫菜藻红蛋白性质鉴定
对纯化所得的坛紫菜 PE进行光谱鉴定和电泳鉴定。光谱鉴定扫描了紫外吸收光谱和荧光发色光谱。用Native-PAGE和SDS-PAGE测定蛋白四级结构和三级结构的分子量,两种电泳均分别用醋酸锌和考马斯亮蓝染色。
1.10 蛋白纯度与含量计算方法
藻胆蛋白吸收光谱纯度计算参考 Siegelman等[8]的方法。
藻胆蛋白含量计算参考高洪峰等[9]的方法。
2 结果与分析
2.1 不同饱和度盐析结果
在不同的硫酸铵饱和度中,坛紫菜藻红蛋白的纯度和含量不同。第1次盐析中,当饱和度为15%时,PE的纯化效果最佳,纯度为0.29,得率为80%。第 2次盐析中,当饱和度为 50%时纯化效果最佳,PE纯度达到0.76,得率为74.%。第3次盐析中,当饱和度为10%时纯化效果最佳,PE的纯度为0.82,得率为95%。第4次盐析中,当饱和度为40%时纯化效果最佳,PE的纯度为0.93,得率为87%。4次盐析结果如图1~4所示。

图1 坛紫菜第1次盐析效果Fig. 1 Effect of 1st crude salting out.

图2 坛紫菜第2次盐析结果Fig. 2 Effect of 2nd crude salting out.
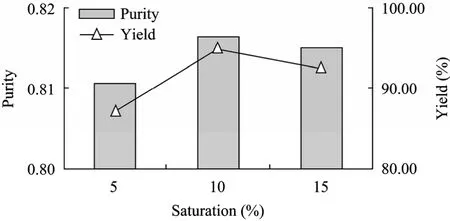
图3 坛紫菜第3次盐析结果Fig. 3 Effect of 3rd crude salting out.
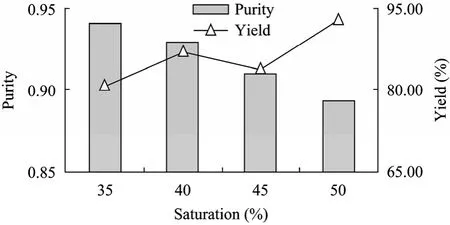
图4 坛紫菜第4次盐析结果Fig. 4 Effect of 4th crude salting out.
2.2 坛紫菜藻红蛋白大规模制备结果
7 kg阴干坛紫菜经过捣碎、多次盐析、脱盐、及一次层析后,得到508 mg PE (A564/A280>3.2)。随着纯化流程的进行,坛紫菜藻红蛋白的纯度依次上升,在一步羟基磷灰石层析后,藻红蛋白的纯度由层析前的0.95升高至3.65,得率由65%下降为10.6% (图 5)。

图5 新鲜坛紫菜纯化结果Fig. 5 Results of purification from fresh Porphyra haitanensis. 1: crude extract; 2−5: extract after 1st, 2nd, 3rd, 4th saltout, repectively; 6: extract after desalting; 7: purified PE after chromatography.
2.3 规模制备的藻红蛋白性质鉴定
层析所得坛紫菜PE的紫外吸收光谱中在497 nm和 566 nm处各有一个吸收峰 (λmax=566 nm),在538 nm处有一肩峰 (图6),是典型的R-PE吸收峰特征[10]。对坛紫菜PE进行荧光扫描,激发波波长介于300~600 nm (图7),其中用561 nm光激发时得到的发射波的峰值最大,此发射峰的波长为580 nm (图 8),是典型的 R-PE发射峰特征[11]。PE Native-PAGE显示蛋白的四级结构分子量约为120 kDa (图9 1a,1b),SDS-PAGE显示PE的三级结构含有两种亚基,分子量分别约为18 kDa和21 kDa(图9 2a,2b),推测为α亚基和β亚基。由于PE为α、β亚基的多聚体,即 (αβ)n,本实验所得PE的四级结构为 (αβ)3。

图6 坛紫菜PE吸收光谱Fig. 6 Absorption spectra of PE from Porphyra haitanensis.

图7 坛紫菜PE荧光扫描3D图谱Fig. 7 3D fluorescence spectrum of PE from Porphyra haitanensis. EX means exciting wavelength , and EM is equal to emission wavelength.
3 讨论
3.1 关于硫酸铵盐析的效果

图8 坛紫菜PE荧光发射图谱Fig. 8 Emission spectrum of PE from Porphyra haitanensis.EX means exciting wavelength , and EM is equal to emission wavelength.

图9 坛紫菜PE电泳鉴定图谱Fig. 9 Electrophoresis of PE from Porphyra haitanensis. The purified PE was examined by Native-PAGE and SDS-PAGE.(1a) Fluorescent bands of the R-PE chromophore-carrying subunits exhibited under ultraviolet light at 365 nm after the gel was stained with 0.2 mol/L zinc acetate in Native-PAGE. (1b)Polypeptide bands of the R-PE showed by Coomassie Blue G-250 staining in Native-PAGE. (2a) Bands after zinc acetate staining in SDS-PAGE. (2b) Bands after Coomassie Blue G-250 staining in SDS-PAGE.
为了减轻藻胆蛋白规模制备时纯化的压力,改进蛋白粗提工艺是方法之一。藻胆蛋白粗提制备中最常用的是硫酸铵盐析法。目前主要有3种:1) 一步沉淀法,如将红毛藻粗提液加至60%饱和度,得到纯度0.42的PE[12]。2) 分步沉淀法,如以新鲜蓝藻或红藻为对象,用25%、35%和60%饱和度分步沉淀出PE、PC和APC[8];但30%和50%饱和度无法将纯顶螺旋藻PC和APC分开[13]。3) 分段梯度盐析法,如以纯顶螺旋藻Sp (NS)-90020为对象,先用25%饱和度沉淀杂质,再以55%沉淀目标蛋白,沉淀溶解后逐渐缩小硫酸铵浓度区域。经过 9次盐析,PC纯度达到3.7,而APC纯度为1.1[14]。本实验结果显示,前2种方法无法得到较高纯度的PE粗提液 (图1,2)。第3种方法盐析次数太多,不仅费时费力,且其中28%~32%和35%~48%盐析段过于狭窄,不易把握。
本实验经过 4次硫酸铵盐析后,粗提液中 PE的纯度由破碎液中的 0.29提高为 0.93,产率降为49%。该方法是对盐析次数和盐析药品用量的平衡,既提高了纯度,保证了得率,又降低了人力和经济成本。
3.2 关于坛紫菜藻红蛋白规模纯化
对于藻胆蛋白规模纯化前人有不少研究,如采用 DEAE琼脂糖凝胶层析纯化 550 g铜绿微囊藻Microcystis aeruginosa得到33 g纯度3.4的PC和2.3 g纯度4的APC[15],采用疏水层析纯化700 g龙须菜 Gracilaria verrucosa得到 98 mg纯度 4.4的PE[16],纯化550 g掌状红皮藻Palmaria palmata得到67 mg纯度3.5的PE[17],可见不同的原料其产率相差很大。
而坛紫菜的规模提纯却未见报道,本实验采用7 000 g新鲜坛紫菜在纯化时只过一次羟基磷灰石柱即可获得508 mg纯度大于3.2的PE,省时省力。且HA的成本低,适合放大。
3.3 本方法的社会、生态效益和应用前景
目前虽然海洋经济在中国国民经济中的地位不断上升,但海边的渔民却面临渔业资源日趋衰竭、转产转业困难等问题。而坛紫菜PE生产规模的扩大需要原料的大量供应,这为海边的紫菜养殖户开辟了新的市场渠道,有利于提高农民收入。紫菜养殖不仅可为渔民带来效益,也有利于净化海区环境。条斑紫菜治理海区富营养化的实验证明紫菜养殖可大量去除氮、磷元素[18],栽培期间规模化文蛤养殖未发生死亡现象,表明紫菜栽培去富营养化作用和生态修复功能十分明显。
由于使用了廉价的经济海藻作为原料 (坛紫菜市价6元/kg),简单和低成本的粗提工艺 (硫酸铵市价 16元/kg),自制的层析填料 (HA),加之较高的蛋白产率和纯度,使得本方法具有较高的经济效益及规模可持续扩大的潜力。因此使用本方法能够在生产出高附加值藻胆蛋白的同时,也能为海区的渔民提供就业渠道,还能为治理海区的污染作出贡献,兼经济、社会、生态效益于一体。
致谢:感谢上海海洋大学严兴洪老师提供的坛紫菜。
REFERENCES
[1] Liu LN, Chen XL, Zhang XY, et al. One-step chromatography method for efficient separation and purification of R-phycoerythrin from Polysiphonia urceolata. J Biotechnol, 2005, 116(1): 91−100.
[2] Benedetti S, Benvenuti F, Pagliarani S, et al. Antioxidant properties of a novel phycocyanin extract from the blue-green alga Aphanizomenon flos-aquae. Life Sci,2004, 75(19): 2353−2362.
[3] Nagaoka S, Shimizu K, Kaneko H, et al. A novel protein C-phycocyanin plays a crucial role in the hypocholesterolemic action of Spirulina platensis concentrate in rats. J Nutr, 2005, 135(10): 2425−2430.
[4] Shih CM, Cheng SN, Wong CS, et al. Antiinflammatory and antihyperalgesic activity of C-phycocyanin. Anesth Analg, 2009, 108(4): 1303−1310.
[5] Sun L, Wang SM, Gong XQ, et al. Isolation, purification and characteristics of R-phycoerythrin from a marine macroalga Heterosiphonia japonica. Protein Expres Purif,2009, 64(2): 146−154.
[6] Ranjitha K, Kaushik BD. Purification of phycobiliproteins from Nostoc muscorum. J Sci Indus Res, 2005, 64(5):372−375.
[7] Sekar S, Chandramohan M. Phycobiliproteins as a commodity: trends in applied research, patents and commercialization. J Appl Phycol, 2008, 20(2): 113−136.
[8] Siegelman HW, Kycia JH. Algal biliproteins//Hellebust JA, Craigie JS, eds. Handbook of Phycological Method.HKJ: Cambridge University Press, 1978.
[9] Gao HF. The variation in the contents of phycobiliproteins from Porphyra haitanensi collected in different growing stages. Oceanol Limnol Sin, 1993, 24(6): 645−648.
高洪峰. 不同生长期坛紫菜中藻胆蛋白的含量变化. 海洋与湖沼, 1993, 24(6): 645−648.
[10] Wang GC, Zhou BC, Zeng CK. Isolation, properties and spatial site analysis of γ subunits of B-phycoerythrin and R-phycoerythrin. Sci Chin Ser C: Life Sci, 1998, 41(1):9−17.
[11] Grabowski J, Gantt E. Photophysical properties of phycobiliproteins from phycobilisomes: fluorescence lifetimes, quantum yields, and polarization spectra.Photochem Photobiol, 1978, 28(1): 39−45.
[12] Zheng J, Gao YH, Wang WX, et al. Studies on crude extraction methods of phycoerythrin from Bangia fusco-purpurea and denaturalization mechanism of phycobiliprotein in different irradiation conditions. J Xiamen Univer : Nat Sci, 2003, 42(1): 117−122.
郑江, 高亚辉, 王文星, 等. 红毛藻藻红蛋白的粗提方法比较及不同光照条件下藻胆蛋白变性机制的初步探讨. 厦门大学学报: 自然科学版, 2003, 42(1): 117−122.
[13] Peng WM, Shang ST, Liu GQ, et al. Extraction of phycobiliprotein from Sp.-D. J Food Sci, 1999, 20(6):48−49.
彭卫民, 商树田, 刘国琴, 等. 钝顶螺旋藻 (Sp.-D) 藻胆蛋白的提取. 食品科学, 1999, 20(6): 48−49.
[14] Hu YB, Hu HJ, Li YG, et al. Study on mass production of phycobilins from PC rich strain of Spirulina platensis. J Wuhan Botan Res, 2002, 20(4): 299−302.
胡一兵, 胡鸿钧, 李夜光, 等. 从一种富含藻胆蛋白的螺旋藻中大量提取和纯化藻蓝蛋白的研究. 武汉植物学研究, 2002, 20(4): 299−302.
[15] Padgett MP, Krogmann DW. Large scale preparation of pure phycobiliproteins. Photosynth Res, 1987, 11(3):225−235.
[16] Wang GC. Isolation and purification of phycoerythrin from red alga Gracilaria verrucosa by expanded-bedadsorption and ion-exchange chromatography.Chromatographia, 2002, 56(7/8): 509−513.
[17] Wang GC, Sun HB, Fan X, et al. Large-scale isolation and purification of R-phycoerythrin from red alga Palmaria palmata using the expanded bed adsorption method. Acta Botan Sin, 2002, 44(5): 541−546.
[18] He PM, Xu SN, Zhang HY, et al. Bioremediation efficiency in the removal of dissolved inorganic nutrients by the red seaweed, Porphyra yezoensis, cultivated in the open sea. Water Res, 2008, 42(4/5): 1281−1289.谱法. 计量与测试技术, 2005, 32(7): 46.
[13] Cheng HR, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts. Biotechnol Lett, 2006, 28(1):55−59.
[14] Zhang HY, Shen NK, Zhou X. Gene knockout tech nology and its application in microbial breeding. Liquor-Making Sci Technol, 2010, 4: 21−25.
张红岩, 申乃坤, 周兴. 基因敲除及其在微生物育种中的应用. 酿酒科技, 2010, 4: 21−25.
[15] He DQ, Xiao DG, Lv Y. Cre-LoxP System-mediated gene recombination and it’s application in yeast. China Biotechnol, 2008, 28(6): 46−49.
和东芹, 肖冬光, 吕烨, Cre-LoxP系统介导的基因重组及其在酵母中的应用. 中国生物工程杂志, 2008, 28(6):46−49.
[16] Zhang YP, Du CY, Huang ZH, et al. Effect of aldehyde dehydrogenase gene knockout on 1,3-propanediol production by Klebsiella pneumoniae. J Chem Ind Eng,2006, 57(11): 2686−2692.
张延平, 杜晨宇, 黄志华, 等. 醛脱氢酶基因敲除对克氏肺炎杆菌合成 1,3-丙二醇的影响. 化工学报, 2006,57(11): 2686−2692.
[17] Wang YC, Qin JC, Wang AQ, et al. Construction and functional analysis of the MNN9 gene disruption mutant in Aspergillus niger. Mycosystema, 2006, 25(1): 70−76.
王永超, 秦浚川, 王敖全, 等. 黑曲霉 MNN9基因缺失株的构建及其功能分析. 菌物学报, 2006, 25(1): 70−76.
[18] Winzeler EA, Liang H, Shoemaker DD, et al. functional analysis of the yeast genome by precise deletion and parallel phenotypic characterization. Novartis Found Symp, 2000, 229: 105−111.
[19] Aon MA, Cortassa S. Catabolite repression mutants of Saccharomyces cerevisiae show altered fermentative metabolism as well as cell cycle behavior in glucose-limited chemostat cultures. Biotechnol Bioeng,1998, 59(2): 203−213.
[20] Lin SS, Manchester JK, Gordon JI. Enhanced gluconeogenesis and increased energy storage as hallmarks of aging in Saccharomyces cerevisiae. J Biol Chem, 2001. 276(38): 36000−36007.
[21] McCartney RR, Schmidt MC. Regulation of Snf1 kinase. J Biol Chem, 2001, 276(39): 36460−36466.
[22] Maestre O, García-Martinez T, Peinado RA, et al. Effects of ADH2 overexpression in Saccharomyces bayanus during alcoholic fermentation. Appl Environ Microbiol,2008, 74(3): 702−707.
Scale-up preparation of phycoerythrin from Porphyra haitanensis
Chunxia Li, Daiyuan Yan, Jing Ni, Ziye Guo, Chun’er Cai, and Peimin He
Aqual-life Science and Technology College, Shanghai Ocean University, Shanghai 201306, China
Received: June 23, 2010; Accepted: October 18, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (Nos. 2006AA10Z323, 2007AA09Z406),Shanghai Education Commission Key Discipline Program (No. S30701).
Corresponding author: Peimin He. Tel: +86-21-61900423; E-mail: pmhe@shou.edu.cn
国家高技术研究发展计划 (863计划) (Nos. 2006AA10Z323, 2007AA09Z406),上海市教委优势 (重点) 学科项目 (No. S30701) 资助。
