乙酸分级预处理甘蔗渣对纤维素酶解性能的影响
2011-09-29赵雪冰刘德华
赵雪冰,刘德华
清华大学化学工程系应用化学研究所,北京 100084
乙酸分级预处理甘蔗渣对纤维素酶解性能的影响
赵雪冰,刘德华
清华大学化学工程系应用化学研究所,北京 100084
为提高甘蔗渣的纤维素酶解性能,采用乙酸脱木素结合碱脱乙酰基的预处理工艺 (Acetoline工艺) 对甘蔗渣进行预处理,考察了乙酸脱木素过程中若干因素对预处理结果的影响,并对预处理后甘蔗渣的纤维素酶解性能进行了研究。结果表明,经过Acetoline预处理后甘蔗渣在7.5%固体含量、15 FPU+10 CBU/g固体的纤维素酶和β-葡萄糖苷酶用量下酶解48 h,酶解聚糖转化率接近80%。与稀酸预处理相比,Acetoline预处理可以得到更高的酶解聚糖转化率。实验结果表明Acetoline工艺是一种可有效提高甘蔗渣纤维素酶解性能的预处理方法。
木质纤维素,预处理,酶解性能,脱木素,脱乙酰基
Abstract:During the bioconversion of lignocellulose to ethanol, the biomass always undergoes pretreatment in order to increase the enzymatic digestibility of cellulose. In present work, we conducted the pretreatment of sugarcane bagasse with aqueous acetic acid for delignification and alkali for deacetylation respectively (Acetoline process) to increase cellulose accessibility for enzymatic hydrolysis. The effects of several factors on the pretreatment effectiveness were investigated. The enzymatic digestibility of pretreated bagasse was further studied. The enzymatic glycan conversion of pretreated solid reached about 80% when it was digested under 7.5% solid consistency with cellulase of 15 FPU/g solid and β-glucosidase of 10 CBU/g solid for 48 h. Compared with dilute acid pretreatment, Acetoline pretreatment could obtain higher enzymatic glycan conversion. The experimental results indicate that Acetoline is an effective pretreatment method to increase the enzymatic digestibility of sugarcane bagasse.
Keywords:lignocellulose, pretreatment, enzymatic digestibility, delignification, deacetylation
近年来,从木质纤维素生物转化生产燃料乙醇的研究与开发受到了世界各国的广泛关注。这一方面是由于乙醇与汽油混合后可提高汽油的辛烷值和含氧量,使得汽油能够更加完全地燃烧,从而减少颗粒污染物及CO等气体的排放[1]。另一方面是由于乙醇不仅可以由淀粉质原料发酵生产,还可以由来源广泛且价格低廉的木质纤维素生产。据估计,地球上每年光合作用的产物 (生物质) 高达1 500~2 000亿t,是地球上唯一可超大规模再生的实物性资源[2]。同时,全生命周期分析表明纤维素乙醇生产可以显著降低 CO2的净排放量[3]。但由于木质纤维素的致密性和木质化结构阻碍了纤维素的酶催化水解。因此,将其进行酶解之前需要进行预处理以提高纤维素的酶解性能。目前人们已开发了多种预处理工艺,包括物理法、化学法、物理-化学法和生物法[4-7],这些方法各有优缺点。从综合利用木质纤维素各组分出发,有机溶剂预处理为木质纤维素的组分分离和高值化利用提供了一个很好的途径[8]。有机溶剂预处理即是采用有机溶剂或其水溶液,在添加或不添加催化剂的前提下于一定温度和压力下对木质纤维素进行处理,其可获得易于酶解的纤维素固体、半纤维素水解产物以及较高纯度的木质素产品[8]。该预处理过程同时也是木质纤维素组分分离的过程,即所谓的分级预处理。在众多的有机溶剂中,乙酸是可用于脱木素的最有前景的有机溶剂之一。这主要是由于乙酸预处理具有如下优点:1) 乙酸是木素的良好溶剂,对于木素具有较高的溶解度;2) 乙酸预处理可以在常压下进行;3) 乙酸可通过蒸馏回收并循环使用;4) 预处理过程中半纤维素脱乙酰基产生的乙酸可作为溶剂损失的补充;5) 乙酸木素易于从黑液中回收。因此,已有不少文献报道了采用乙酸水溶液进行木质纤维素制浆或组分分离的研究工作[9-11],但以采用乙酸来预处理木质纤维素的过程却鲜有报道。这主要是因为乙酸预处理过程中会导致纤维素乙酰化,从而抑制了纤维素的酶解反应[12]。本实验室已开发了基于乙酸脱木素和碱处理脱乙酰基的预处理工艺(Acetoline工艺),该工艺可以有效提高纤维素的酶解性能[13]。本文的目的即是考察基于乙酸脱木素的预处理过程中各因素对木素脱除率、聚糖水解率、乙酰基含量等目标响应变量的影响,并对预处理后的纤维素固体进行酶解性能测试。
1 材料与方法
1.1 实验材料
实验所用木质纤维素为甘蔗渣,产自广西南宁市。甘蔗渣经风干后筛分除去蔗髓,取不能通过20目筛孔的部分进行实验研究。经分析,其葡聚糖、木聚糖、阿拉伯糖基、乙酰基、克拉森木素、酸溶木素和灰分含量分别为40.48%、26.41%、1.17%、5.30%、22.64%、1.47%和 1.38%。所用纤维素酶为诺维信公司生产的Celluclast 1.5 L,经测定其纤维素酶活为38.5 FPU/mL。酶解过程中添加的β-葡萄糖苷酶亦为诺维信公司生产,其酶活为240 CBU/mL。所用化学试剂主要包括冰醋酸和98%硫酸,均为市售分析纯。
1.2 预处理过程
乙酸脱木素过程在带有机械搅拌的1 000 mL三口烧瓶中进行,其中一口与开口冷凝管相连。称取30 g蔗渣置于烧瓶中,加入300 mL含有0.1~0.3 wt%硫酸的乙酸水溶液 (乙酸浓度为60%~90%),然后将烧瓶置于电热套中加热至沸点反应1~3 h后停止加热,过滤除去黑液。为避免或减少溶解木素的二次沉淀并沉积在纤维表面,所得固体先采用相同浓度的乙酸溶液进行洗涤,过滤后再用自来水洗涤至中性。当需要进行乙酰基脱除反应时,向洗涤后的固体中添加一定量的碱,搅拌均匀后于一定温度下处理一定时间。为区别脱乙酰基的碱处理步骤,将乙酸脱木素步骤称为“乙酸处理”,而整个预处理过程即称为Acetoline预处理。
作为比较的稀酸预处理过程在5 L 316不锈钢高压釜中进行,预处理条件为:1%硫酸,10∶1液固比 (L/kg),160 ℃下保温30 min,升温和降温总时间为1.5 h。
1.3 预处理后纤维素固体的酶解
乙酸处理及Acetoline预处理后纤维素固体的酶解性能测试在50 mL三角瓶中进行。一定量的纤维素固体置于三角瓶内,加入一定体积含有纤维素酶的pH 4.8醋酸缓冲液,置于50 ℃、130 r/min的摇床中酶解120 h。纤维素酶的用量为5~40 FPU/g固体,β-葡萄糖苷酶的添加量为5~40 CBU/g固体。预处理后纤维素固体的酶解性能以酶解聚糖转化率(EGC,%) 表征,其定义为:

其中,酶解产生的还原糖以纤维二糖、葡萄糖和木糖之和计。
1.4 分析方法
甘蔗渣和处理后固体中的主要成分根据美国可再生能源实验室的方法进行测定[14]。纤维素酶酶活根据 Ghose的方法测定[15],但以 HPLC代替 DNS法来测定还原糖浓度。所用HPLC仪器为日本岛津公司生产,色谱柱为 Aminex HPX-87H柱 (美国Bio-Rad 公司生产),分析条件为:5 mmol/L H2SO4为流动相,0.8 mL/min流速,柱温65 ℃,差示折光检测器。
2 结果与分析
2.1 乙酸处理正交实验
为考察乙酸浓度 (CAcH)、催化剂硫酸浓度 (CSA)和反应时间 (t) 对乙酸处理中固体得率 (SY)、葡聚糖水解率 (GH)、木聚糖水解率 (XH)、木素含量(LC)、木素脱除率 (DD)、乙酰基含量 (AC) 以及酶解聚糖转化率 (EGC) 的影响,以 L9(34) 正交表安排实验,测定了不同因素水平组合下的响应变量值,结果如表 1所示。其中反应温度为所用乙酸溶液的常压沸点 (~107 ℃),液固比为10∶1 (L/kg)。各因素对响应变量影响的水平趋势图见图 1。可知,随着乙酸浓度、硫酸浓度和反应时间增加,固体得率降低。固体得率的降低主要是由于聚糖水解以及木素脱除引起的。从图1B和1C可知,随着3个因素的水平值增加,葡聚糖水解率和木聚糖水解率均增加,但葡聚糖水解率显著低于木聚糖水解率。此外,处理后固体中葡聚糖的含量随着乙酸浓度、硫酸浓度和反应时间增加呈上升趋势,而木聚糖含量呈下降趋势。这是由于木聚糖更易于水解,同时加上木素的脱除使得葡聚糖得以“纯化”的缘故。随着此三因素水平值增加,乙酸处理后纤维素固体中的木素含量降低,相应的木素脱除率增加,表明增加乙酸浓度、硫酸浓度和反应时间有利于木素的脱除。方差分析结果表明,乙酸浓度和硫酸浓度对于木素脱除率有显著影响,而反应时间的影响不显著。实验中发现大部分木素的脱除主要发生在第 1小时内,即第 1小时为主体木素脱除阶段,木素脱除率随时间变化明显,而 1 h后为残余木素脱除阶段,木素脱除率随时间变化不明显。因此在所选的反应时间水平范围 (1~3 h) 内反应时间对于木素脱除率无显著影响。进一步对因素间的相互作用进行分析知此三因素间的相互作用对木素脱除率无显著影响。从图1E可知,乙酰基含量随着硫酸浓度和反应时间增加呈降低趋势,但随着乙酸浓度增加呈显著上升趋势,表明乙酸浓度是影响纤维素发生乙酰化反应最为显著的因素。但与甘蔗渣原料相比,在所研究的条件下乙酸处理后固体的乙酰基含量均有所降低 (甘蔗渣中的乙酰基含量为5.30%)。这是因为半纤维素中含有乙酰基,而乙酰基在酸性环境下会发生水解。因此乙酸处理后固体中乙酰基含量的变化受到脱乙酰基反应和乙酰化反应的共同作用。而且纤维素发生明显乙酰化反应一般是在木素脱除率达到一定程度,纤维发生分离的时候才变得显著。因此,关于乙酸处理过程中乙酰基含量的变化还需要进一步进行动力学研究。但从正交实验结果来看,采用70%乙酸脱木素时,乙酰化反应不明显。而采用90%乙酸脱木素时可观察到明显的乙酰化现象,预处理后纤维素固体的乙酰基含量大于 4%。对于乙酸处理后固体的酶解性能,从图1F可知,随着乙酸浓度、硫酸浓度和反应时间增加,酶解聚糖转化率呈上升趋势,这主要是由于随着这些因素水平增加,木素脱除率随之增加的缘故。但由于乙酸处理过程会导致乙酰化的发生,因此并非木素脱除率最高时得到最高的酶解聚糖转化率。综合来看,以80%乙酸添加0.3%硫酸的条件下反应较为合适。

表1 乙酸处理的L9(34) 正交实验及结果Table 1 L9(34) experiments of acetic acid pretreatment
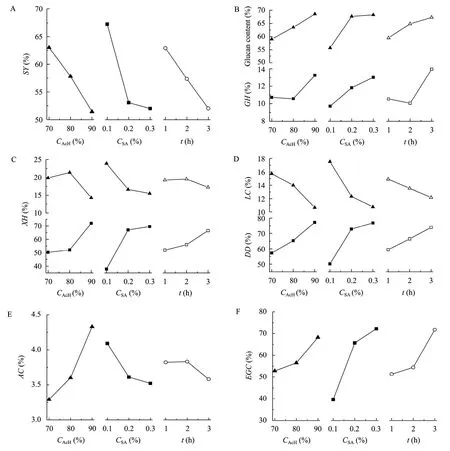
图1 乙酸处理甘蔗渣过程中各因素对响应变量影响的水平趋势图Fig. 1 Effects of several variables on acetic acid delignification of sugarcane bagasse. (A) SY. (B) Glucan content and GH. (C)Xylan content and XH. (D) LC and DD. (E) AC. (F) EGC (enzymatic hydrolysis condition: 20 FPU+40 CBU/g solid, 2.5% (g/100 mL)solid consistency). The abbreviations are the same as table 1.
可见,乙酸脱木素过程中提高乙酸浓度、催化剂用量和反应时间有利于木素脱除,但同时也增加了预处理过程中聚糖的水解率和预处理后纤维素固体的乙酰基含量。因此,如在乙酸处理后采用少量碱进一步处理以脱除乙酰基,可进一步提高纤维素的酶解性能。同时,采用碱处理脱除乙酰基可以避免其在同步糖化发酵过程中水解生成乙酸,进而抑制菌体生长。
2.2 乙酸处理后碱脱乙酰基对甘蔗渣纤维素酶解性能的影响
从前面正交实验的结果来看,乙酸处理过程中提高乙酸浓度有利于木素的脱除,但同时也增加了乙酰化反应的程度。Pan 等研究发现在木素含量相当 (约 18%) 时,乙酸制浆所得纸浆的酶解性能远低于乙醇制浆所得纸浆的酶解性能。其主要原因是乙酰基的存在会阻碍纤维素与纤维素酶结合位点间的氢键形成,从而阻碍纤维素酶中具有催化功能的结构域与纤维素之间的结合;此外,乙酰基的存在增加了纤维素的酶促反应空间位阻[12]。因此有必要对乙酸脱木素后的纤维素固体进行脱乙酰基处理。为比较乙酸处理过程中乙酸浓度对后续碱 (NaOH)处理的影响,我们考察了采用80%乙酸在常压沸点下脱木素 (A条件) 和 90%乙酸在常压沸点下脱木素 (B条件) 这两种情形时不同碱用量 (基于初始甘蔗渣重量) 的预处理,结果如表 2所示。可知,碱处理可以有效脱除乙酰基。当采用80%乙酸进行脱木素时,NaOH用量为2% (基于初始甘蔗渣重量)即可完全脱除乙酰基,而采用90%乙酸进行脱木素时,要完全脱除乙酰基,NaOH用量需提高至3% (基于初始甘蔗渣重量)。与对照样相比,碱处理后固体得率和木素含量有所降低,而葡聚糖和木聚糖含量有所增加。从纤维素固体的酶解性能来看,随着碱用量增加,初始酶解聚糖转化速率 (IEGCR) 和120 h的酶解聚糖转化率均显著提高。特别地,当第一步采用90%乙酸进行脱木素时,未经碱处理的样品初始酶解聚糖转化速率仅有 1.09%/h,而采用 4%NaOH处理后,初始酶解聚糖转化速率提高了9倍,相应的120 h酶解聚糖转化率提高了1.6倍。可见,乙酸处理后采用碱处理来脱除乙酰基可以有效提高聚糖酶解速率和转化率。因此,根据以上实验结果,Acetoline预处理甘蔗渣较为合适的条件为: 采用80% 乙酸,0.3%硫酸,10∶1液固比在常压沸点下处理2.0 h,进一步采用4% (基于初始甘蔗渣重量)的NaOH处理1 h,随后用清水洗至中性。
2.3 Acetoline预处理后纤维素固体的酶解性能测试
为进一步研究Acetoline预处理对甘蔗渣纤维素酶解性能的影响,对预处理后的纤维素固体酶解性能进行了更为详细地考察,从固体含量、纤维素酶用量及 β-葡萄糖苷酶用量等方面研究了酶解聚糖转化率与酶解时间的关系,结果如图2~4所示。
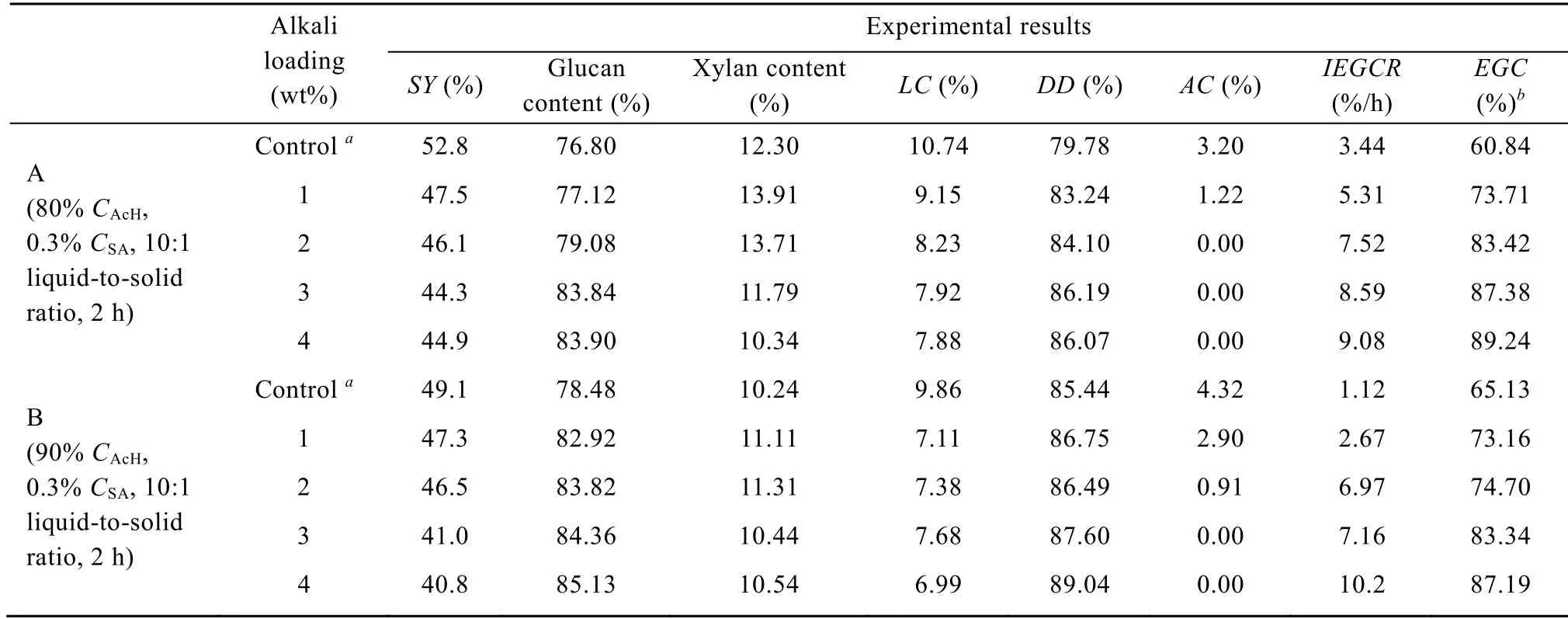
表2 乙酸处理后采用碱处理对预处理结果的影响Table 2 Effect of alkaline deacetylation after acetic acid delignification on pretreatment
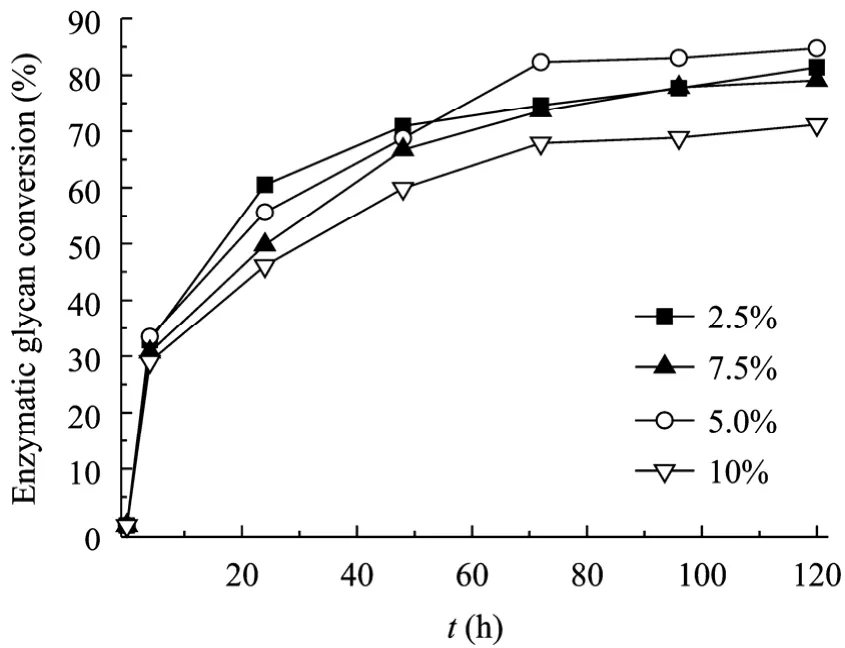
图2 固体含量对酶解聚糖转化率的影响Fig. 2 Effects of solid consistency on enzymatic glycan conversion. Other enzymatic hydrolysis condition: 20 FPU+40 CBU/g solid.
固体含量是影响酶解过程中液相可发酵糖浓度的重要因素。提高固体含量可以提高可发酵糖浓度,进而提高发酵产品,如乙醇的浓度,降低分离成本。但固体含量增加会增加搅拌能耗以及产物对酶解过程的抑制作用[16]。从图2可知,酶解时间小于24 h时,随着固体含量增加酶解聚糖转化率降低。而当酶解时间为120 h,固体含量小于7.5%时酶解聚糖转化率无明显区别,但固体含量提高至10%时,酶解聚糖转化率明显降低。Carrasco等研究汽爆预处理甘蔗渣酶解性能时也得到类似的结论[17]。比较酶解120 h后液相中的还原糖 (以纤维二糖、葡萄糖和木糖总和计) 浓度可知,固体含量为 2.5%、5%、7.5%和 10%时还原糖浓度分别为 21.4、43.6、61.6和74.9 g/L,相应的酶解聚糖转化率分别为81.4%、84.7%、79.1%和71.2%。可见,提高固体含量虽然酶解聚糖转化率有所降低,但可以显著提高液相还原糖的浓度。

图3 纤维素酶用量对酶解聚糖转化率的影响Fig. 3 Effects of cellulase loading on enzymatic glycan conversion. Other enzymatic hydrolysis condition: 7.5% solid consistency.
纤维素酶用量是影响聚糖转化速率和最终转化率的一个重要因素。增加纤维素酶用量可以显著提高酶解速率 (图3)。当纤维素酶用量为5 FPU/g固体时,酶解48 h和120 h仅分别得到35%和50%的聚糖转化率,而纤维素酶用量增加至20 FPU/g固体时,相同酶解时间下聚糖转化率分别提高至70%和80%。进一步将纤维素酶用量增加至30 FPU/g固体,酶解初速率显著提高,24 h后即可得到65%的聚糖转化率,但酶解120 h的聚糖转化率与纤维素酶用量为15 FPU/g固体时的相差不大。

图4 β-葡萄糖苷酶对酶解聚糖转化率的影响Fig. 4 Effects of β-glucosidase loading on enzymatic glycan conversion (other enzymatic hydrolysis condition: 7.5% solid consistency).
由于纤维素酶活性受到产物抑制,特别是纤维二糖的抑制作用最为强烈。其可结合在外切葡聚糖酶活性部位附近的色氨酸残基上形成“位阻效应”,从而阻止纤维素分子链进入活性中心[18]。因此,在纤维素酶解过程中往往添加一定量的 β-葡萄糖苷酶以加快纤维二糖转化为葡萄糖来消除其对外切葡聚糖酶的抑制作用。在酶解Acetoline预处理后的甘蔗渣过程中,添加一定量的 β-葡萄糖苷酶,结果如图4所示。可见添加10 CBU/g固体的β-葡萄糖苷酶与未添加时的结果相比,聚糖转化速率明显增加。当纤维素酶用量为10 FPU/g固体时,酶解24 h得到45%左右的转化率,而添加10 CBU/g固体的β-葡萄糖苷酶后,24 h的酶解聚糖转化率提高至60%。类似地,在较高纤维素酶用量下添加10 CBU/g固体的β-葡萄糖苷酶亦能有效提高聚糖转化速率,但继续增加 β-葡萄糖苷酶用量时酶解聚糖转化率并无明显增加。可见,对于Acetoline预处理后的甘蔗渣酶解,在7.5%固体含量时添加10 CBU/g固体的β-葡萄糖苷酶已经足够。
2.4 Acetoline预处理与稀酸预处理等方法比较
稀酸预处理木质纤维素是被人们所看好的最具有发展前景的预处理方法之一。我们进一步采用稀酸对甘蔗渣进行预处理,并与 Acetoline预处理进行比较,结果如图5所示。Acetoline预处理后甘蔗渣酶解48 h后可得到接近80%的总酶解聚糖转化率 (其中葡聚糖转化率为 74.2%,木聚糖转化率为89.1%),而稀酸预处理的总酶解聚糖转化率仅为50%左右 (其中葡聚糖转化率为 51.1%,木聚糖转化率为29.1%)。这主要是由于稀酸预处理过程虽然可以水解大部分的半纤维素,但仅有很少一部分木素溶解,绝大部分的木素仍残留在预处理后的固体中。这些木素在酶解过程中会不可逆地吸附纤维素酶,造成有效酶浓度降低,从而降低了酶解速率和转化率。根据实验结果,稀酸预处理后固体中木素含量增加至40.6%,而Acetoline预处理后固体中木素的含量仅为 7.88%。可见,脱除木素对于提高纤维素酶解性能是很有效的。与文献报道的预处理方法相比,Acetoline预处理亦可得到较好的酶解聚糖转化率。Martin 等研究了湿氧化法预处理对甘蔗渣酶解性能的影响。当甘蔗渣在初始pH为10.0,195 ℃下处理15min,可得到最好的预处理效果。所得纤维素固体在固体含量为 2%、纤维素酶用量为25 FPU/g固体、β-葡萄糖苷酶浓度为0.46 CBU/mL(对应23 CBU/g固体) 条件下水解48 h聚糖转化率为74.9%。而Acetoline预处理可以在更少的酶用量下得到更高的聚糖转化率,可见Acetoline预处理可以有效提高纤维素的酶解性能。
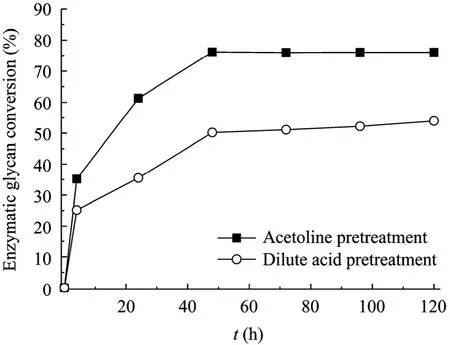
图 5 Acetoline预处理与稀酸预处理后甘蔗渣酶解聚糖转化率比较Fig. 5 Comparison of the enzymatic digestibility of Acetoline pretreated sample and dilute-acid pretreated sample (other enzymatic hydrolysis condition: 7.5% solid consistency).
此外,Acetoline预处理亦消耗了碱,而碱处理本身也是一种很好的提高纤维素酶解性能的预处理方法,其主要是通过脱除木素来提高纤维素可及性的[5]。但由于Acetoline预处理中采用碱处理的目的是脱除乙酸脱木素步骤中引入的乙酰基,而乙酰基的脱除较木素的脱除容易得多,因此Acetoline预处理中的碱用量明显低于碱处理中的量。当甘蔗渣仅采用20% (基于初始甘蔗渣重量) NaOH在121 ℃下处理1 h,所得纤维素固体在15 FPU/g固体的纤维素酶用量下酶解120 h可得到约70%的聚糖转化率[19],而碱用量降低至4% (基于初始甘蔗渣重量,与Acetoline中碱用量相同) 时酶解聚糖转化率仅为23%左右。可见,Acetoline预处理中先采用乙酸脱木素可以更为有效地提高纤维素的酶解转化率。另一方面,乙酸脱木素过程中可以将原料中近80%的木素抽提出来,这部分木素在后续的乙酸回收过程中可以以固体形式析出,即得到乙酸木素。与碱木素相比,乙酸木素由于具有更高的纯度,同时更易于改性而具有更高的附加值。而碱处理木质纤维素过程中,碱木素回收相对较为困难且木素纯度降低,因而限制了其改性和应用。
3 结论
基于乙酸脱木素、碱脱乙酰基的Acetoline预处理工艺可以有效提高甘蔗渣的纤维素酶解性能。乙酸处理脱除了大部分的木素,但也会不同程度造成纤维素的乙酰化。当采用 80%乙酸在添加 0.3%硫酸的条件下于常压沸点处理2.0 h,可得到80%的木素脱除率,但乙酰基含量高达3.2%。乙酸处理后的固体采用清水洗涤至中性后继续采用 4% (基于初始甘蔗渣重量) NaOH在120 ℃下处理1 h可以完全脱除乙酰基。与单独的乙酸处理相比,Acetoline预处理显著提高了聚糖的酶解速率及最终转化率。从固体含量、纤维素酶用量和β-葡萄糖苷酶添加量对预处理后甘蔗渣的酶解性能进行了研究,结果表明Acetoline预处理后甘蔗渣在 7.5%固体含量以及15 FPU+10 CBU/g固体的纤维素酶和β-葡萄糖苷酶用量下酶解48 h,酶解聚糖转化率接近80%,而经1%稀硫酸在160 ℃下处理30 min后的甘蔗渣在相同酶解条件下的聚糖转化率仅为50%左右。
REFERENCES
[1] Balat M, Balat H, Öz C. Progress in bioethanol processing.Progr Energ Combust Sci, 2008, 34(5): 551−573.
[2] Qu YB. Industrialization of cellulosic ethanol. Progr Chem, 2007, 19(7/8): 1098−1108.
曲音波. 纤维素乙醇产业化. 化学进展, 2007, 19(7/8):1098−1108.
[3] Farrell AE, Plevin RJ, Turner BT, et al. Ethanol can contribute to energy and environmental goals. Science,2006, 311(5760): 506−508.
[4] Sun Y, Cheng JY. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresour Technol, 2002,83(1): 1−11.
[5] Mosier N, Wyman C, Dale B, et al. Features of promising technologies for pretreatment of lignocellulosic biomass.Bioresour Technol, 2005, 96(6): 673−686.
上述规定反映出非全日制用工形式的突出特点是灵活性,因相应的劳动者可以随时工作、随时休息,所以,此类用工不适用年休假的相关规定。因此,按照法律规定,洪小芳无法享受跟其他员工一样的待遇,公司以此为由拒绝其要求不违反法律规定。
[6] Yang B, Wyman CE. Pretreatment: the key to unlocking low-cost cellulosic ethanol. Biofuel Bioprod Bior, 2008,2(1): 26−40.
[7] Alvira P, Tomás-Pejó E, Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review. Bioresour Technol, 2010, 101(13): 4851−4861.
[8] Zhao XB, Cheng KK, Liu DH. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl Microbiol Biotechnol, 2009, 82(5): 815−827.
[9] Pan XJ, SanoY. Acetic acid pulping of wheat straw under atmospheric pressure. J Wood Sci, 1999, 45(4): 319−325.
[10] Muurinen E. Organosolv pulping. A review and distillation study related to peroxiacid pulping [D]. Finland:University of Oulu, 2000.
[11] Pan XJ, Sano Y. Fractionation of wheat straw by atmospheric acetic acid process. Bioresour Technol, 2005,96(11): 1256−1263.
[12] Pan XJ, Gilkes N, Saddler JN. Effect of acetyl groups on enzymatic hydrolysis of cellulosic substrates.Holzforschung, 2006, 60(4): 398−401.
[13] Zhao XB, Liu DH. A method for pretreatment of lignocellulosic biomass: CN, 101864683 A, 2010-10-20.
赵雪冰, 刘德华. 一种木质纤维原料的预处理方法: CN,101864683 A, 2010-10-20.
[14] Sluiter A, Hames B, Ruiz R, et al. Determination of Structural Carbohydrates and Lignin in Biomass.Laboratory Analytical Procedure (LAP), National Renewable Energy Laboratory of the USA, 2008.
[15] Ghose TK. Measurement of cellulase activities. Pure Appl Chem, 1987, 59(2): 257−268.
[16] Cara C, Moya M, Ballesteros I, et al. Influence of solid loading on enzymatic hydrolysis of steam exploded or liquid hot water pretreated olive tree biomass. Process Biochem, 2007, 42(6): 1003−1009.
[17] Carrasco C, Baudel HM, Sendelius J, et al. SO2-catalyzed steam pretreatment and fermentation of enzymatically hydrolyzed sugarcane bagasse. Enzyme Microb Technol,2010, 46(2): 64−73.
[18] Zhao Y, Wu B, Yan BX, et al. Mechanism on the inhibition effect of cellobiose on exoglucanase. Sci China Series C:Life Sci, 2003, 33(5): 454−460.
赵越, 武彬, 阎伯旭, 等. 纤维二糖抑制外切纤维素酶水解作用机理的分析. 中国科学C辑: 生命科学, 2003,33(5): 454−460.
[19] Zhao XB, Peng F, Cheng KK, et al. Enhancement of the enzymatic digestibility of sugarcane bagasse by alkali−peracetic acid pretreatment. Enzyme Microb Technol, 2009, 44(1): 17−23.
Fractionating pretreatment of sugarcane bagasse for increasing the enzymatic digestibility of cellulose
Xuebing Zhao, and Dehua Liu
Institute of Applied Chemistry, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China
Received: November 20, 2010; Accepted: January 18, 2011
Supported by: International Cooperation Project of the Ministry of Science and Technology of China (No. 2010DFB40170), Tsinghua Research Funding (No. 2009THZ0223), National Basic Research Program of China (973 Program) (No. 2011CB707406).
Corresponding author: Xuebing Zhao. Tel/Fax: +86-10-62772130; E-mail: zhaoxb04@mails.tsinghua.edu.cn
科技部国际合作项目 (No. 2010DFB40170),清华自主研发项目 (No. 2009THZ0223),国家重点基础研究发展计划 (973计划) (No. 2011CB707406)资助。
