二苯基硫脲钴(Ⅲ)配合物的合成、表征及其与DNA的作用
2011-09-29曹丰璞丁呈华柳文敏冯玉全行文茹
曹丰璞 丁呈华 柳文敏 冯玉全 行文茹
(南阳师范学院化学与制药工程学院,南阳 473061)
二苯基硫脲钴(Ⅲ)配合物的合成、表征及其与DNA的作用
曹丰璞*丁呈华 柳文敏 冯玉全 行文茹
(南阳师范学院化学与制药工程学院,南阳 473061)
合成了二苯基硫脲钴(Ⅲ)配合物[Co(DPTU)3](DMF)3(DPTU=二苯基硫脲),通过IR和元素分析等手段对其进行了表征,并用X射线单晶衍射确定了其晶体结构。用电子吸收光谱、荧光光谱、粘度实验等方法研究了配体和配合物与DNA的相互作用。结果表明,配体和配合物与DNA的作用既存在插入作用又存在静电结合模式。
二苯基硫脲;钴配合物;DNA;插入作用;静电结合
近年来,小分子金属配合物与核酸等生物大分子相互作用的研究已引起人们的普遍关注,对于金属配合物与DNA作用时引发的化学和生物效应,一直是十分活跃的研究课题[1-5]。硫脲衍生物及其配合物是一类重要的化学试剂,已广泛应用于化学及化工生产的各个领域;硫脲及其配合物具有良好的生物活性,可以在药物化学中用于抗癌、抗菌剂的制备[6-7]。钴是人体内一种必要的微量元素,在生物体内均以配合物的形式存在。关于钴的配合物的研究在药理学、配位化学以及生物无机化学方面具有重要意义[8-9]。我们设计并合成了以二苯基硫脲为配体的钴配合物,并测定了其晶体结构,具有这种配体的钴配合物的晶体结构未见文献报道,利用吸收光谱实验、荧光光谱实验、粘度实验研究了配体、配合物与鲑鱼精DNA的作用。通过研究表明配合物与DNA之间存在着相互作用,为金属配合物在生物体内的药理作用提供初步的理论依据。
1 实验部分
1.1 仪器及试剂
Elementar Corporation Vario ELⅢ元素分析仪;Bruker ApexⅢ型X射线单晶衍射仪上;Thermo Nicolet 5700红外光谱仪;Perkin-Elmer Lambda 650s型紫外可见光谱仪;乌氏粘度计 (毛细管内径0.5~0.6 mm)。
鲑鱼精DNA,Sigma公司进口分装;二苯基硫脲、醋酸钴、N,N-二甲基甲酰胺(DMF)和其它试剂均为市售分析纯,使用前未经进一步纯化。实验用水为二次蒸馏水。
研究配体和配合物与DNA相互作用时,配体和配合物溶解在DMF中;DNA用5 mmol·L-1Tris-HCl,50 mmol·L-1NaCl(pH=7.2) 缓冲溶液配制,经UV 谱测定 A260/A280大于 1.8, 浓度以 ε260=6600 L·mol-1·cm-1确定。
1.2 标题配合物的合成
准确称取1 mmol二苯基硫脲溶于10 mL DMSO中,滴加 1 mmol Co(CH3COO)2·4H2O的无水乙醇10 mL,水浴加热,55℃下搅拌反应4.5 h有黑色浑浊出现,过滤,滤液中加入适量的DMF,在室温下缓慢挥发,1个月后得到紫黑色棒状单晶,它可直接用于X-射线衍射分析。按C48H54CoN9O3S3元素分析理论值(%):C 60.24,H 5.37,N 13.17;实测值(%):C 60.21,H 5.39,N 13.14。
1.3 配合物晶体结构测定
选取尺寸为 0.31 mm×0.25 mm×0.20 mm 的单晶样品,采用Bruker Smart ApexⅡCCD单晶衍射仪,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm),在 1.87°≤θ≤25°范围内,共收集衍射点12 058个,其中独立衍射点(Rint=0.031 2)8 350个,有5485个I>2σ的独立衍射点用于结构精修。全部数据经Lp校正和经验吸收校正,晶体结构由直接法解出,部分非氢原子坐标在以后的数论差值Fourier合成中陆续确定,全部非氢原子坐标及各向异性热参数用全矩阵最小二乘法修正。氢原子坐标通过理论加氢方法得到。所有计算均采用SHELXTL-97程序包在PC计算机上完成。有关晶体学数据详见表1。
CCDC:800751。

表1 标题配合物的晶体学数据Table 1 Crystallographic data of titled complex
1.4 Co配合物与DNA作用的实验方法
1.4.1 电子吸收光谱实验
在参比池中放2 mL DMF溶液,样品池放同样体积的配体或配合物溶液,测定配体或配合物的吸收光谱;用微量加样器每次往参比池和样品池加入相同体积的DNA溶液,测定吸收光谱。
1.4.2 荧光光谱实验
在样品池中加入2 mL的配体或配合物溶液,每次往样品池加入一定体积的DNA溶液,使DNA与配体或配合物的浓度比值不断增加,用适当激发光进行激发,测定配合物或配体的发射光谱。
1.4.3 DNA 的粘度实验
DNA 浓度固定为 1.16×10-4mol·L-1, 配体或配合物浓度依次增大,在25℃恒温水槽中用乌氏粘度计测其粘度。
2 结果与讨论
2.1 配体和配合物的表征
用Thermo Nicolet 5700红外光谱仪,采用KBr压片法,在400~4000 cm-1范围内测得配体和配合物的红外光谱,比较配体和配合物的红外谱图可以看出,配合物的振动吸收峰都有相应的移动。标题化合物中新出现的 2 923.4和 2 854.7 cm-1处的ν(CH3)的不对称和对称伸缩振动峰以及1665.1 cm-1处的ν(C=O)的伸缩振动峰,说明配合物中存在溶剂DMF。配体中1344.2和1314.8 cm-1处的ν(C=S)吸收峰在配合物中移至1 301.4 cm-1,同时配合物在539.4和469.5 cm-1出现的新峰可指认为ν(N-Co)和ν(S-Co),上述情况表明N-H中的N原子和C=S中的S原子参与了与金属离子的配位。红外光谱的分析结果与配合物的晶体结构分析结果一致。
配体和配合物的紫外可见光谱在Perkin-Elmer Lambda 650s型紫外可见光谱仪上测定,所采用的溶剂是分析纯的 DMF,配成 1.28×10-5mol·L-1的溶液,配体的吸收峰在280 nm,这来源于配体中苯环中的π→π*跃迁,配合物不仅在268 nm处有吸收,同时在可见区观察到两条弱的吸收可归之为八面体环境Co(Ⅲ)离子的d-d跃迁[10]。
2.2 晶体结构描述与讨论
配合物的单元结构见图1,主要键长和键角列于表2。从图1可以看出,该配合物的不对称单元由1个Co(Ⅲ)中心离子、3个二苯基硫脲配体和3个未参与配位的DMF组成。配合物以Co(Ⅲ)离子为中心形成配位多面体,在轴向位置与S3、N4配位,键长 分 别 为 0.227 22(13)nm(Co1-S3)、0.192 2(4)nm(Co1-N4), 在赤道平面上与 S1、N2、S2和 N6形成两短两长的配位键,两短键为Co1-N2 (0.193 6(4)nm)和Co1-N6(0.192 7(4)nm),两长键为Co1-S1(0.22511(14)nm)和 Co1-S2(0.22650(13)nm)。位于轴向位置的S3与处于赤道位置的S1、N2、S2和N6键角分别为 98.90(5)°(S1-Co1-S3)、93.35(12)°(N2-Co1-S3)、99.70(5)°(S2-Co1-S3)、71.37(11)°(N6-Co1-S3),这4个角均不同程度的偏离90°,位于轴向位置的N4与处于赤道位置的S1、N2、N6和S2键角分别 为 93.74(12)°(N4-Co1-S1)、97.54(15)°(N4-Co1-N2)、97.33(15)° (N4-Co1-N6)、71.43(10)°(N4-Co1-S2),键角情况与S3相似。3对位于对角位置与Co(Ⅲ)离子配位的原子的键角大小分别为165.39(11)°(N4-Co1-S3)、163.88(13)° (N2-Co1-S2)、166.19(11)°(N6-Co1-S1),比较接近180°。因此由以上数据可以看出金属配合物的几何构型为畸变八面体构型。

图1 配合物的不对称单元椭球图Fig.1 Asymmetric unit structure of complex
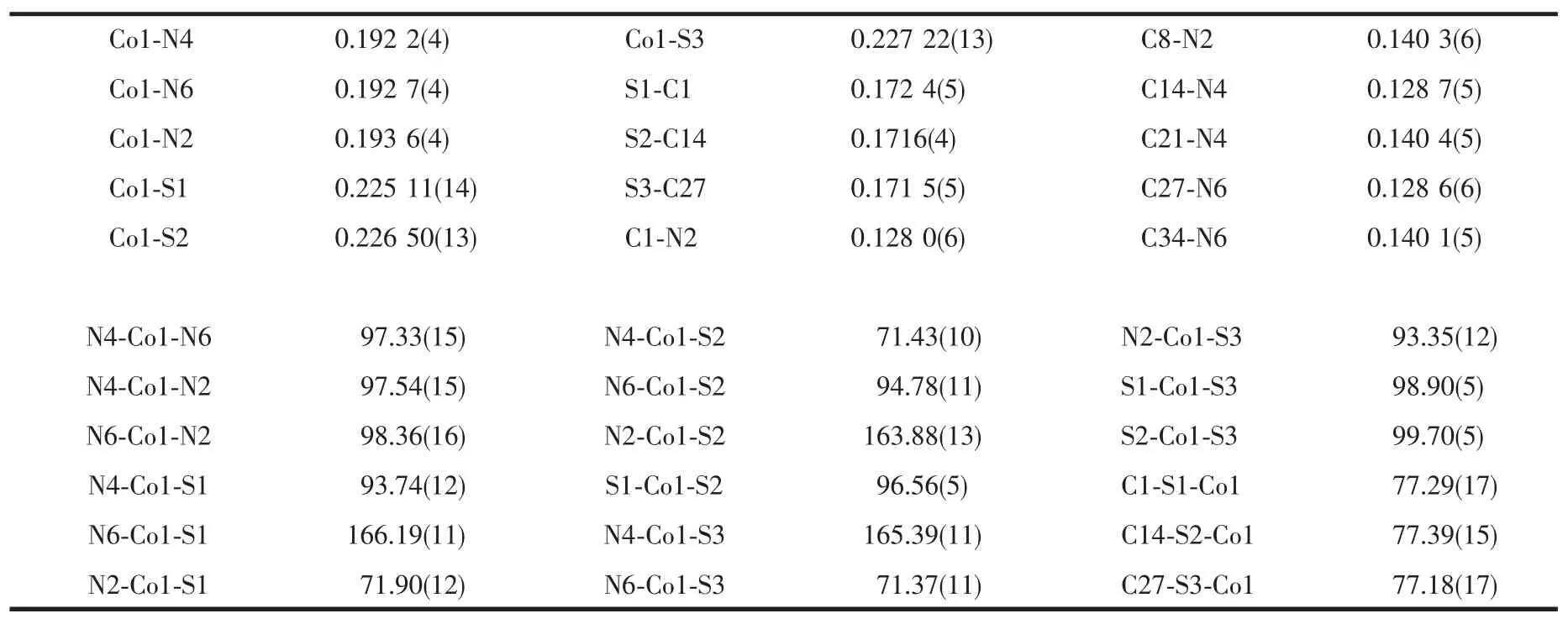
表2 配合物的主要键长和键角Table 2 Selected bond distance(nm)and bond angle(°)for complex
2.3 钴配合物与DNA的作用
2.3.1 吸收光谱实验
物质与DNA相互作用后会引起吸收光谱带红移(蓝移)效应、减色(增色)效应及谱带变宽,尤其以插入方式结合的分子变化会更大[11-13]。增色效应和减色效应是与DNA双螺旋结构和空间构型密切相关的特有光谱性质。增色效应是小分子与DNA碱基作用,DNA双螺旋结构改变的结果;而减色效应是小分子与DNA的磷酸基团静电作用,使DNA空间轴向收缩的结果[14-15]。从图2可以看出,配体的吸收光谱随DNA的加入,吸收峰伴随有增色现象;而配合物的吸收光谱(见图3)随DNA的加入变化情况与配体正好相反,吸收峰出现减色效应,但是红移效应不是很明显。这些结果表明:配体与DNA之间可能是由于静电作用,使DNA双螺旋结构破坏,发生解旋,从而产生增色效应;而配合物可能是以部分插入模式与DNA作用,使其π空轨道与碱基的π电子轨道发生偶合,偶合后的π轨道因部分填充电子,使跃迁几率减小,产生减色效应[16],但是π→π*跃迁能量并无减小,因为红移现象不明显,因此推测配合物与DNA插入结合作用较弱。

图2 不同浓度DNA条件下配体的吸收光谱Fig.2 Absorbption spectra of DPTU in various concentration of DNA

图3 不同浓度DNA条件下配合物的吸收光谱Fig.3 Absorbption spectra of complex in various concentration of DNA
2.3.2 荧光光谱实验
荧光法是研究配合物与DNA作用的比较灵敏的测试方法。配体在λex=290 nm的激发光谱中,在350 nm附近有一荧光峰,且该峰随DNA浓度的增加荧光强度增强。由此推测有可能是配体嵌入到了DNA双螺旋结构的碱基对之间,受到了DNA分子的保护,减少了溶剂分子对配体的碰撞所致[17]。配合物在λex=280 nm的激发光谱中,在338 nm处有一荧光峰,随着DNA浓度的增大该峰荧光强度减弱。这些特征表明:配合物可能以静电结合等方式与DNA作用,从而导致荧光强度下降。

图4 不同浓度DNA条件下配体的荧光光谱Fig.4 Flurescence spectra of DPTU in various concentration of DNA

图5 不同浓度DNA条件下配合物的荧光光谱Fig.5 Flurescence spectra of complex in various concentration of DNA
2.3.3 粘度实验
粘度测定是检测物质与DNA结合方式最有效的方法之一,粘度对分子长度变化非常敏感。当小分子配合物以插入模式与DNA作用时,DNA相邻碱基对的距离会增大以容纳插入的配体,从而导致DNA双螺旋伸长,DNA溶液的粘度增加;当配合物以静电或沟面结合等非插入模式与DNA作用时,DNA溶液的粘度无明显变化;以部分插入模式与DNA作用时,则可能使DNA的双螺旋扭结,使其分子粘度减小[18-19]。实验结果(图6)表明:配体与DNA作用后粘度有所增加,但是总体变化不是很大,说明配体与DNA之间的作用方式既有插入模式,又存在静电结合等非插入模式;而配合物与DNA作用后,其粘度先减小后略有增大,这说明配合物在高浓度下以静电作用为主和在低浓度下以部分插入作用为主的多种作用模式与鲑鱼精DNA发生键合作用。
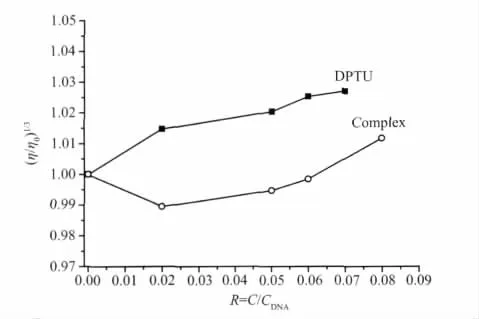
图6 配体或配合物对DNA粘度的影响Fig.6 Effect of DPTU or complex on the relative of DNA
3 结 论
合成了一种新的钴配合物,通过多种手段对其结构进行了表征。利用电子吸收光谱实验、荧光光谱实验和粘度实验研究了配体和配合物与DNA的相互作用,发现DNA的加入使配体吸收光谱发生增色效应,荧光强度增大,而使配合物吸收光谱发生减色效应,荧光强度减小;随着配体浓度的增大,DNA溶液粘度值略有增大,而随着配合物浓度的增大,DNA溶液粘度值先减小后增大,这些结果说明配体和配合物与DNA的作用是插入模式和静电结合模式并存。
[1]ZHU Li(朱莉),YU Xian-Yong(于贤勇),LONG Yun-Fei(龙云飞),et al.Acta Chim.Sinica(Huaxue Xuebao),2009,67(2):139-144
[2]ZHAO Na(赵娜),WANG Xing-Ming(王兴明),WANG Dan(王单),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(12):2129-2136
[3]O′Donoghue K A,Kelly J M,Kruger P E.Dalton Trans.,2004(1):13-15
[4]Hossain M D,Ueno R,Haga M.Inorg Chem.Comm.,2000(3):35-38
[5]GUO Mao-Lin(郭茂林),YANG Pin(杨频).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1995,16(7):1014-1015
[6]CHEN Ting(陈婷).Chinese J.China Sci.Technol.Inform.(Zhongguo Keji Xinxi),2005(17):21
[7]ZHANG You-Ming(张有明),YANG Li-Zi(杨莉梓),LIN Qi(林奇),et al.Acta Chim.Sinica(Huaxue Xuebao),2006,64(11):1200-1204
[8]YANG Hao(杨浩),LIU Jian-Chao(刘建超),BAO Xiao-Yu(包晓玉),et al.Acta Chim.Sinica(Huaxue Xuebao),2010,68(6):508-514
[9]ZHU Li(朱 莉),PENG Bin(彭 斌),LENG You(凌 友),et al.Acta Chim.Sinica(Huaxue Xuebao),2008,66(24):2705-2711
[10]JING Zhi-Hong(景志红),HU Chun-Xia(胡春霞),LI Yan-Tuan(李延团).Chin.J.Qufu Normal Univ.(Qufu Shifan Daxue Xuebao),2000,26(4):58-60
[11]TAN Da-Jin(谭大金),HE Yun(贺云),QIU Li(邱李),et al.Chinese J.Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2007,19(50):502-505
[12]ZHANG Rong-Ying(张蓉颖),PANG Dai-Wen(庞代文),CAI Ru-Xiu(蔡汝秀).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1999,20(8):1210-1217
[13]PENG Jun-Feng(彭俊蜂),LING Jian-Ya(凌建亚),ZHANG Han-Xing(张晗星),et al.Chin.J.Spectrosc.Spectr.(Guangpuxue Yu Guangpu Fenxi),2004,24(7):858-861
[14]ZOU Min(邹敏),LIU Shu-Wen(刘叔文),ZHOU Chun-Qiong(周春琼).Acta Chim.Sinica(Huaxue Xuebao),2010,68(6):481-486
[15]ZHANG Ai-Mei(张爱梅),JIA Li-Ping(贾丽萍),HUANG Peng(黄蓬).Chin.J.Liaocheng Univ.:Nat.Sci.(Liaocheng Daxue Xuebao),2009,22(1):51-53
[16]SHUAI Li(帅丽),WANG Jiao-Liang(王娇亮),SONG Zhao-Feng(宋昭凤),et al.Chin.J.Nat.Sci.Hunan Normal Univ.(Hunan Shifan Daxue Ziran Kexue Xuebao),2005,28(4):59-62
[17]WANG Liu-Fang(王流芳),SONG Yu-Min(宋玉民),FENG Ya-Fei(冯亚非),et al.Acta Chim.Sinica(Huaxue Xuebao),2004,62(22):2277-2281
[18]HU Ya-Min(胡亚敏),WANG Xing-Ming(王兴明),FEI Dan(费丹),et al.Acta Chim.Sinica(Huaxue Xuebao),2008,66(10):1245-1251
[19]ZHANG Gai-Qing(张改清),YIN Cai-Xia(阴彩霞),HUO Fang-Jun(霍方俊),et al.Chinese J.Ionrg.Chem.(Wuji Huaxue Xuebao),2009,25(3):428-432
Synthesis,Characterization and Study on the Interaction of DNA with Diphenylthiourea Cobalt(Ⅲ)Complex
CAO Feng-Pu*DING Cheng-HuaLIU Wen-Min FENG Yu-Quan XING Wen-Ru
(College of Chemistry and Pharmaceutical Engineering,Nanyang Normal University,Nanyang,Henan 473061,China)
A cobalt(Ⅲ)complex with diphenylthiourea [Co(DPTU)3](DMF)3,where DPTU=diphenylthiourea,has been synthesized and characterized by IR,elemental analysis and X-ray diffraction methods.The Interactions of DNA with DPTU and complex have been investigated by absorption spectroscopy,fluorescence spectroscopy and viscosity.The studies suggested that the interaction of DPTU and complex with DNA belong to both partial intercalation and electrostatic interaction.CCDC:800751.
diphenylthiourea;cobalt(Ⅲ)complex;DNA;partial intercalation;electrostatic interaction
O614.81+2
:A
:1001-4861(2011)02-0343-05
2010-07-05。收修改稿日期:2010-10-25。
南阳师范学院高层次人才科研启动费、2009年河南省教育厅科技攻关项目(No.200913150020)资助。
*通讯联系人。 E-mail:caofpu99@163.com
