N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺从盐酸介质中萃取三价镧系金属的研究
2011-09-29吴广谱杨金红夏光明孙国新
吴广谱 杨金红 夏光明 崔 玉 孙国新
(济南大学化学化工学院,济南 250022)
N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺从盐酸介质中萃取三价镧系金属的研究
吴广谱 杨金红 夏光明 崔 玉 孙国新*
(济南大学化学化工学院,济南 250022)
以煤油/辛醇(7∶3,V/V)为稀释剂,研究 N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺(DMDODGA)从盐酸介质中萃取三价镧系金属的性能及反应机理;考察了水相盐酸浓度、萃取剂浓度及温度对其萃取性能的影响。结果表明分配比在所研究酸度范围内随盐酸浓度的增加先增大后减小;随萃取剂浓度的增加而增大;萃合物的组成为MCl3·2DMDODGA(M=Sm,Gd,Dy)或MCl3·DMDODGA(M=Er,Lu)。萃取过程为放热反应,升高温度不利于萃取。同时计算出了萃取反应的平衡常数及热力学函数。萃合物的红外光谱表明羰基氧、醚氧均与镧系离子配位。
N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺; 盐酸; 镧系金属; 萃取
新萃取剂的研究有利于新的萃取工艺的建立与发展。酰胺类萃取剂因其耐辐射、不易水解、辐解产物易洗涤且不影响萃取分离过程、能完全燃尽不产生固体废物、容易合成等一系列的优点,而被认为是一类很有前途的萃取剂[1-9]。有关这类萃取剂在硝酸体系中分离提纯镧系、锕系元素的研究已被大量报道[10-17]。稀土湿法冶金、稀土回收时常使用盐酸体系,探讨该类萃取剂在盐酸体系中萃取镧系元素的行为具有重要意义。
近些年来的研究表明,在酰胺基础上发展起来的 3-氧戊二酰胺类萃取剂对 Ln(Ⅲ)、An(Ⅲ,Ⅳ,VI)和碱土金属有更好的萃取能力[18-24]。刘敏等[25]对这方面的研究进展进行了综述,认为不对称3-氧戊二酰胺的萃取能力明显比对称3-氧戊二酰胺的萃取能力强,且萃取效果受自身结构的影响较大。迄今为止还未见有利用该类萃取剂从盐酸介质中萃取稀土的研究报道。
初步研究发现以纯粹烷烃、芳烃等为稀释剂时,3-氧戊二酰胺类萃取剂在盐酸体系中的萃取能力很弱,实用价值不大,当采用煤油/辛醇为稀释剂时萃取效率大幅提高。本文开展了以煤油/辛醇为稀释剂,N,N′-二甲基-N,N′-二辛基-3-氧戊二酰胺在盐酸体系中对三价镧系离子的萃取性能研究。
1 实验部分
1.1 试剂与仪器
N,N′-二 甲 基-N,N′-二 辛 基 -3-氧 戊 二 酰 胺(DMDODGA)由二甘酰氯和甲基辛胺反应制得[26],减压蒸馏提纯,经红外光谱、元素分析、1HNMR等检测,纯度大于98%,可用于本实验,其结构如下:
所用试剂均为分析纯试剂。煤油经磺化、蒸馏备用。

722s可见分光光度计 (上海棱光技术有限公司);低温恒温振荡器 (上海梅香仪器有限公司);SPECTRUM ONE红外光谱仪(美国PE公司);Unity-Inova-300型核磁共振仪 (Varian公司);PE2400C型元素分析仪(美国)。
1.2 萃取实验方法
1.2.1 稀土溶液的配制
准确称取一定质量的稀土金属氧化物,用适量浓盐酸溶解,加热缓慢蒸干,冷却后加4滴浓盐酸,用二次蒸馏水定容得到浓度为0.1000 mol·L-1的相应稀土离子标准溶液,工作溶液由此稀释并加入定量的盐酸得到。
1.2.2 萃取剂的配制
按比例准确称取一定质量的萃取剂于5支100 mL 容量瓶中,用煤油/辛醇(7∶3,V/V)将其稀释至刻度,最后得到浓度分别为 0.075、0.100、0.125、0.150、0.175 mol·L-1的萃取剂溶液。
1.2.3 萃取步骤
分别量取等体积的镧系离子溶液和有机相置于磨口离心试管中,在低温恒温振荡器中振荡30 min至萃取平衡,离心分相取萃余水相用偶氮胂(Ⅲ)分光光度法测定,由差减法计算分配比D。除温度效应外,实验均在(25±0.5)℃下完成。温度影响萃取实验在水浴低温恒温振荡器中完成,温度控制误差小于 0.5 ℃。
1.2.4 红外光谱表征
所有产品和原料红外谱图都采用KBr压片法,在4000~400 cm-1范围内收集样品的红外光谱,扫描次数为4次,分辨率为2 cm-1。
2 结果与讨论
2.1 水相盐酸浓度对萃取分配比的影响
由图1可知,在所研究酸度范围内,低酸度下,盐酸的同离子效应使萃取分配比随盐酸浓度的增加而增大,酸度较大时,萃取分配比又随之降低。与硝酸体系不同[27],酰胺类萃取剂萃取盐酸的能力很弱。高酸度下,水溶液中氯离子与稀土离子形成配位阴离子,不能被萃取,可能是造成萃取率下降的主要原因。

图1 HCl浓度对萃取镧系离子分配比的影响Fig.1 Effect of HCl concentration on the extraction distribution ratio of lanthanides
随原子序数的增加,达到最大萃取分配比所需酸度逐渐减小(图1),且萃取率提高,这与硝酸体系规律相似[28]。
2.2 萃取剂浓度对萃取分配比的影响
固定水相酸度及金属离子浓度,研究了萃取剂浓度变化对萃取镧系离子分配比的影响。从图2看出,当水相盐酸的浓度为 2.00 mol·L-1时,三价镧系离子的萃取分配比在煤油/辛醇体系中随着萃取剂浓度的增加而增加。萃取剂DMDODGA对三价镧系离子的萃取可以用下列反应表示:


图2 萃取剂浓度对萃取镧系离子分配比的影响Fig.2 Effect of extraction concentration on the extraction distribution ratio of lanthanides
萃取平衡常数为:
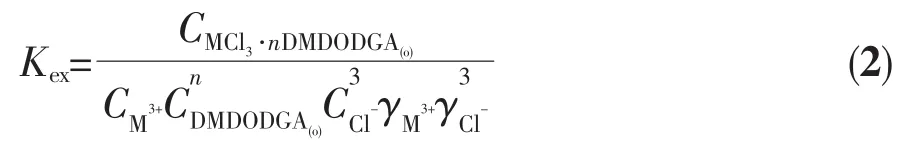
萃取完成后水相中三价镧系元素M3+的总浓度为:

其中β1为Cl-与三价镧系离子的一级稳定常数,由于Cl-配位能力弱,远不及溶液中大量水的配位能力,因此做了如下近似:

分配比为:
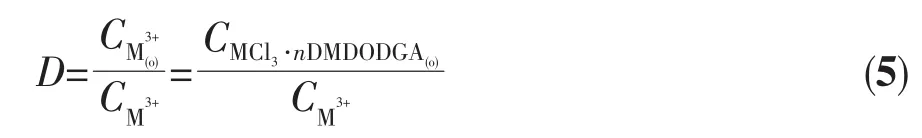
条件平衡常数为:

两边取对数得:
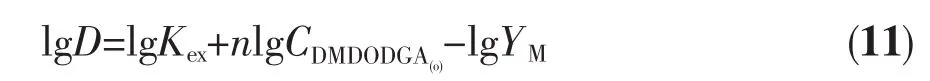
在温度、酸度以及金属离子浓度不变的情况下,以lgD对lgCDMDODGA(o)作图可得到一直线,其斜率即为溶剂化数n。由实验数据经线性拟合后得到5条直线 (图 2),Sm3+、Gd3+、Dy3+对应的斜率值约为 2;Er3+、Lu3+的斜率值约为1。这表明在以煤油/辛醇做稀释剂时,萃合物分子中1个三价镧系离子与2个或1个分子DMDODGA配位,形成萃合物的组成分别 为 MCl3·2DMDODGA(M=Sm,Gd,Dy) 或 MCl3·DMDODGA(M=Er,Lu)。
根据皮泽方程[29]推导可知,盐酸的平均活度系数为:

当 溶 液 中 CHCl=2.00 mol·L-1,I=2.000 mol·L-1时,

298 K 时的水溶液中,A=0.391,b=1.2,α=2.0,,适用范围CHCl<6 mol·L-1, 代入上述公式中得 f=-0.851 6,B=0.430,因此得 γ±=1.013。

从而得 γCl-=1.05,γM3+=1.02
根据公式(7)及(8),可计算出萃取反应的lgK值及 lgKex值,见表1。
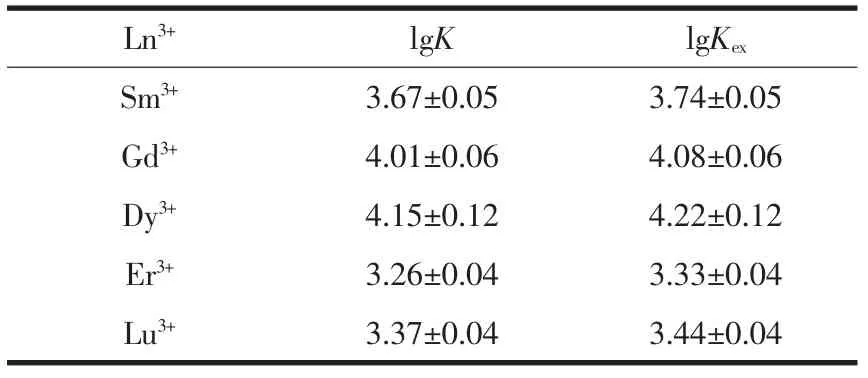
表 1 煤油/辛醇(7∶3,V/V)体系中 DMDODGA 萃取镧系离子的lgK和lgKex值Table 1 Values of lgK and lgKexof the extraction of lanthanides(Ⅲ)with DMDODGA in kerosene/octanol(7∶3,V/V)
2.3 温度对DMDODGA萃取三价镧系金属离子分配比的影响
在DMDODGA-煤油/辛醇体系中,温度对萃取分配比的影响如图3所示。可以看出随温度的增加,DMDODGA萃取三价镧系离子的分配比在逐渐减小,表明DMDODGA萃取三价镧系离子是放热反应,升高温度对萃取不利。

图3 温度对镧系离子分配比的影响Fig.3 Effect of temperature on the extraction distribution ratio of lanthanides
根据Vant Hoff方程得到:

由公式(11)可知:
lgD=lgKex+nlgCDMDODGA(o)-lgYM
当 lgCDMDODGA(o)、YM恒定时,将公式(11)两边对1/T求偏微熵及由公式(17)得:

以lgD对1000/T作图,由直线的斜率可求出萃取反应的热焓。
由反应的吉布斯自由能和熵值函数公式:
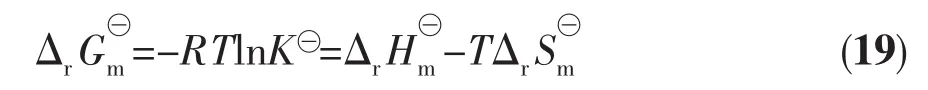
其中K⊖值即对应于上文中的Kex值,求出各热力学函数值,结果列于表2。由表2可知,所研究的三价镧系离子的萃取反应焓及吉布斯能和熵变均为负值,说明DMDODGA对稀土元素的萃取是放热反应,且萃取效果受温度影响的程度不同。焓变数值较大表明此反应是焓驱动的。
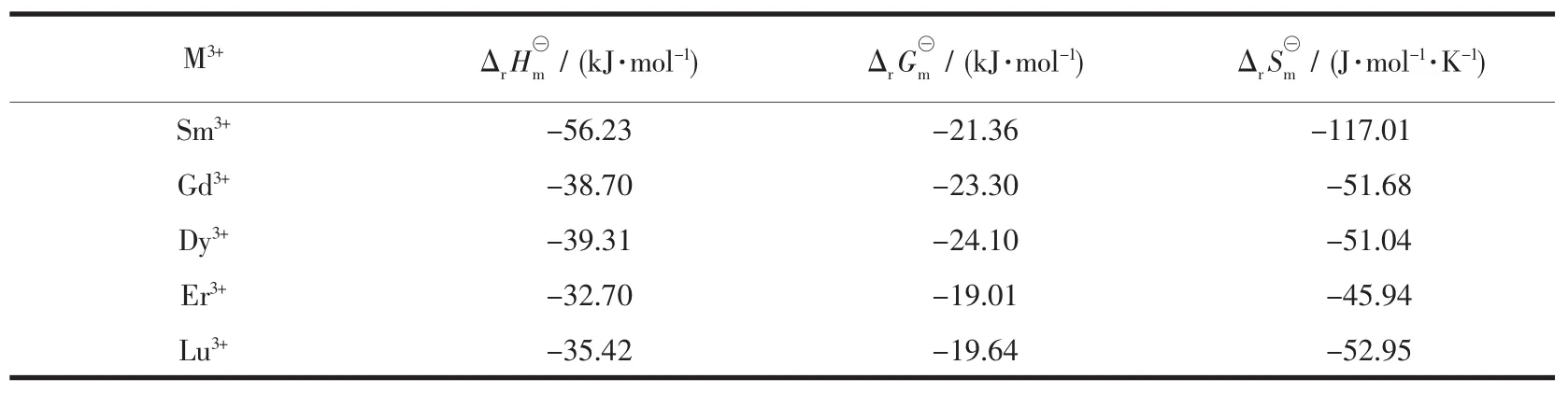
表2 煤油/辛醇(7∶3,V/V)体系中DMDODGA萃取镧系离子的热力学函数值Table 2 Thermodynamic data of the extraction of lanthanides(Ⅲ) in kerosene/octanol(7∶3,V/V)
2.4 负载镧系离子后DMDODGA的红外光谱研究
比较萃取负载镧系离子有机相的红外光谱数据(表3)发现游离萃取剂的羰基吸收峰(1 655.12 cm-1)消失,1630 cm-1附近出现一个新峰,为配位C=O吸收峰[30]。但随原子序数的增加,1630 cm-1附近该新峰的波数逐渐增加,主要是因为镧系原子对电子的束缚能力越来越强,使得酰胺羰基的红外吸收峰向高波数偏移。在1120 cm-1附近的C-O-C的吸收峰发生了偏移,这说明萃取剂通过羰基以及醚氧键与三价镧系元素配位[31]。
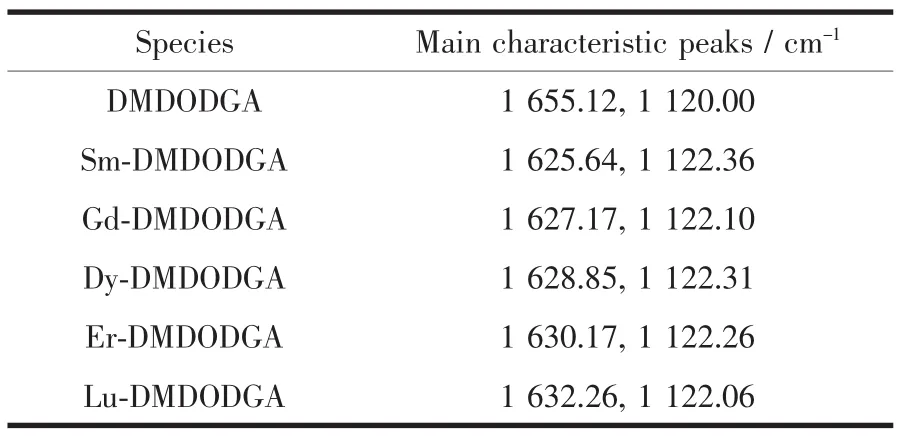
表3 负载镧系离子有机相的红外光谱数据Table 3 IR spectra acta of organic phase loaded lanthanides(Ⅲ)
2.5 萃取剂与镧系金属离子形成不同配合物的讨论
萃取剂与镧系金属离子形成不同配合物的原因可能有两种:一是萃取剂的自身结构。萃取剂自身的差异影响主要表现在萃取剂和Cl-、H2O相互竞争配位的结果,在竞争过程中萃取剂的空间结构影响了参与配位的原子的配位能力。另外一个是配位原子的大小。配位数不同归因于镧系收缩现象,当核半径太小时空间位阻效应导致不足以容纳2个配体同时配位。对于萃取剂DMDODGA而言,由于其分子中辛基的存在导致空间位阻增大,配体之间的相互竞争加剧,此时稀土离子半径的大小是决定DMDODGA在萃合物分子中参与配位的配体个数的主要因素。由于配体的空间位阻使其在萃合物分子中的数目发生变化即Sm(Ⅲ)、Gd(Ⅲ)、Dy(Ⅲ)的萃合物的分子结构为 MCl3·2DMDODGA, 而 Er(Ⅲ),Lu(Ⅲ)则为 MCl3·DMDODGA。 Dy(Ⅲ),Er(Ⅲ)之间的半径差别则就是DMDODGA在萃合物分子中2配位与1配位的分界点。Lumetta 等[32]在研究用N,N,N′,N′-四甲基丁二酰胺萃取硝酸体系中镧系离子时形成的萃合物分子结构不同,其结果也支持这里提出的竞争配位的观点。
2.6 辛醇的特殊作用
影响萃取剂萃取效果的因素除自身结构及配位原子大小之外,稀释剂的作用也很重要,它对萃取分配比及萃合物的结构都有重大的影响。在本文研究过程中,加入辛醇大幅度提高了萃取分配比。分析原因是萃合物可能是离子型配合物,即氯离子没有参与配位,带有极性羟基的辛醇能够很好的溶解离子型萃合物,而芳烃、烷烃稀释剂的溶剂化能力差,导致在这些溶剂中加入辛醇能极大地增大其溶解离子型萃合物的能力。目前我们获得了氯化铒与N,N′-二甲基-N,N′-二苯基-3-氧戊二酰胺配合物的晶体结构,显示氯离子确实没有配位,晶体中有配位水和结晶水,晶体结构正在进一步精修中,将于近期发表。
3 结 论
DMDODGA以煤油/辛醇为稀释剂可有效从盐酸体系中萃取三价镧系离子,并显示出一定的分离效果。萃合物组成为MCl3·2DMDODGA(M=Sm,Gd,Dy)或 MCl3·DMDODGA(M=Er,Lu)。 其 中 配 位DMDODGA的羰基氧以及醚键氧均参与配位。三价镧系金属离子分配比在所研究酸度范围内随盐酸浓度的增加先增加后减小。萃取剂浓度增加,有利于萃取。萃取过程是放热反应,升高温度对萃取不利。
[1]Murillo M T,Espartero A G,Jorge S Q,et al.Solvent Extr.Ion Exch.,2009,27(2):107-131
[2]Tian G X,Zhang P,Wang J C,et al.Solvent Extr.Ion Exch.,2005,23(5):631-643
[3]Mowafy E A,Aly H F.Solvent Extr.Ion Exch.,2007,25(2):205-224
[4]Giuseppe M,Hanna A,Hendrik V.Solvent Extr.Ion Exch.,2008,25(1):62-76
[5]Turanov A N,Karandashev V K,Baulin V E.Solvent Extr.Ion Exch.,2008,26(2):77-99
[6]Sun G X,Liu M,Cui Y,et al.Solvent Extr.Ion Exch.,2010,28(4):482-494
[7]CUI Yu(崔玉),SUN Guo-Xin(孙国新),LI Ye-Xin(李业新),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(11):1723-1726
[8]Ning P G,Cao H B,Zhang Y.Sep.Purif.Technol.,2009,70:27-33
[9]ZHANG Ming-Zu(张明祖),NI Pei-Hong(倪沛红),CAO Zheng-Bai(曹正白),et al.Nucl.Technol.(He Jishu),2000,23(9):668-672
[10]Magnusson D,Christiansen B,Glatz J P,et al.Solvent Extr.Ion Exch.,2009,27(1):26-35
[11]Muría M T,Espartero A G,Sánchez-Quesada J,et al.Solvent Extr.Ion Exch.,2010,28(2):107-131
[12]ZHANG Zhen-Wei(张振伟),CUI Yu(崔玉),SUN Guo-Xin(孙国新),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(10):1867-1870
[13]Husain M,Ansari S A,Mohapatra P K,et al.Desalination,2008,229:294-301
[14]SUN Guo-Xin(孙国新),CUI Yu(崔玉),YIN Shao-Hong(尹少宏),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(2):265-269
[15]ZHANG Rong-Suo(张荣锁),CHEN Wen-Jun(陈文浚),HUANG Zhong-Liang(黄忠良),et al.J.Nucl.Radiochem.(He Huaxue Yu Fangshe Huanxue),2001,23(2):87-92
[16]WANG You-Shao(王友绍),SUN Zong-Xun(孙宗勋),HE Lei(何磊),et al.Nucl.Technol.(He Jishu),2003,26(3):224-228
[17]CHENG Qian(程倩),LI Yu(李玉),BAO Bo-Rong(包伯荣),et al.J.Nucl.Radiochem.(He Huaxue Yu Fangshe Huanxue),2008,30(3):152-155
[18]TIAN Guo-Xin(田国新),WANG Jian-Chen(王建晨),SONG Chong-Li(宋崇立).J.Nucl.Radiochem.(He Huaxue Yu Fangshe Huanxue),2001,23(3):135-140
[19]DING Song-Dong(丁颂东),CHEN Wen-Jun(陈文浚),CHEN Shao-Jin(陈绍金),et al.J.Nucl.Radiochem.(He Huaxue Yu Fangshe Huanxue),2003,25(1):61-64
[20]Gujar R B,Ansari S A,Mohapatra P K,et al.Solvent Extr.Ion Exch.,2010,28(3):350-366
[21]ZHANG Yan-Ju(张艳菊),CUI Yu(崔玉),LIU Min(刘敏),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(12):2047-2050
[22]Ansari S A,Pathak P N,Manchanda V K.Solvent Extr.Ion Exch.,2005,23:463-479
[23]Kannan S,Moody M A,Barnes C L,et al.Inorg.Chem.,2008,47(11):4691-4695
[24]Ansari S A,Mohapatra P K,Manchanda V K.Ind.Eng.Chem.Res.,2009,48:8605-8612
[25]LIU Min(刘敏),YUAN Mei-Long(袁美龙),YIN Shao-Hong(尹少宏),et al.J.Univ.Jinan(Jinan Daxue Xuebao),2007,21(2):133-136
[26]LIU Min(刘敏).Thesis for the Master of Jinan University(济南大学硕士论文).2007.
[27]Nigond L,Musikas C,Cuillerdier C.Solvent Extr.Ion Exch.,1994,12(2):261-296
[28]Sasaki Y,Sugo Y,Suzuki S,et al.Solvent Extr.Ion Exch.,2001,19(1):91-103
[29]YANG Xian-Wan(杨显万),QIU Ding-Fan(邱定番).Hydrometallurgy(湿法冶金).Beijing:Metallurgy Industry Press,1998:39-41
[30]YE Guo-An(叶国安),HE Jian-Yu(何建玉),LUO Fang-Xiang(罗方祥).J.Nucl.Radiochem.(He Huaxue Yu Fangshe Huanxue),2000,22(3):136-143
[31]Shimojo K,Kurahashi K,Naganawa H.Dalton Trans.,2008,37:5083-5088
[32]Lumetta G J,McNamara B C,Rapko B M,et al.Inorg.Chim.Acta,1999,293:195-205
Extraction of Lanthanides(Ⅲ) with N,N′-dimethyl-N,N′-dioctyl-3-oxy-glutaramide from Hydrochloric Acid Medium
WU Guang-Pu YANG Jin-Hong XIA Guang-Ming CUI Yu SUN Guo-Xin*
(School of Chemistry and Chemical Engineering,University of Jinan,Jinan 250022,China)
The extraction performance and mechanism of Lanthanides(Ⅲ) with N,N′-dimethyl-N,N′-dioctyl-3-oxyglutaramide(DMDODGA)in kerosene/n-octanol(7:3,V/V)from hydrochloric acid medium were studied.The influence of the concentration of hydrochloric acid,DMDODGA and the temperature on the extraction had been investigated.The results show that the extraction distribution ratio of Lanthanides(Ⅲ)firstly increases and then decreases with the increase in the concentration of hydrochloric acid.Extraction distribution increases with the increase in extractant concentration.The stoichiometries of the extracted species are MCl3·2DMDODGA (M=Sm,Gd,Dy)or MCl3·DMDODGA(M=Er,Lu).The distribution ratio decreases with the increase in the temperature,and the extraction reaction is exothermic.The IR spectra of the extracted species indicates that the carbonyl oxygen and etheric oxygen of DMDODGA are all coordinated with lanthanide ions.
N,N′-dimethyl-N,N′-dioctyl-3-oxy-glutaramide;hydrochloric acid;lanthanides;extraction
O614.33
:A
:1001-4861(2011)02-0315-06
2010-08-30。收修改稿日期:2010-09-29。
国家自然科学基金(No.21077044);山东省自然科学基金(No.Y2008B41);山东省重点学科基金(No.XTD0704)资助项目。
*通讯联系人。 E-mail:chm_sungx@ujn.edu.cn
