牡蛎糖原的提取、纯化及补体活性研究
2011-09-26宋荪阳,朱蓓薇,杨静峰,孙黎明
宋 荪 阳, 朱 蓓 薇, 杨 静 峰, 孙 黎 明
( 1.大连工业大学 海洋食品教育部工程研究中心, 辽宁 大连 116034; 2.大连工业大学 农业部农产品加工技术研发贝类专业分中心, 辽宁 大连 116034 )
0 引 言
牡蛎是一种营养价值很高的海珍品[1]。牡蛎蛋白质中氨基酸组成完善,富含铁、锌、钙、锰、硒等微量元素[2]。近年来,牡蛎的生理活性得到广泛的关注。已有研究报道表明牡蛎酶解液具有较好的抗氧化活性[3],牡蛎提取物对小鼠肝脏具有保护作用[4],牡蛎糖氨聚糖具有抗肿瘤活性[5]等。其中关于牡蛎多糖的相关研究较多。证明了牡蛎多糖在抗凝血、降血脂[6]、提高免疫功能[7]等方面均具有较好的活性。
糖原是一种仅有葡萄糖组成的特殊多糖,是动物体内能源物质的贮存形式。由于其独特的分子结构,使其在生理活性上不同于一般多糖。陈骞等研究表明,牡蛎糖原具有较好的抗疲劳活性[8],并且证明其相对分子质量在数百万到数千万之间[9]。目前关于牡蛎糖原及其活性的研究报道尚不多见,因此对其生理活性物质的研究具有重要意义。本文采用酶法结合醇沉制备了牡蛎糖原,并通过柱层析分离技术得到纯度较高的牡蛎糖原组分,对牡蛎糖原的体外补体活性进行了研究。
1 材料与方法
1.1 原料与试剂
新鲜牡蛎,购于大连市春柳市场;胃蛋白酶,杭州中香化学有限公司;木瓜蛋白酶,上海生工生物工程技术服务有限公司;其他试剂均为分析纯。
1.2 主要仪器
LG-1.0型真空冷冻干燥机,沈阳航天新阳速冻设备制造有限公司;UV-2100紫外分光光度计,尤尼柯仪器有限公司;Agilent 6890N型气相色谱仪,美国Agilent公司;BIO-RAD 680酶标仪,美国BIO-RAD公司。
1.3 实验方法
1.3.1 牡蛎粗糖原的制备
将新鲜牡蛎去壳,真空冷冻干燥机中干燥,粉碎,过20目筛,备用。
称取牡蛎干粉,加入45倍体积水搅拌均匀,以6 mol/L NaOH调pH至2.0,加入质量分数1.5%的胃蛋白酶,37 ℃水解2 h,迅速灭酶10 min,冷却至室温后,以6 mol/L HCl调pH至中性,4 000 r/min离心10 min,取上清,加入3倍体积95%乙醇,醇沉12 h,弃去酒精,取沉淀,加水复溶,离心至无沉淀或少沉淀,收集上清液,浓缩、冻干,即得牡蛎粗糖原(crude oyster glycogen,COG)。于COG中,加入木瓜蛋白酶进行二次酶解。酶解条件如下:料液比1∶45,酶加量为底物质量的1.5%,在pH 7.0、温度为65 ℃条件下,酶解3 h。酶解后醇沉12 h,收集沉淀加水复溶,离心至无沉淀或少沉淀,收集上清液,浓缩,冻干,即得牡蛎糖原。
1.3.2 牡蛎糖原的分离纯化
首先采用阴离子交换柱DEAE-cellulose 52(2.0 cm×40 cm)对OG进行分离纯化,上样质量浓度为50 mg/mL,上样量为2 mL。分别用0、0.15和0.5 mol/L NaCl作为洗脱液进行梯度洗脱。体积流量为1 mL/min,每6 min收集一管。采用苯酚-硫酸法检测糖原组分。将收集到的各组分合并、浓缩、透析(流水透析24 h,去离子水透析24 h)、冻干,即得组分OG1,OG2,OG3。对组分OG1,进一步采用葡聚糖凝胶Sephadex G-100进行分离纯化(1.6 cm×80 cm),0.15 mol/L NaCl进行线性洗脱,体积流量为每12 min 2 mL,每2 mL收集一管。采用苯酚硫酸法检测糖原质量分数,得到纯化后糖原OG11。
1.3.3 牡蛎糖原的组分分析
糖原质量分数测定采用苯酚硫酸法[10],蛋白质质量分数测定采用Folin-酚法[11]。
1.3.4 牡蛎糖原纯度鉴定
将Sephadex G-100分离纯化后的OG11采用高效液相色谱进行纯度鉴定。进样量为20 μL。色谱分析采用岛津公司的SCL-10AVP高效液相色谱仪,分析条件如下:色谱柱为TSK-GEL G4000PWXL柱(7.8 mm×300 mm),流动相为超纯水;体积流量为0.5 mL/min。将收集到的样品采用苯酚硫酸法检测。
1.3.5 牡蛎糖原单糖组成鉴定
牡蛎糖原的单糖组成鉴定采用气相色谱法[12]。
称取5 mg样品,向其中加入1.0 mL 2 mol/L 的三氟乙酸(TFA),在120 ℃条件下水解2 h后移入蒸发皿中,于80 ℃水浴中加无水乙醇除酸。待中性后,在溶液中加入1.0 mg 肌醇及1.0 mL 0.1 mol/L Na2CO3溶液,在30 ℃水浴下保温50 min后向溶液中加入50 mg硼氢化钠,室温下静置1.5 h后用25%乙酸中和溶液,采用阳离子交换树脂除盐、过滤、蒸馏水洗涤并移入水解管中干燥。向水解管中加入1.0 mL甲醇除酸,N2吹干,重复2次。向水解管中加入1.0 mL正丙胺、1.0 mL吡啶、0.5 mL乙酸酐、90 ℃保温1 h,N2吹干后加入0.5 mL无水二氯甲烷,待沉淀溶解后离心,取上清,待测。
气相色谱条件:色谱柱,AJW&HP-88 Capillary column(100 m×250 μm×0.25 μm)(Agilent,美国);程序升温,180 ℃保持3 min;以10 ℃/min的速度升至230 ℃,保持20 min;以5 ℃/min的速度升至240 ℃,保持20 min;以5 ℃/min的速度升至250 ℃,保持30 min;载气(N2)体积流量0.5 mL/min;压力171.8 kPa;进样量为5 μL。
1.3.6 牡蛎糖原补体活性的研究
首先制备致敏绵羊红细胞。取绵羊红细胞用缓冲液离心洗3次,每次2 000 r/min,离心10 min,重复3次。再用GGVB配制成体积分数为2%的绵阳红细胞(SRBC)悬液。取相同体积2 U溶血素加入SRBC悬液中,混匀后置37 ℃水浴致敏30 min,即为致敏的绵羊红细胞悬液。样品检测时,取100 μL样品,200 μL补体(人血清,1∶25稀释),200 μL GGVB(0.141 mol/L NaCl,0.5 mmol/L MgCl2,0.15 mmol/L CaCl2,1.8 mmol/L巴比妥钠,0.1%明胶,pH 7.4),37 ℃水浴30 min,加入100 μL致敏绵羊红细胞,37 ℃水浴30 min,4 000 r/min离心10 min,取上清液在405 nm处测吸光值。设空白对照,用100 μL GGVB代替样品。
2 结果与讨论
2.1 牡蛎糖原的提取及组分分析
动物体内多糖多与蛋白质以共价结合形式存在,采用传统的水提法很难将其去除。本实验采用蛋白酶酶解去除牡蛎中的蛋白质。
表1显示,牡蛎干粉经胃蛋白酶一次酶解后糖质量分数达到72.58%,说明使用胃蛋白酶并结合乙醇沉淀能有效提取COG,但是仍有12.30%的蛋白质未被去除,因此采用二次酶解,加入木瓜蛋白酶去除这部分蛋白质,得到OG。木瓜蛋白酶酶解后蛋白质量分数仅为1.81%,同时糖质量分数也得到显著提高。

表1 牡蛎糖原组成
2.2 牡蛎糖原的分离纯化
采用阴离子交换柱DEAE-52对OG进行分离纯化。经不同浓度的NaCl进行梯度洗脱后,得到3个带不同电荷的组分OG1、OG2和OG3(图1)。由表1可知,OG1糖质量分数极高且几乎不含蛋白质,为牡蛎糖原的主要组分。因此,将其作为主要研究对象,采用葡聚糖凝胶Sephadex G-100进一步分离纯化,得到3个分子质量不同的糖峰:OG11、OG12、OG13(图2)。其中OG11峰值明显高于其他组分,因此该组分为牡蛎糖原的主要组成成分。图2结果还表明牡蛎糖原的分子质量较大,这与文献[9]报道一致。
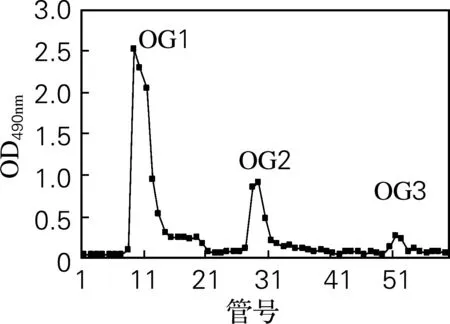
图1 OG DEAE-52分离纯化
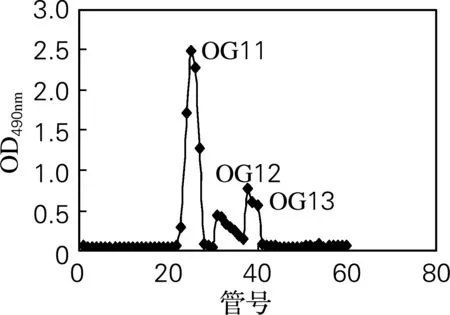
图2 OG1 Sephadex G-100 分离纯化
2.3 牡蛎糖原纯度的鉴定
采用高效液相色谱法对分离纯化后的组分OG11进行纯度鉴定。样品采用苯酚硫酸法进行检测,仅得到一个单一峰,且对称性较好(图3),证明得到纯度较高的牡蛎糖原组分。
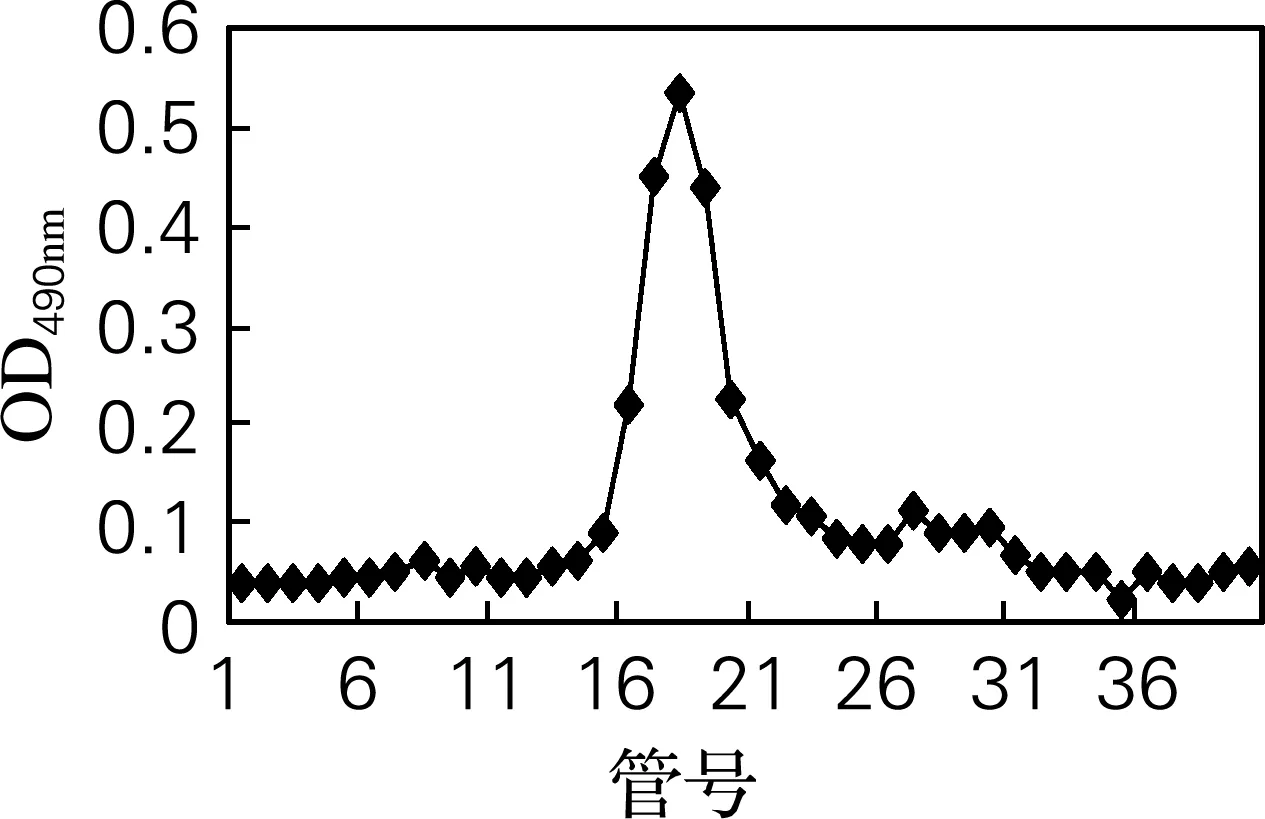
图3 OG11高效液相色谱纯度鉴定
2.4 牡蛎糖原的鉴定
将OG11组分进行单糖组成鉴定(图4)。通过气相色谱法,样品经三氟乙酸水解,采用乙酰化方法对样品进行处理,肌醇为内标。标准单糖采用相同的处理方法。OG11气相色谱结果显示,牡蛎中仅含一种单糖组分,以此组分的相对保留时间与标准单糖出峰的相对保留时间进行对照,证明该单糖组分为葡萄糖。

图4 牡蛎糖原气相色谱图
2.5 牡蛎糖原补体活性的研究
OG11在质量浓度为0.1~5.0 mg/mL,补体抑制活性由8.09% 提高到77.38%(图5),且具有一定的剂量-效应关系。
补体系统是人体重要的免疫防御系统之一。补体系统过度激活会引起人体免疫系统的过度反应,造成人体自身正常组织的损伤。
多糖是一类具有显著抗补体活性的天然产物[13]。国内外研究表明,多糖的抗补体活性主要与其单糖组成、硫酸基团及支链结构的存在有关[14-16]。陈骞等[17]对牡蛎糖原结构的研究发现,其链长较短且分支化程度高。这有可能与牡蛎的补体活性有关,具体机理还有待于进一步研究。
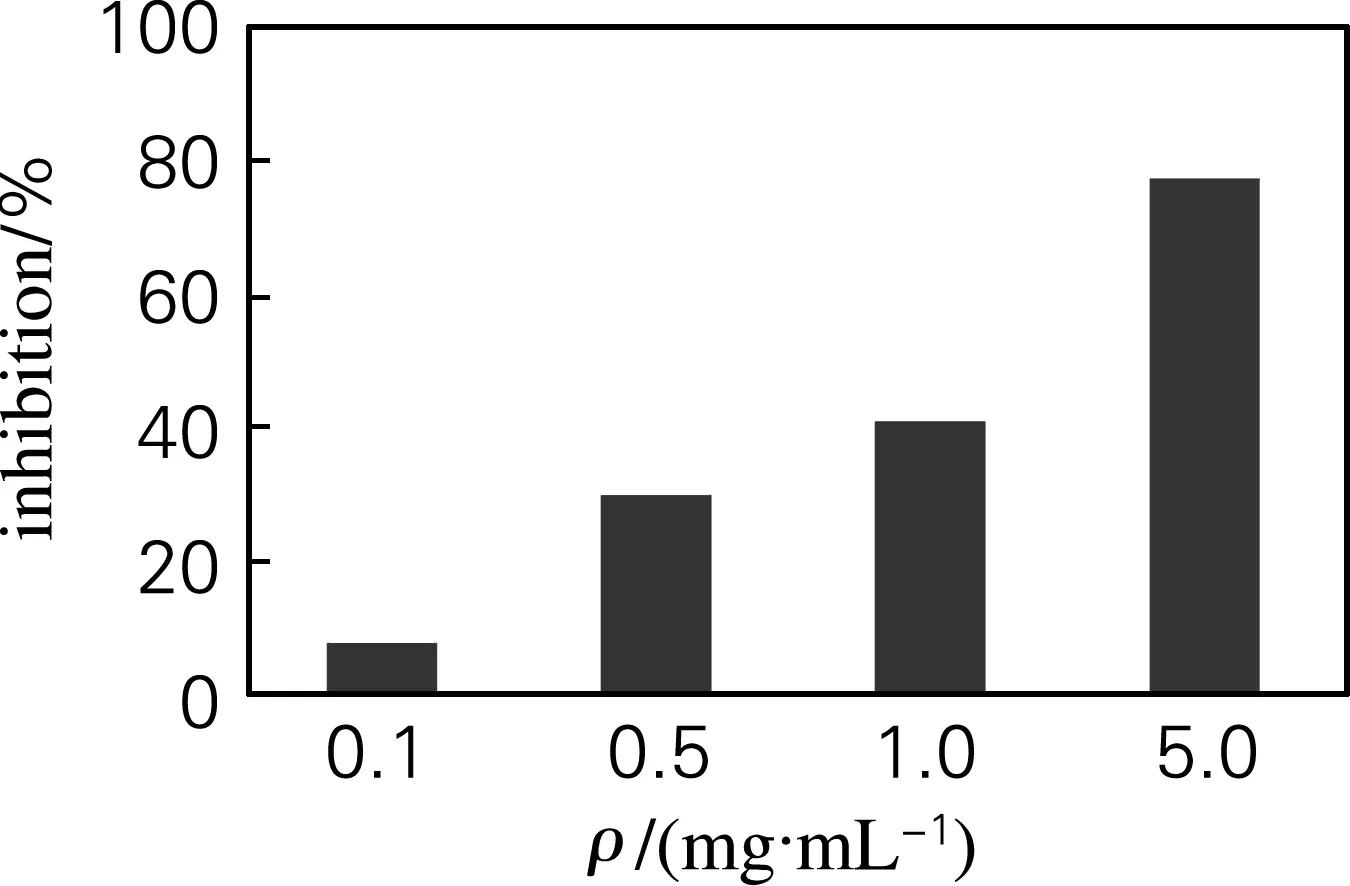
图5 牡蛎糖原对补体活性的抑制作用
Fig.5 The anti-complementary activity of oyster glycogen
3 结 论
(1)胃蛋白酶和木瓜蛋白酶处理,可以有效除去蛋白,使COG中的蛋白质量分数从12.30%降低至1.81%(OG)。通过DEAE-52和Sephadex G-100的纯化作用可进一步降低糖原中的蛋白,组分OG1的蛋白质量分数仅为0.33%。
(2)OG11对补体的经典途径具有较强的抑制作用。
[1] 董晓伟,姜国良,李立德,等. 牡蛎综合利用的研究进展[J]. 海洋科学, 2004, 28(4):62-65.
[2] 汪何雅,杨瑞金,王璋. 牡蛎的营养成分及蛋白质的酶法水解[J]. 水产学报, 2003, 27(2):163-168.
[3] 雷丹青,周先果,张辉,等. 牡蛎酶解液的抗氧化活性研究[J]. 时珍国医国药, 2008, 19(11):2674-2676.
[4] 李旭,苑隆国,王晓辉. 牡蛎提取物对小鼠肝脏保护作用的研究[J]. 医学研究通讯, 2005, 34(1):51-52.
[5] 胡雪琼,吴红棉,刘芷筠,等. 近江牡蛎糖氨聚糖的酶解提取及其抗肿瘤活性的研究[J]. 食品研究与开发, 2009, 30(7):3-6.
[6] 胡婷,陈琼华. 牡蛎多糖防治心血管病及其他生物活性[J]. 中国生化药物杂志, 1993(1):53-56.
[7] 王俊,姚滢,张建鹏,等. 牡蛎多糖的制备和生物学活性研究[J]. 医学研究生学报, 2006, 19(3):217-220.
[8] 陈骞. 牡蛎糖原的提取与抗疲劳活性的研究[D]. 无锡:江南大学, 2005.
[9] 陈骞,杨瑞金,顾聆琳. 牡蛎糖原的研究(Ⅰ)[J]. 食品科学, 2005, 26(6):99-101.
[10] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州:浙江大学出版社, 1998:11-12.
[11] 陈钧辉,陶力,李俊,等. 生物化学实验[M]. 3版. 北京:科学出版社, 2003:59-61.
[12] 阎雪,杨静峰,周大勇,等. 虾夷扇贝内脏多糖SVP-12的分离纯化及性质研究[J]. 食品与发酵工业, 2009, 35(2):172-175.
[13] 徐晗,章蕴毅,张建文,等. 天然产物中的抗补体活性成分[J]. 中国天然药物, 2007, 5(5):322-332.
[14] CATHERINE B, ELIZABETH F, CATHERINE B V, et al. Inhibition of complement activation by natural sulfated polysaccharide(Fucans) from brown seaweed[J]. Molecular Immunology, 1994, 31(4):247-253.
[15] MASASHI T, NAOKO O, RYOKO G, et al. An acidic polysaccharide having immunological activities from the rhizome of Cnidium offtcinale[J]. Chemical and Pharmaceutical Bulletin, 1992, 40(11):2025-2029.
[16] FABIAN B, MARIA C, MARIAC CM, et al. Neatral polysaccharide from Cedrela tubiflora with anticomplementary activity[J]. Phytochemsitry, 1999, 50:57-62.
[17] 陈骞,杨瑞金,顾聆琳. 牡蛎糖原的研究(Ⅱ)[J]. 食品科学, 2005, 26(7):43-46.
