Aeromonas sp. F3胶原酶性质的研究
2011-09-26白杨,钱斯日古楞,王红英,马蕾
白 杨, 钱 斯 日 古 楞, 王 红 英, 马 蕾
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
胶原蛋白独特的三螺旋结构使其结构非常稳定[1],一般的加工温度及短时间加热都不能使其分解,从而造成其消化吸收困难。将胶原蛋白水解为胶原多肽则其在消化吸收、营养、功能特性等方面都会得到显著的提高。利用生物酶降解胶原蛋白是制备小分子胶原蛋白的最佳途径。微生物胶原酶来源广泛,近年来的研究表明,许多土壤、皮毛、海水来源的微生物都能产生胶原酶[2]。目前,应用最广的细菌胶原酶是Clostridiumhistolyticum胶原酶,但其分离纯化较为困难并且经常伴有毒素的产生,更具优势的细菌源胶原酶有待开发。本文所涉及的Aeromonassp. F3是一种海洋微生物,是通过明胶培养基筛选所得到的胶原酶高产菌株,所分泌的胞外酶对胶原蛋白有良好的降解作用。Aeromonassp. F3属于弧菌科的气单胞菌属,是一类接近球状的革兰氏阴性菌,能产生明胶酶[3],本研究是以该菌株出发,发酵获取胶原酶,对该胶原酶的动力学性质,包括酶解条件及其热稳定性进行了初步的探讨,并对该酶水解鱼皮胶原蛋白的产物进行了研究。
1 实 验
1.1 主要材料
产胶原酶菌株Aeromonassp. F3,本实验室从海滩污泥中筛选。鱼皮,大连海洋大学提供。
发酵培养基:葡萄糖3 g/L,酵母浸粉9 g/L,氯化钠5 g/L,硫酸锰10 mg/L。
标准蛋白质,北京索莱宝科技有限公司;其他试剂为国产分析纯。
1.2 方 法
1.2.1 胶原酶生产菌的扩大培养
于保存斜面上挑取一菌环接入种子培养基,种子培养基即LB培养基,于40 ℃、180 r/min下摇瓶培养24 h,4 ℃冰箱保存。将种子培养基接种至发酵培养基中,在最佳产酶条件下(温度40 ℃,初始pH 8.0)振荡培养24 h备用。
1.2.2 胶原酶的提取
取发酵液,在8 000 r/min冷冻离心5 min,去沉淀取上清液。冰浴条件下,边搅拌边缓慢加入乙醇,使乙醇最终达到70%[4],4 ℃静置过夜,8 000 r/min冷冻离心15 min,弃上清液,按照所需的pH以相应的Tris-HCl缓冲液将沉淀复溶,冰箱保存备用。
1.2.3 胶原酶活力测定
取酶液1 mL加入试管中,将试管置于40 ℃水浴锅中预热5 min,加入同样预热5 min的2%酪蛋白溶液l mL,精确计时10 min后加入0.4 mol/L三氯乙酸2 mL终止反应[5]。对照组试管的三氯乙酸在加入酪蛋白溶液之前加入试管。取反应液过滤,用福林法[6]测定酪氨酸浓度,计算相对百分比。
1.2.4 水解效果的研究
取酶液与少量鱼皮混合,在最适温度及pH条件下振荡24 h。酶解反应后将混合液离心去除沉淀,取上清液进行SDS-PAGE电泳分析,确定酶解产物的分子质量。
2 结果与讨论
2.1 pH对酶活的影响
取pH分别为7.7、8.0、8.3、8.6和8.9的酶液,测定相对酶活,确定最佳酶解pH。结果如图1所示,pH 7.7开始,酶活一直上升,pH 8.6时酶活达到峰值,因此最佳pH控制在8.6。
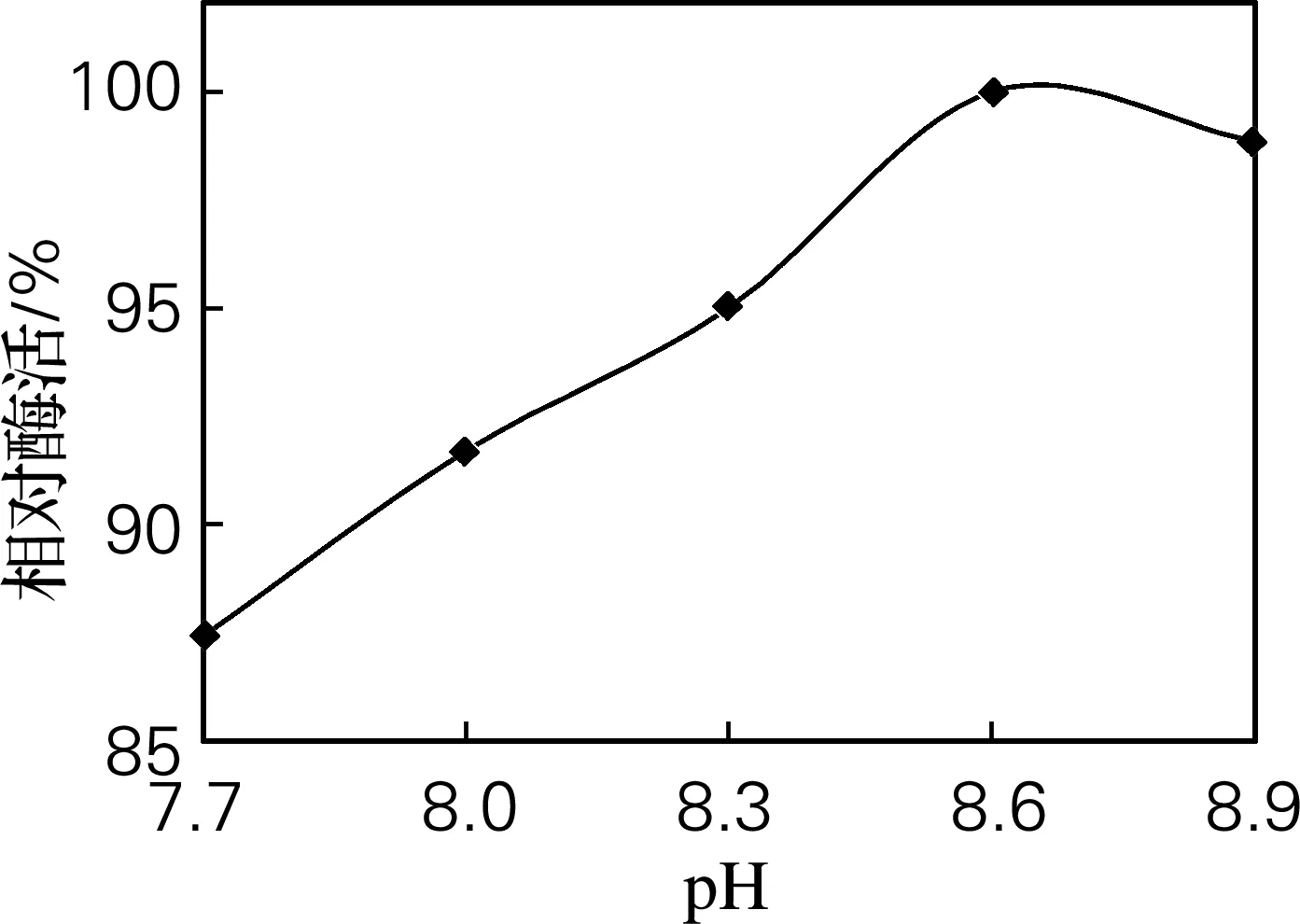
图1 pH对酶活的影响
2.2 胶原酶的热稳定性
取5份酶液,分别以20、30、40、50、60 ℃恒温水浴锅水浴保温40 min,测定残留酶活,确定酶液的热稳定性,结果见图2。由图2可见,20、30、40 ℃处理过的酶液,其剩余酶活差别不大,而50 ℃以上温度处理40 min后的酶液基本失活。
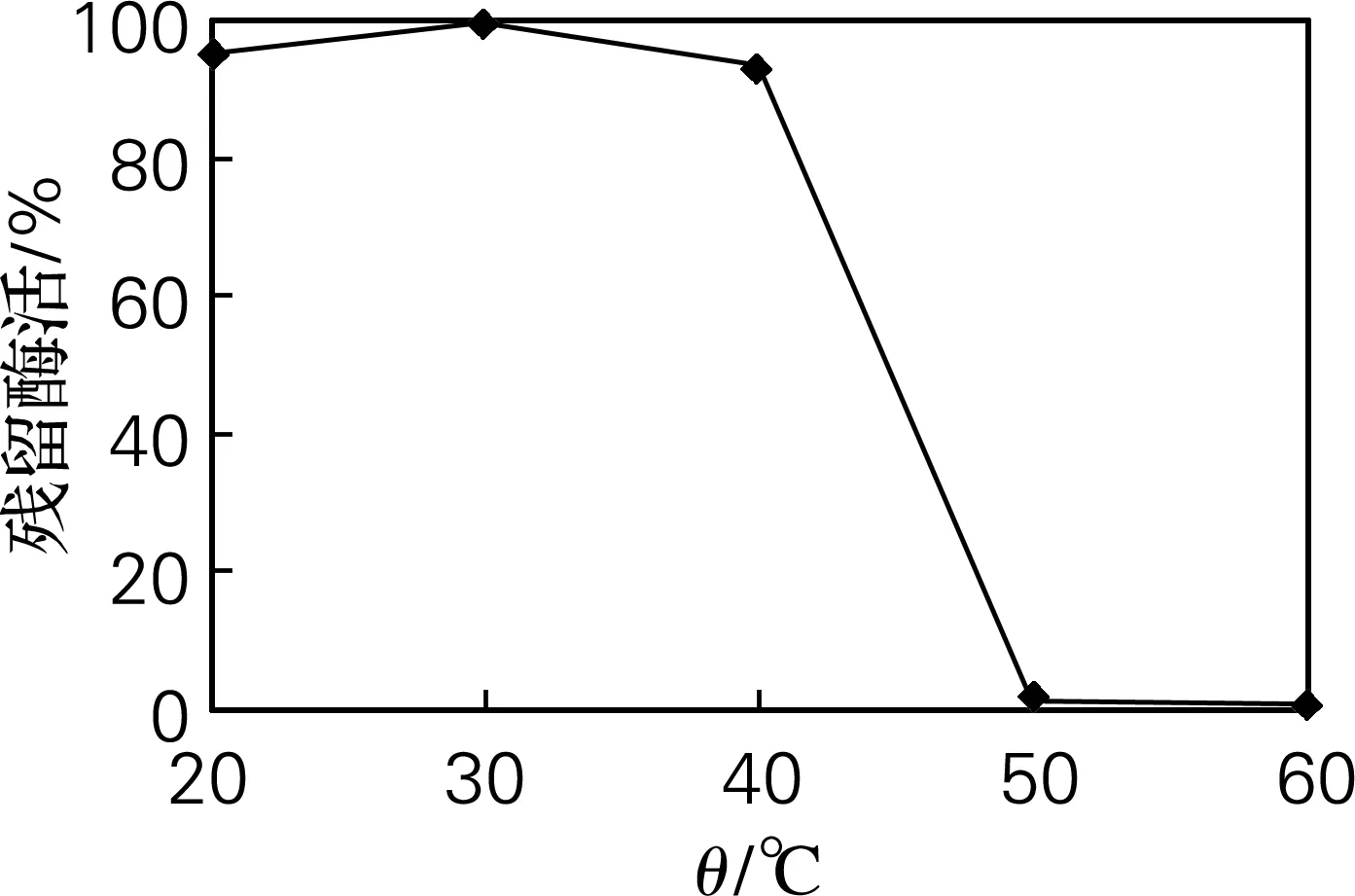
图2 胶原酶的热稳定性
2.3 温度对酶活的影响
取5份酶液,分别以20、30、40、50、60 ℃的酶解反应温度测定酶活,确定酶液的最佳催化温度,结果见图3。由图3可见,在50 ℃时胶原酶的催化能力最强,考虑到50 ℃时的热稳定性,在长期的酶解过程中,40 ℃才是催化温度的合理选择。
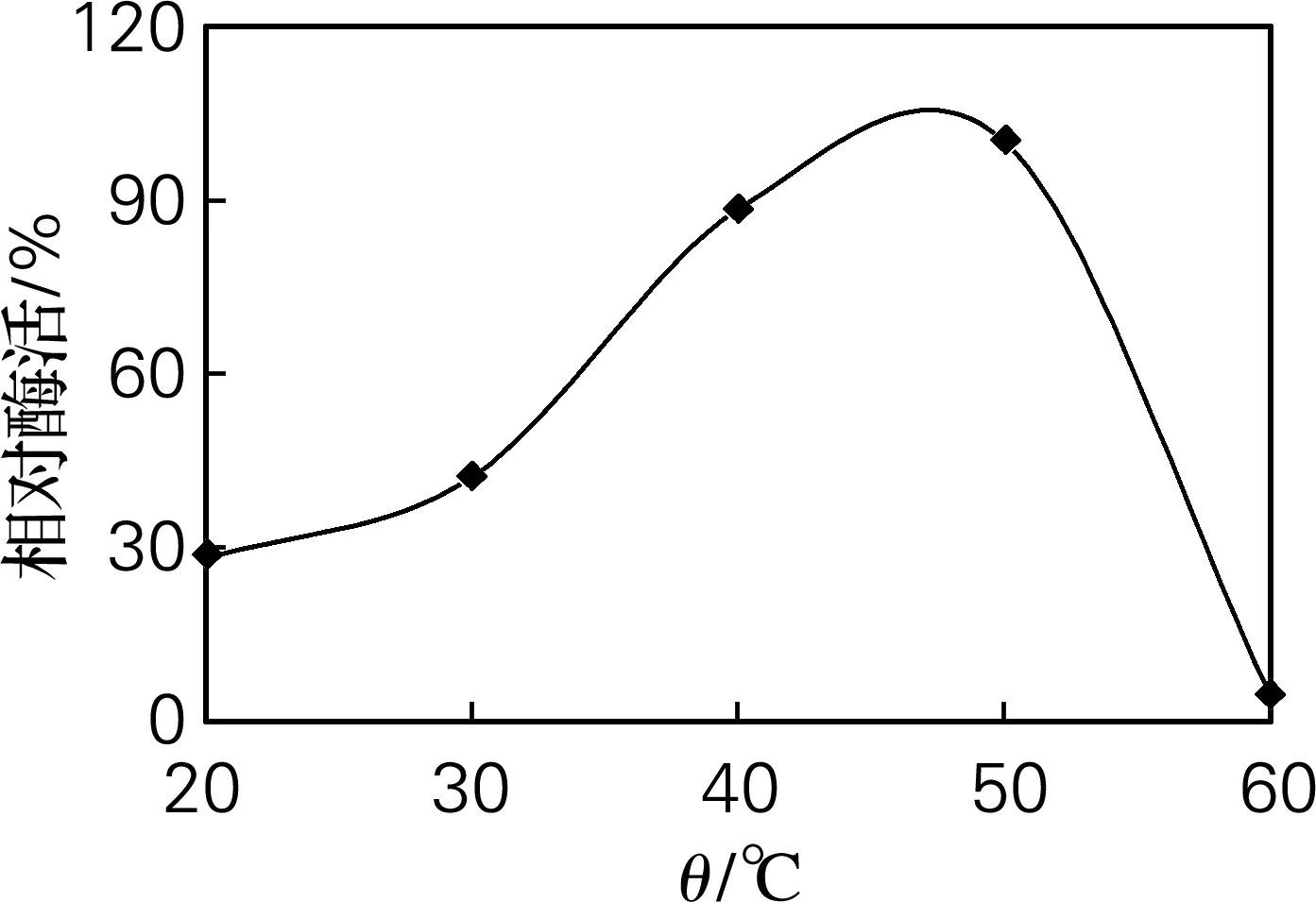
图3 温度对酶活的影响
2.4 金属离子对酶活的影响
分别将酶液加入不同浓度的氯化钙、硫酸镁、硫酸铜、硫酸亚铁、硫酸锌及硫酸锰中,测定相对酶活,确定最佳金属离子及其浓度,结果如图4。由图4可见,其中镁离子以及高浓度的钙离子对胶原酶有轻微的抑制作用;铜离子、亚铁离子、锌离子和锰离子对胶原酶均有不同程度的抑制作用,只有在酶解过程中加入0.5 mmol/L的钙离子,能将酶活提高5%左右。
2.5 Aeromonas sp. F3 胶原酶对鱼皮的水解效果分析
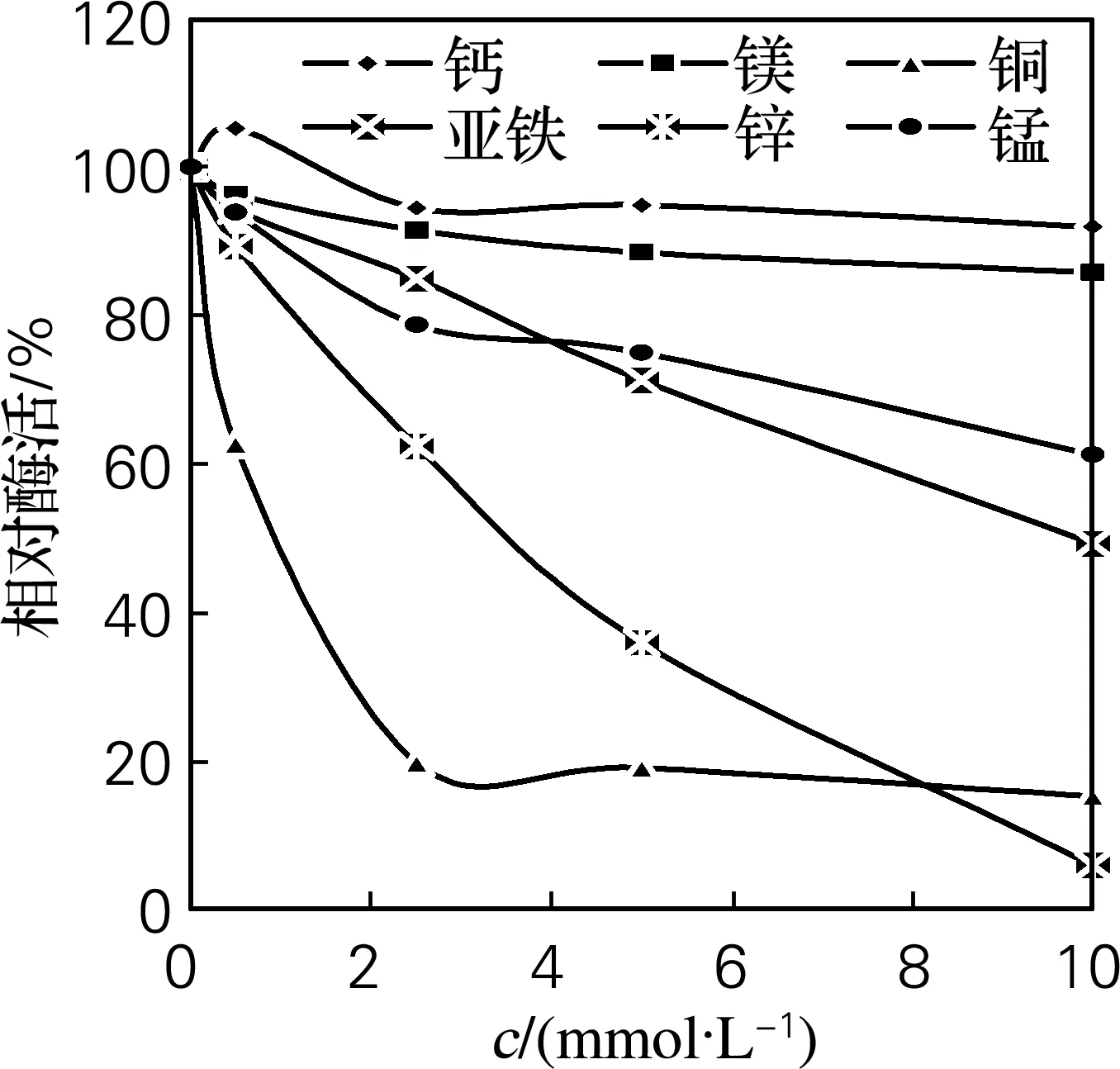
图4 金属离子对酶活的影响
取pH为8.6的酶液,并加入浓度为0.5 mmol/L的氯化钙,与适当鱼皮混合,同时取无菌水与等量鱼皮混合作为对照,将两种混合液在40 ℃、180 r/min条件下反应24 h,以鱼皮与无菌水的混合液作对照。图5为水解后的效果图,由图5可以看出,水解液颜色由澄清变为浑浊,鱼皮也由水解前的片状变为浆状,可见该胶原酶对鱼皮确实具有水解能力。将水解液离心取上清液上样电泳,标准Maker成分为:肌球蛋白200.0 ku;β半乳糖苷酶116.0 ku;磷酸酶b 97.2 ku;牛血清蛋白66.4 ku;卵清蛋白44.3 ku;碳酸苷酶29.0 ku;胰蛋白酶抑制剂20.1 ku,电泳结果见图6。鱼皮经胶原酶水解后的分子质量低于30 ku。

图5 水解效果图

图6 SDS-PAGE电泳图
3 结 论
该菌所产胞外蛋白酶的最佳酶解pH为8.6,在pH 9.0附近,胶原酶仍具有很大活性,体现了海洋酶耐碱的特点。50 ℃以上时,该胶原酶的稳定性不佳,40 min之内基本完全失活。短时间内的酶解反应过程中,50 ℃的条件能使酶活达到最高,但是具体实验过程中,时间都超过1 h甚至更长,参照该酶的热稳定性,40 ℃才是酶解反应的最佳选择。
有研究指出,钙离子对一千多种蛋白酶都有促进作用,且其促进作用与浓度有很大关系[7]。本实验也可以看出,在提及的6种金属离子,在浓度不同时,每种金属离子对酶活的影响都不尽相同。其中只有钙离子在低浓度时对酶活有一定的促进作用,但是其影响不大。
参照最佳酶解条件,用粗提的胶原酶对鱼皮进行水解反应,效果是比较好的,水解液从之前的较为澄清变得浑浊,可见粗提的酶液对鱼皮确实有水解作用。从水解产物分子质量的角度来看,产物的分子质量只达到了30 ku左右,相对较大。考虑用两步酶法[8]进行降解,会达到更好的效果。
[1] 王丽娜,黄素珍. 胶原蛋白的研究进展[J]. 肉类研究, 2010(1):16-22.
[2] 诸葛健. 工业微生物实验技术手册[M]. 北京:中国轻工出版社, 1994:145-147.
[3] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:106-120.
[4] 郝伟,王璋,蔡慧农. 微生物谷氨酰胺转胺酶沉淀分离方法的研究[J]. 食品科学, 2006, 27(10):331-334.
[5] 李陈,吴琦,陈惠. 胶原蛋白酶活性的测定方法[J]. 中国皮革, 2008, 37(11):24-25,30.
[6] 中华人民共和国商业部. ZB x 66030-87. 中华人民共和国专业标准蛋白酶活力测定法[S]. 北京:中国标准出版社, 1987.
[7] 吴京平. 金属离子对蛋白酶活力和热稳定性的影响[J]. 中国皮革, 2004, 33(11):32-34.
[8] 吕凌云,马兴元,蒋坤,等. 从皮革废弃物中提取胶原蛋白及其高值化应用的研究进展[J]. 西部皮革, 2010, 32(15):46-51.
