12味药食两用中药抑制α-葡萄糖苷酶作用研究
2011-09-26朱文佳,朱林敏,周锋伟,付绍平,朱靖博
朱 文 佳, 朱 林 敏, 周 锋 伟, 付 绍 平, 朱 靖 博
( 大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034 )
0 引 言
目前,全球有2.46亿糖尿病患者,而中国是继印度之后的第二大糖尿病国家。餐后高血糖是糖尿病患者的早期症状,是加重糖尿病并引发并发症进而导致死亡的主要因素[1]。流行病学研究发现,餐后高血糖是增加心血管疾病死亡的主要因素[2]。α-葡萄糖苷酶抑制剂通过抑制小肠刷状缘α-葡萄糖苷酶的活性,延缓葡萄糖的生成和吸收,因而可有效降低餐后高血糖[3]。
临床应用的α-葡萄糖苷酶抑制剂多是生物合成或半生物合成药,种类少、价格贵、副作用大[4]。药食两用植物在我国有着悠久的食用历史,安全、可靠、有效[5],而且我国拥有得天独厚的中医食疗理论,因此从药食两用中药中筛选出高效、低毒、经济的α-葡萄糖苷酶抑制剂越来越显示出其重要性和迫切性。
本研究首次应用HPLC对具有糖尿病治疗效果的12味药食两用中药进行了α-葡萄糖苷酶抑制活性的评价,为了比较全面的评价药食两用中药的α-葡萄糖苷酶抑制活性,研究选择5种溶剂对每味中药进行系统提取,然后测定每个提取部位对α-葡萄糖苷酶的抑制率,为药食两用中药的综合利用和开发提供了可靠的实验数据。
1 材料与方法
1.1 材料与设备
12种药食两用中药购于河北安国中药材市场,详细药材信息见表1;对-硝基苯基-α-D-吡喃葡萄糖苷,PNPG,纯度99%,Sigma公司;α-葡萄糖苷酶,EC 3.2.1.20,面包酵母,纯度≥10 U/mg,Sigma公司;牛血清白蛋白,BSA,纯度≥95%,Sigma公司;阿卡波糖,Acarbose,批号AC-0808040,湖南新汇制药有限公司;其余试剂均为分析纯。
HWS 26型电热恒温水浴锅,上海一恒科技有限公司;SK-1型快速混匀器,常州国华仪器有限公司;PNS-3C型pH酸度计,上海鹏顺科学仪器有限公司;UltiMate 3000高效液相色谱分析仪,美国DIONEX公司;微量进样器,宁波市镇海玻璃仪器厂;1.5 mL离心管,美国Axygen公司;0.45 μm虑膜,上海密粒膜分离技术有限公司;滤纸,定性滤纸,杭州特种纸业有限公司。
1.2 方 法
1.2.1 中药提取物的制备
依次选择正己烷、二氯甲烷、乙酸乙酯、甲醇、水5种溶剂对12味药食两用中药进行系统提取:中药经烘干,粉碎后准确称量200 g,按照中药质量与溶剂体积的比为1∶4超声提取1 h,滤纸过滤,提取溶液用旋转蒸发仪浓缩,浸渣用下一种溶剂继续提取。经系统提取,中药所含成分按照极性大小分配到5个提取部位中,分别是正己烷提取部位(NH)、二氯甲烷提取部位(MC)、乙酸乙酯提取部位(EA)、甲醇提取部位(ME)、水提取部位(AQ)。
1.2.2 反应溶液的制备
0.067 mo1/L pH 6.8的磷酸盐缓冲液:将7.646 g K2HPO4·3H2O,4.559 g KH2PO4溶解于超纯水中,调整pH至6.8,用超纯水定容于500 mL容量瓶中,4 ℃低温保藏。
0.1 U/mL含0.2% BSA的α-葡萄糖苷酶:称取0.001 g固体酶,用含0.2% BSA上述磷酸缓冲溶液定容于10 mL容量瓶中,-20 ℃冻存,使用时低温解冻并稀释5倍使用。
8 mmol/L的PNPG:精密称取0.024 g PNPG,用缓冲溶液定容于10 mL容量瓶中,4 ℃低温保藏。
0.2 mol/L的Na2CO3终止剂:称取2.12 g Na2CO3,用超纯水溶解,定容于100 mL容量瓶中。
1.2.3 α-葡萄糖苷酶抑制活性的测定
依据传统的Tremblay[6]法,以PNPG为底物,通过HPLC检测水解产物4-硝基酚(p-Nitrophenol,PNP)的变化,确定α-葡萄糖苷酶的活性。实验在1.5 mL离心管中进行,反应总体积为160 μL:10 μL 0.067 mol/L pH 6.8的磷酸盐缓冲溶液、30 μL 0.1 U/mL α-葡萄糖苷酶,振荡混匀,37 ℃孵育20 min,加入40 μL 8.0 mmol/L PNPG开启反应,震荡混匀,37 ℃反应30 min后,加入80 μL 0.2 mol/L Na2CO3终止反应,加超纯水稀释至500 μL,振荡混匀,经0.45 μm膜过滤后,用HPLC检测,通过产物PNP的浓度变化,计算α-葡萄糖苷酶的活性。
选择合适的试剂溶解各味中药的提取部位作为待测样品,以相同体积的待测样品代替缓冲溶液加入到反应体系中。测试各个提取部位对α-葡萄糖苷酶的抑制活性,同时设置阳性对照(以等体积的Acarbose代替磷酸盐缓冲溶液)、空白对照(以等体积的磷酸盐缓冲溶液代替酶液),按照下式计算抑制率:
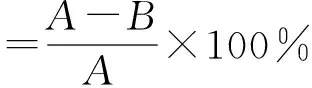
式中,A为不加待测样品时PNP的浓度(扣除相应空白,mmol/L);B为加入待测样品后PNP的浓度(扣除相应空白,mmol/L)。
1.2.4 PNP的HPLC定量分析
色谱条件:Sino Chrom ODS-BP色谱柱,5 μm,4.6 mm×250 mm,大连依利特分析仪器有限公司;流动相:A为乙腈,B为含0.1%甲酸的水溶液,梯度洗脱条件为:0~8 min,20%~30% A;8~13 min,30%~80% A;13~18 min,80%~20% A;18~28 min,20% A;流速,1.0 mL/min;进样量,20 μL;柱温,常温;检测波长,314 nm。
PNP标准曲线:精确称取0.020 9 g PNP标准品,用磷酸盐缓冲溶液超声溶解,定容于25 mL容量瓶中,配置成6 mmol/L的PNP母液,将母液稀释成0.002 5、0.005、0.01、0.05、0.1、0.2、0.4、0.8 mmol/L。按照上述色谱条件测定,以浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线。
1.2.5 样品溶剂的选择
向反应体系中分别加入5和10 μL的甲醇、二甲基亚砜(DMSO)和丙酮,测定3种溶剂对α-葡萄糖苷酶的抑制效果。
1.2.6 中药提取物对α-葡萄糖苷酶抑制活性的测定
12味中药经系统溶剂提取共获得60个提取部位,水提取部位用水溶解,其他提取部位根据“1.2.5”的方法,选择对酶活性影响较小的溶剂溶解。每个提取部位的初始测定浓度为64 mg/mL(反应体系中加入α-葡萄糖苷酶之前的浓度),按照“1.2.3”的方法测定每个提取部位对α-葡萄糖苷酶的抑制作用,对抑制活性较高的提取部位(抑制率为100%)按照相同的方法,浓度稀释10倍后进一步测定。
2 结果与讨论
2.1 PNP标准工作曲线
按照“1.2.4”的方法绘制标准曲线,求得回归方程为y=197.4x+0.819 3,R2=0.999 8,说明PNP在0.002 5~0.8 mmol/L线性关系良好。
2.2 有机溶剂对α-葡萄糖苷酶活性的影响
甲醇、DMSO、丙酮是α-葡萄糖苷酶抑制剂筛选中常用的样品溶媒,在低浓度范围内对酶活性影响较小[7-9]。本研究中,反应体系中加入5 μL溶剂时,DMSO对α-葡萄糖苷酶活性有轻微抑制作用,丙酮基本全部抑制了α-葡萄糖苷酶的活性,而甲醇对α-葡萄糖苷酶的活性却有一定的激活作用;当加入体积增加到10 μL时,试剂基本全部抑制了α-葡萄糖苷酶的活性,如表2所示,因此,实验选择甲醇、DMSO溶解非水提取部位,同时设置甲醇和DMSO的阴性对照(以等体积的甲醇和DMSO代替磷酸盐缓冲溶液)。

2.3 中药提取部位对α-葡萄糖苷酶的抑制作用
阳性药物Acarbose在64、6.4和0.64 mg/mL时对α-葡萄糖苷酶的抑制率分别为76.42%、21.29%、8.73%,相同条件下12种中药的60个提取部位对α-葡萄糖苷酶均表现出不同程度的抑制活性,质量浓度64 mg/mL时有31个组分抑制率达到100%,占筛选总量的51.6%,将这些组分浓度稀释到6.4 mg/mL进行第2次测定,其中8个组分抑制活性达到100%,占筛选总量的13%,将这些组分浓度稀释到0.64 mg/mL进行第3次测定,具体抑制率如表3所示,丁香和肉桂的5个提取部位都具有较高的抑制活性,枸杞子的5个提取部位抑制率普遍较低;丁香和肉桂的水提取部位、榧子的甲醇和水提取部位在0.64 mg/mL抑制活性显著,抑制率均在95%以上。
3 结 论
本文以PNPG为底物,通过HPLC定量分析水解产物PNP,确定α-葡萄糖苷酶的活性,实验研究了12味药食两用中药的60个提取部位对α-葡萄糖苷酶的抑制活性,筛选出了对α-葡萄糖苷酶有显著抑制效果的8个活性部位,研究发现,12味中药的提取物对α-葡萄糖苷酶均有不同程度的抑制效果,丁香和肉桂的每个活性部位都具有较强的抑制活性。具有抑制活性的提取物中,极性较大组分往往活性较高,有可能是一些糖类或糖类衍生物的竞争性抑制作用;前人研究较少的低极性组分也有一定的抑制活性,一般为黄酮类、生物碱类或萜类化合物[10],这些化合物可能与α-葡萄糖苷酶存在新的作用方式,在抑制类型上可能较多的是非竞争性抑制[11-12],有待进一步的研究证实,相关活性物质的进一步分离和结构鉴定工作正在进行中。

表3 中药提取物对α-葡萄糖苷酶的抑制率
[1] CERIELLO A, COLAGIURI S. Guideline for the management of pose-meal blood glucose[J]. Diabetes Voice, 2007, 52(3):9-11.
[2] RAJU B C, TIWARI A k, KUMAR J A, et al. α-Glucosidase inhibitory antihyperglycemic activity of substituted chromenone derivatives[J]. Bioorganic & Medicinal Chemistry, 2009, 47:1-8.
[3] 顾觉醒,陈紫娟. α-葡萄糖苷酶抑制剂的研究与应用[J]. 药学进展, 2009, 33(2):62-67.
[4] 马燕燕,鲁晓翔. 天然产物α-葡萄糖苷酶抑制剂筛选研究进展[J]. 粮食与油脂, 2010(6):7-10.
[5] 佘世望,肖小年,范青生,等. 60种药食两用植物抗氧化作用研究[J]. 食品科学, 1995, 16(11):3-5.
[6] CHAPDELAINE P, TREMBLAY R R, DUBE J Y. P-nitrophenol-α-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J]. Chinical Chemistry, 1978, 24(2):208-211.
[7] LEE D S. Dibutyl phthalate, an α-glucosidase inhibitor from streptomyces melanosporofaciens[J]. Journal of Bioscience and Bioengineering, 2000, 89(3):271-273.
[8] 杨付梅,孙黔云. α-葡萄糖苷酶抑制剂微量筛选模型的正交法构建和筛选[J]. 中国药理学通报, 2009, 25(8):1113-1116.
[9] 王继国. 中药血竭化学模式识别及α-葡萄糖苷酶抑制成分亲和筛选研究[D]. 上海:上海大学, 2004.
[10] 陈静,程永强,刘晓庆,等. 食品中α-葡萄糖苷酶抑制剂的研究进展[J]. 食品科学, 2007, 28(4):360-362.
[11] 李改利. 扩大π-体系呫吨酮衍生物的设计合成及其与α-葡萄糖苷酶的相互作用[D]. 广州:中山大学, 2009.
[12] 康文艺,张丽. 五种苦苣苔科植物α-葡萄糖苷酶抑制活性研究[J]. 天然产物研究与开发, 2010, 22(1):122-125.
