碱性[Bmim]Im离子液体催化合成DEHC
2011-09-26潘素娟,王大鸷,于长顺,李炎龙,张绍印
潘 素 娟, 王 大 鸷, 于 长 顺, 李 炎 龙, 张 绍 印
( 大连工业大学 化工与材料学院, 辽宁 大连 116034 )
0 引 言
碳酸二异辛酯(DEHC) 是一种无色清洁油,具有强极性酯基、良好润滑性能、较低的凝固点及倾点(-63 ℃)、与烃类油相容性好以及高热氧化稳定性等优点[1],因此,研究人员认为DEHC在合成基础油领域具有应用价值。另外,DEHC对200~350 nm的紫外光具有较强的吸收作用,与其他酯相比不易皂化,并可快速地进行生物降解,使其在日用化工当中的应用也备受重视。
关于DEHC合成的报道不多,均由DMC与EHOH通过两步酯交换法催化合成。所用的催化剂总结起来可分为两大类: 路易斯酸和强碱,如碱金属醇盐[2]、金属氧化物[3]、碳酸盐、碘化钾以及钛酸酯[4]等。固体碱催化反应虽然具有产物易于分离的优点,但催化剂制备和回收利用的工序复杂,极易被大气中的CO2和H2O等杂质污染,且DEHC的收率偏低,原料循环利用效率低下[5]。所以,开发新型的绿色催化剂,提高DEHC合成选择性和收率,成为目前酯交换法合成DEHC亟待解决的技术问题之一。
离子液体作为绿色化学是具有发展前景的研究方向之一,可充当环境友好型催化剂,近年来在精细化学品合成领域受到了广泛关注[6-9]。本文采用1-丁基-3-甲基咪唑阳离子与咪唑阴离子搭配的碱性[Bmim]Im离子液体为催化剂,通过碳酸二甲酯(DMC)与异辛醇(EHOH)的两步法反应,合成出高收率和高纯度的DEHC。考察了催化剂用量、醇酯比、反应时间和反应温度对DEHC收率的影响。在确定最佳反应条件的同时,验证了离子液体作为新型催化剂催化酯交换反应的可行性。
1 实 验
1.1 试剂及仪器
[Bmim]Im[6]离子液体,实验室自制;DMC,分析纯,国药集团化学试剂有限公司;乙酸乙酯、甲醇、乙醚、EHOH,分析纯,天津市瑞金特化学品有限公司,所有试剂均未进行后续处理。
DF-101S集热式恒温加热磁力搅拌器、RE-2000A旋转蒸发器,河南巩义予华仪器有限公司;Spectrum One-B型傅里叶变换红外光谱仪,美国珀金埃尔默公司;Varian INOVA 400 MHz核磁共振仪,美国Varian仪器公司;GF7890F型气相色谱仪,上海天美科学仪器有限公司。
1.2 合成方法
1.2.1 DEHC的合成
在装有搅拌器、温度计、冷凝管、恒压滴液漏斗的250 mL四口烧瓶中,加入EHOH和一定量的[Bmim]Im,加热升温至90 ℃,缓慢匀速滴加DMC,约1 h滴完,保持90 ℃反应一定时间后,接入分水器将反应生成的甲醇和未反应的DMC蒸出。然后升温至110~130 ℃反应4 h,反应结束后经冷却、减压蒸馏后,静置分层。下层棕色黏稠状液体回收,得到可循环使用的[Bmim]Im型离子液体。上层液体在532 Pa下减压蒸馏,收集190 ℃无色液体得到DEHC。
1.2.2 产物的表征
气相色谱仪使用极性毛细管色谱柱(0.25 mm×30 m),填料为聚乙二醇,氢火焰离子化检测器, N2作为载气。检测条件为:炉温设定70~200 ℃,采用程序升温,升温速率10 ℃/min,进样温度为240 ℃,检测器温度270 ℃。
使用Spectrum One-B型傅里叶变换红外光谱仪,采用液膜法对产物进行结构表征。扫描波数范围为4 000~400 cm-1。
以CDCl3为溶剂,用Varian INOVA 400 MHz核磁共振仪对产物进行氢谱测定。
2 结果与讨论
2.1 正交试验设计及优化试验结果
离子液体[Bmim]Im催化酯交换反应尚无正式的文献报导。试验中参考了固体碱催化剂催化合成DEHC的工艺[2-4],选择了醇酯比、催化剂用量、步骤一反应时间、步骤二的反应温度作为条件因素,采用4因素3水平正交试验进行了反应条件优化。因素水平见表1,正交试验结果见表2。

表1 酯交换正交试验因素水平表
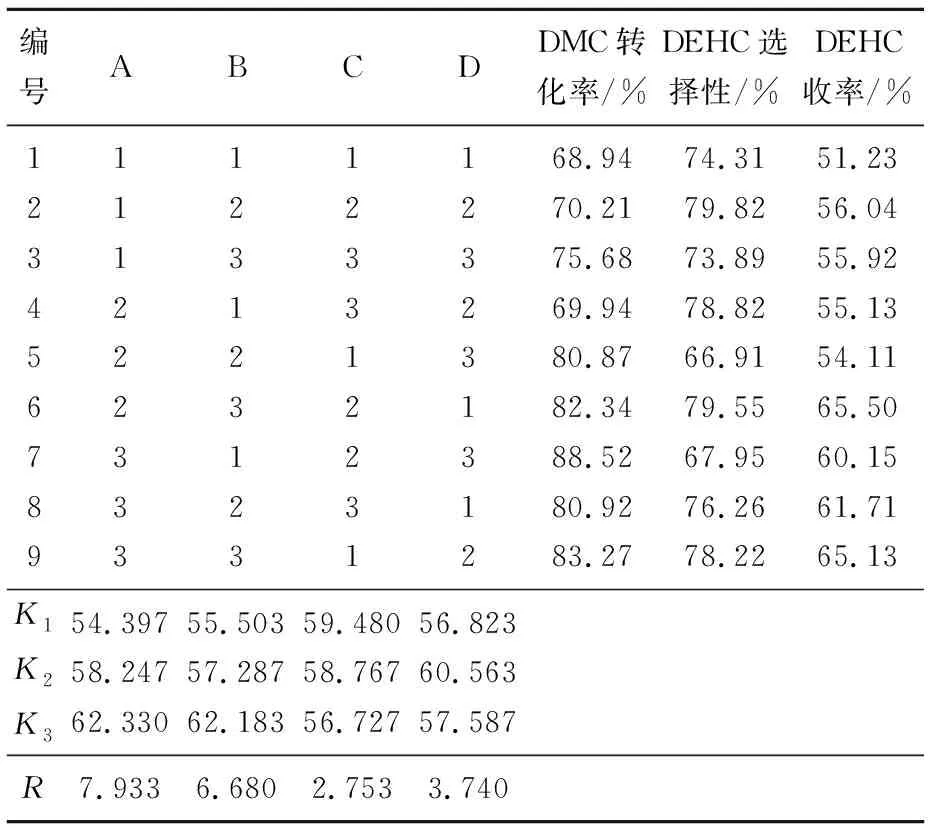
表2 酯交换正交试验结果
由正交试验结果可以看出,在上述4个考察因素中,对DEHC收率的影响次序为:催化剂用量(A)>醇酯比(B)>第二步反应温度(D)>第一步反应时间(C)。其优位级组合为A3B3C2D2。
以优位级组合为反应条件,即EHOH与DMC的摩尔比4∶1、催化剂用量为反应原料总质量的2.0%、第一步反应温度90 ℃,反应时间2 h、第二步反应温度120 ℃,反应时间4 h重复酯交换反应,所得产品的收率为66.15%。
2.2 DEHC的红外光谱及1H核磁共振分析


图1 [Bmim]Im催化合成DEHC的傅里叶红外光谱图谱(优化条件下)
在图2的1H核磁共振谱图中,化学位移δ在4.05×10-6处多重峰对应CH2O中的4个H,1.61×10-6处的两重峰对应CH中的2个H,1.30×10-6处的多重峰对应CH2中的16个H,0.90×10-6处的三重峰对应CH3中的12个H。H总数与DEHC中的H个数与位置相符合。
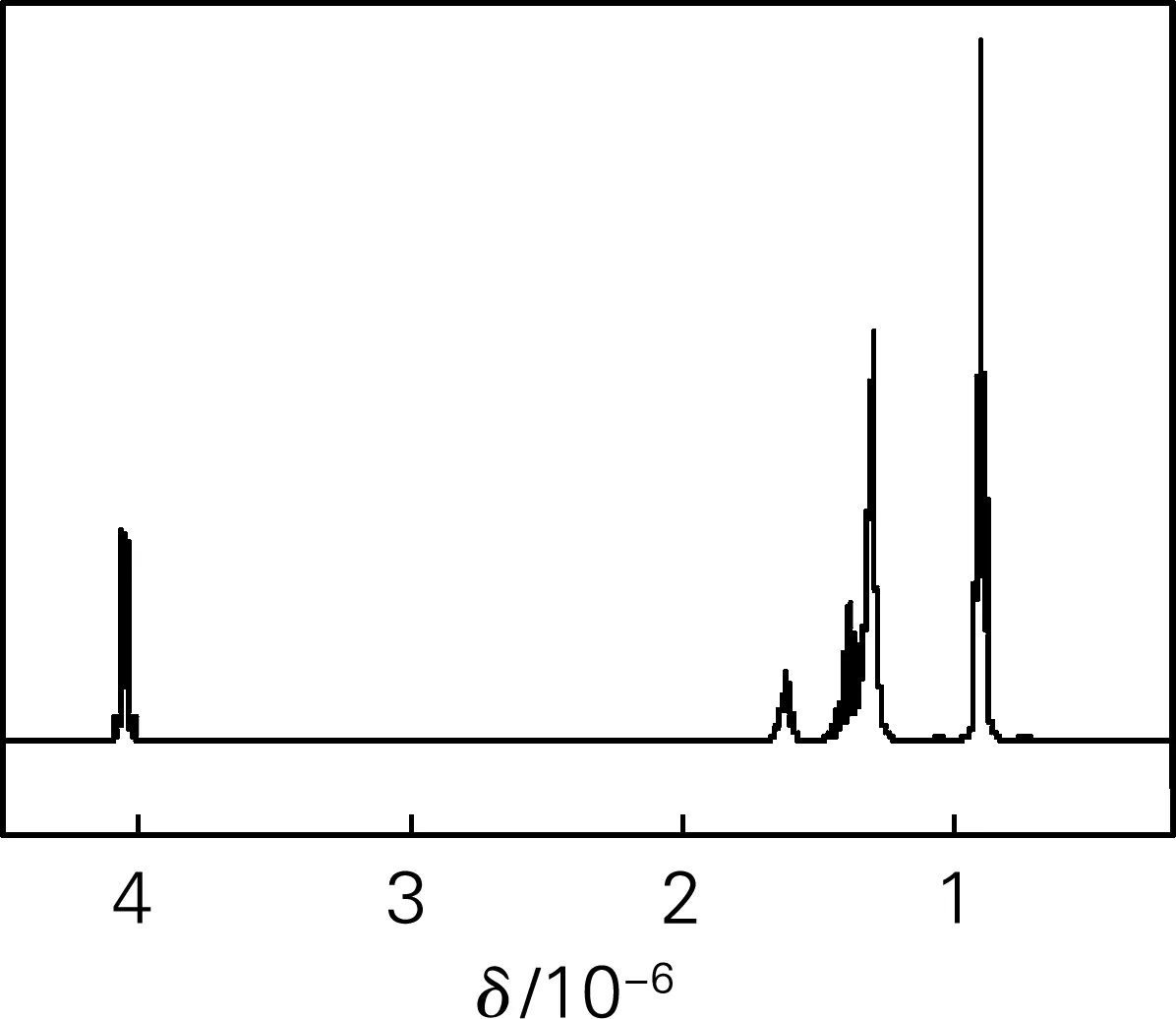
图2 [Bmim]Im催化合成DEHC的1H核磁共振谱图(优化条件下)
2.3 DEHC的气相色谱分析
在前述气相色谱条件下,DMC、EHOH与DEHC的柱留时间分别为1.713、5.833和13.013 min。使用外标法计算表明DEHC的纯度>99%。色谱图中没有出现其他杂质峰,表明[Bmim]Im可以完全得到分离与回收。
2.4 [Bmim]Im的重复使用催化效率实验
对回收的[Bmim]Im进行了重复催化效率实验。将体系分液后,下层催化剂层不经过任何处理,直接用于重复性酯交换催化反应。由于[Bmim]Im离子液体在处理过程中有一定的损耗,因此在考察离子液体催化剂循环利用效率的实验中每次补加0.2 g [Bmim]Im。
由图3可以看出,催化剂经过6次重复使用之后,催化酯交换反应制备DEHC的收率变化小于0.5%,说明[Bmim]Im的热稳定性较好,且具有良好的循环使用性能。

图3 催化剂的重复使用实验结果
2.5 反应机理探讨
[Bmim]Im催化DMC与EHOH的反应机理属于一种亲核取代反应过程。结合气相色谱结果及Gryglewicz[2]、Shaikh[10]、Tundo[11]和王庆印[12]提出的催化机理,作者提出反应机理如下:咪唑阴离子作为一种很好的亲核试剂进攻DMC,生成CH3OCOIm和甲氧基阴离子咪唑离子液体[Bmim]OCH3,[Bmim]OCH3与异辛醇发生质子交换得到[Bmim]OC8H16和甲醇,甲醇被及时蒸出,促进平衡移动,得到的[Bmim]OC8H16进攻CH3OCOIm,咪唑阴离子基团离去,得到异辛基碳酸甲酯和[Bmim]Im。升温后,咪唑阴离子再进攻异辛基碳酸甲酯,重复上述过程得到产物DEHC和[Bmim]Im的混合物。静置分层后,回收[Bmim]Im离子液体。上层液体经减压蒸馏得到纯度>99%的DEHC。
3 结 论
(1)[Bmim]Im离子液体催化DMC与EHOH酯交换生成DEHC的最佳条件为:催化剂用量为原料总质量的2.0%,醇酯摩尔比为4∶1,步骤一反应温度90 ℃,反应时间2 h,步骤二反应温度120 ℃,反应时间4 h。DEHC的收率为66.15%。
(2)采用红外光谱、核磁共振等对产物的结构进行表征,分析结果表明产品结构正确,且利用气相色谱分析可知,产品纯度>99%。
(3)碱性离子液体[Bmim]Im对DMC与EHOH酯交换反应具有优异的催化性能,与固体碱催化剂相比,[Bmim]Im的催化活性高、选择性好,且属于“绿色”催化剂,在碳酸酯与醇酯交换反应中有一定的实用价值。
[1] 田恒水,朱云峰,郝晔,等. 制备碳酸二烷基酯的方法:中国,200510026042.3[P]. 2005-11-23.
[2] GRYGLEWICZ S, OKO F A, GRYGLEWICZ G. Synthesis of modern synthetic oils based on dialkyl carbonates[J ]. Industrial and Engineering Chemistry Research, 2003, 42:5007-5010.
[3] 任勃,李茹民,高路杨,等. CaO/ZrO2-La固体碱催化合成碳酸二异辛酯[J]. 化学工程师, 2007, 136(1):1-5.
[4] 冯秀丽,王庆印,刘绍英,等. 钛酸钾催化DMC酯交换反应合成碳酸二异辛酯的研究[J]. 工业催化, 2006, 14(9):37-40.
[5] 李向召,江琦. 固体碱催化剂研究进展[J]. 天然气化工, 2005, 30(1):42-48.
[6] 陈学伟,李雪辉,宋红兵,等. 咪唑阴离子型碱性离子液体的合成及其催化Knoevenagel缩合反应[J]. 催化学报, 2008, 29(10):957-959.
[7] MACFARLANE D R, PRINGLE J M, JOHANSSON K M, et al. Lewis base ionic liquids[J]. Chemical Communications, 2006, 67:1905-1917.
[8] MASAHIRO Y F, KATARINA J, PETER N, et al. Novel Lewis-base ionic liquids replacing typical anions[J]. Tetrahedron Letters, 2006, 47:2755-2758.
[9] XU Jian-ming, QIAN Chao, LIU Bo-kai, et al. A fast and highly efficient protocol for Michael addition of N-heterocycles to α, β-unsaturated compound using basic ionic liquid [Bmim]OH as catalyst and green solvent[J]. Tetrahedron, 2007, 63:986-990.
[10] SHAIKH A A G, SIVARAM S. Dialkyl and diaryl carbonates by carbonate interchange reaction with dimethyl carbonate[J]. Industrial and Engineering Chemistry Research, 1992, 31:1167-1170.
[11] TUNDO P, TROTTA F, MORAGLIO G, et al. Continuous-flow processes under gas-liquid phase-transfer catalytic (GL-PTC) conditions:The reaction of dialkyl carbonates with phenols, alcohols, and mercaptans[J]. Industrial and Engineering Chemistry Research, 1988, 27:1565-1571.
[12] 王庆印, 钱锦华, 姚洁, 等. KI催化酯交换合成碳酸二正辛酯的研究[J]. 分子催化, 2005, 19(6):463-467.
