人参皂苷Rg3与Rg5的分离及Rg3异构体的拆分
2011-09-26田桐,宋建国,赵慕,鱼红闪,金凤燮
田 桐, 宋 建 国, 赵 慕, 鱼 红 闪, 金 凤 燮
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连工业大学 化工与材料学院, 辽宁 大连 116034 )
0 引 言
人参皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1是红参中微量含有的人参稀有皂苷,具有抗癌[1-4]、抗血栓[5-6]和提高免疫力[7-8]等功效。红参加工过程中,二醇类皂苷Rb1、Rb2、Rc、Rd等受热或在微酸环境中,微量地转化为20(S)-Rg3、20(R)-Rg3、Rg5、Rk1。人参二醇类皂苷Rb1等受热时,部分水解可生成20(S,R)-Rg3,20(S,R)-Rg3在20位碳上的-OH和22位碳上的-H进一步脱水而在20位和22位碳之间形成双键,产生反式和顺式的异构体,即Rg5和Rk1[9]。
目前,对单体皂苷20(S)-Rg3、20(R)-Rg3、Rg5、Rk1药效的研究很少,主要是因为上述皂苷单体制备难度大,因此采用合理的方法分离得到20(S)-Rg3、20(R)-Rg3、Rg5、Rk1单体是非常必要的。本实验室李海燕[10]用皂苷糖基的酯化方法拆分了20(S)-Rg3和20(R)-Rg3;大连化物所的李鹏等[11]利用2种异构体在不同浓度的乙醇溶液中,利用溶解度的差异实现了20(S)-Rg3、20(R)-Rg3两者的分离;但目前还没有对20(S)-Rg3、20(R)-Rg3、Rg5和Rk1的分离形成系统性研究。本实验根据红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1混合物中各组分的溶解度不同,先分离出20(R)-Rg3;然后采用硅胶柱层析法分离20(S)-Rg3、Rg5和Rk1;进一步采用结晶法,精制得到20(S)-Rg3、20(R)-Rg3单体。本论文对研究各组分的药效及其结构与药效的关系很有意义。
1 材料与方法
1.1 材 料
红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5、Rk1的混合物,人参皂苷标准品20(S)-Rg3、20(R)-Rg3、Rg5、Rk1,由本实验室提供;薄层层析板Silica Gel 60-F254,德国Merck公司生产;硅胶,青岛海洋化工厂生产;其他化学试剂均为分析纯,天津科密欧公司生产。
1.2 方 法
1.2.1 分离方法
为了获得红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1的混合物中各组分单体,利用混合物中各组分溶解度的不同,先分离出20(R)-Rg3。然后采用硅胶柱层析法分离20(S)-Rg3、Rg5和Rk1皂苷。再采用重结晶法分别对已分离出的20(S)-Rg3、20(R)-Rg3进行精制。
1.2.1.1 硅胶柱层析法
将20(S)-Rg3、Rg5和Rk1混合物用甲醇溶解,加入80~100目硅胶,水浴蒸干,不断搅拌,直至硅胶复为粉末状。取300~400目硅胶作分离胶,在玻璃柱内铺放均匀后,装入样品胶,最上层置脱脂棉。先用氯仿通柱,再按照V(氯仿)∶V(甲醇)=8.5∶1.5的洗脱剂进行洗脱,TLC检测分离结果,将相同成分的洗脱液收集,浓缩蒸干。
1.2.1.2 20(S)-Rg3与20(R)-Rg3粗品的精制
为得到单体,采用重结晶法分别对已分离出的20(S)-Rg3、20(R)-Rg3粗品进行精制。
20(S)-Rg3粗品的精制:加入80%甲醇溶液,加热搅拌使其充分溶解,自然冷结晶,过滤结晶,干燥后称重。
20(R)-Rg3粗品的精制:加入吡啶与甲醇混合溶液,加热搅拌使其充分溶解后,加水至浓度达到90%,自然冷结晶,过滤结晶,干燥后称重。
1.2.2 分析方法
1.2.2.1 薄层层析法(TLC)检测样品中所含皂苷成分
将人参皂苷溶于甲醇中,微量点样器吸取标准品及样品,点样于薄层层析板,然后置于层析缸中展开,展开剂:V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5。用10%硫酸溶液加热显色。通过对照样品斑点与标准品斑点来确定样品中所含皂苷成分。
1.2.2.2 高效液相色谱法(HPLC)测定人参皂苷单体的纯度
色谱仪,Waters 2695高效液相色谱分析仪,Waters 2996二极管阵列检测器及Empower色谱工作站对总皂苷进行检测。色谱条件,Knauer C18色谱柱(5 μm,250 mm×3 mm);流动相,乙腈(A)-水(B);0~20 min,20%A等度;20~31 min,20%A~32%A线性梯度;31~40 min,32%A~43%A线性梯度;40~70 min,43%A~100%A线性梯度;进样量,10 μL;柱温,35 ℃;体积流量,0.6 mL/min;检测波长,203 nm。将待测人参皂苷样品用色谱甲醇溶解,经0.45 μm滤膜过滤,即为检测样品。
2 结果与讨论
2.1 Rg3混合物的组分分析
为了确定红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1混合物的组成及其比例,采用HPLC检测,结果如图1所示。从图1中可以看到,其混合物中20(S)-Rg3、20(R)-Rg3、Rk1和Rg5的峰面积比例依次为28∶12∶18∶42。
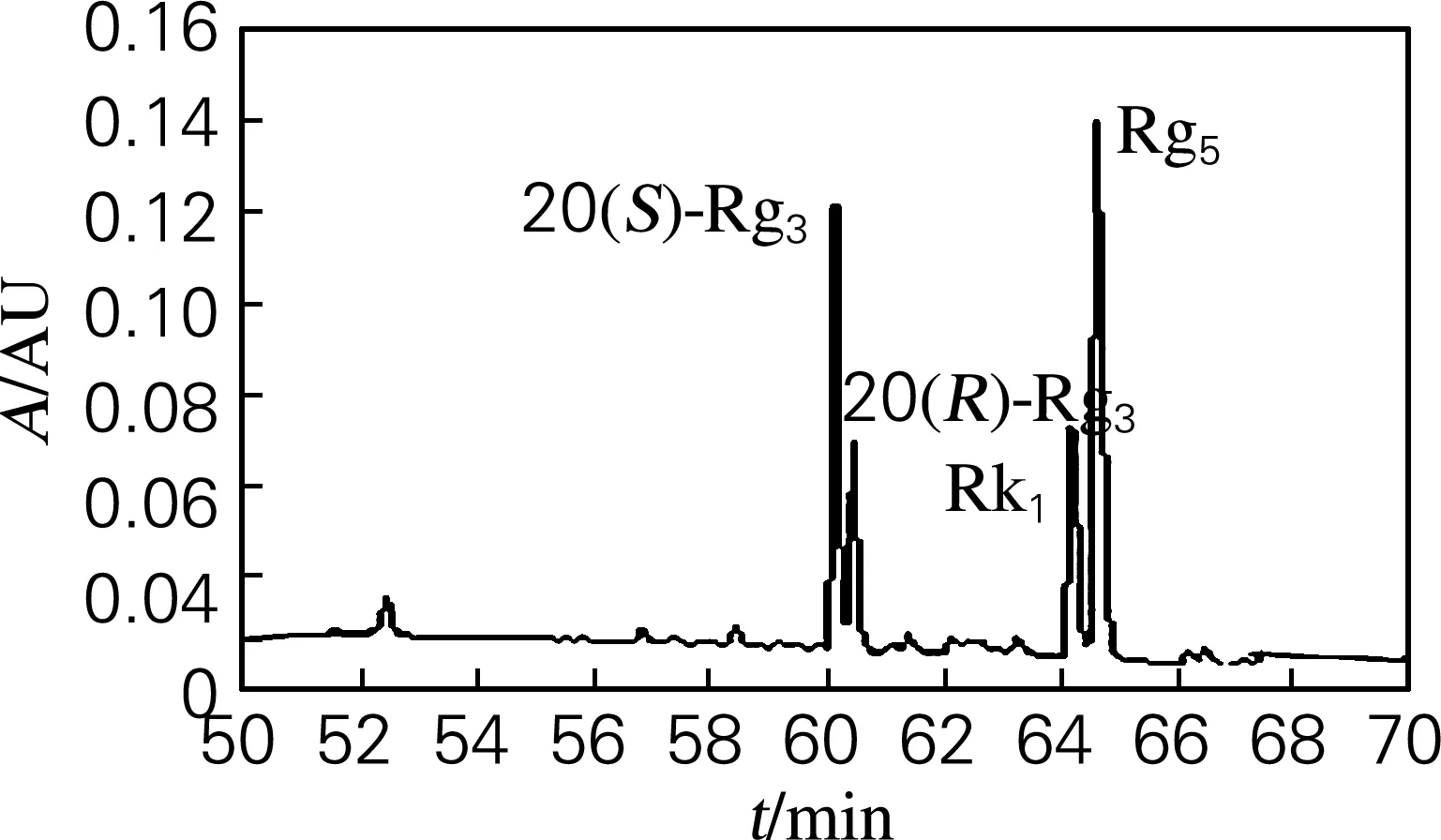
图1 20(S)-Rg3、20(R)-Rg3、Rg5和Rk1混合物HPLC检测图
2.2 Rg3混合物的分离
Rg3混合物的分离是分两步进行的。根据混合物中各组分溶解度的不同,首先分离出20(R)-Rg3,然后采用硅胶柱层析法分离20(S)-Rg3、Rg5和Rk1。
30 g的Rg3混合物充分溶于微酸性溶液,过滤不溶物,干燥后得到20(R)-Rg3粗品7.40 g。余下母液中主要含有20(S)-Rg3、Rg5和Rk1,采用硅胶柱层析法对母液进行分离。TLC检测分离结果如图2。由图2可知,45~63瓶Rg5较纯为单点,单独收集,浓缩干燥。第55瓶开始,分离产物中出现Rg3,80~98瓶Rg3较纯为单点,单独收集,浓缩干燥。99瓶之后为Rg3及下方皂苷。甲醇洗脱余下皂苷。分离产品按号分别收集,结果如表1所示。

表1 人参皂苷洗脱收集表
从表1中可以看到,20(S)-Rg3、Rg5和Rk1混合物采用硅胶柱层析法分离后,得到10.9 g为单点的Rg3和6.05 g为单点的顺反异构体Rg5和Rk1混合物。HPLC检测发现,得到的Rg3中20(S)-Rg3质量分数为75.3%;得到的顺反异构体Rg5和Rk1的混合物中Rg5质量分数为66.4%,Rk1质量分数为23.0%。顺反异构体Rg5和Rk1混合物经HPLC检测结果如图3所示。
2.3 20(S)-Rg3与20(R)-Rg3的精制
为得到20(S)-Rg3、20(R)-Rg3单体,采用重结晶法分别对已分离出的20(S)-Rg3、20(R)-Rg3粗品进行精制。
2.3.1 20(S)-Rg3的精制
称取3 g硅胶柱层析法分离后得到的20(S)-Rg3,加入80%甲醇溶液,加热搅拌使其充分溶解,自然冷结晶,过滤结晶,干燥后称重。采用HPLC检测结晶产品结果如图4所示。
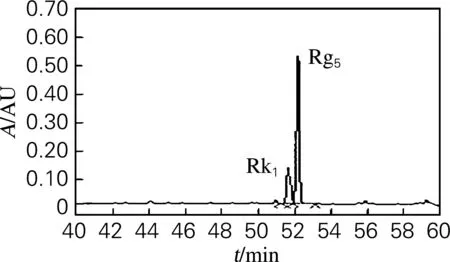
图3 硅胶柱层析法分离得Rg5和Rk1混合物HPLC检测图
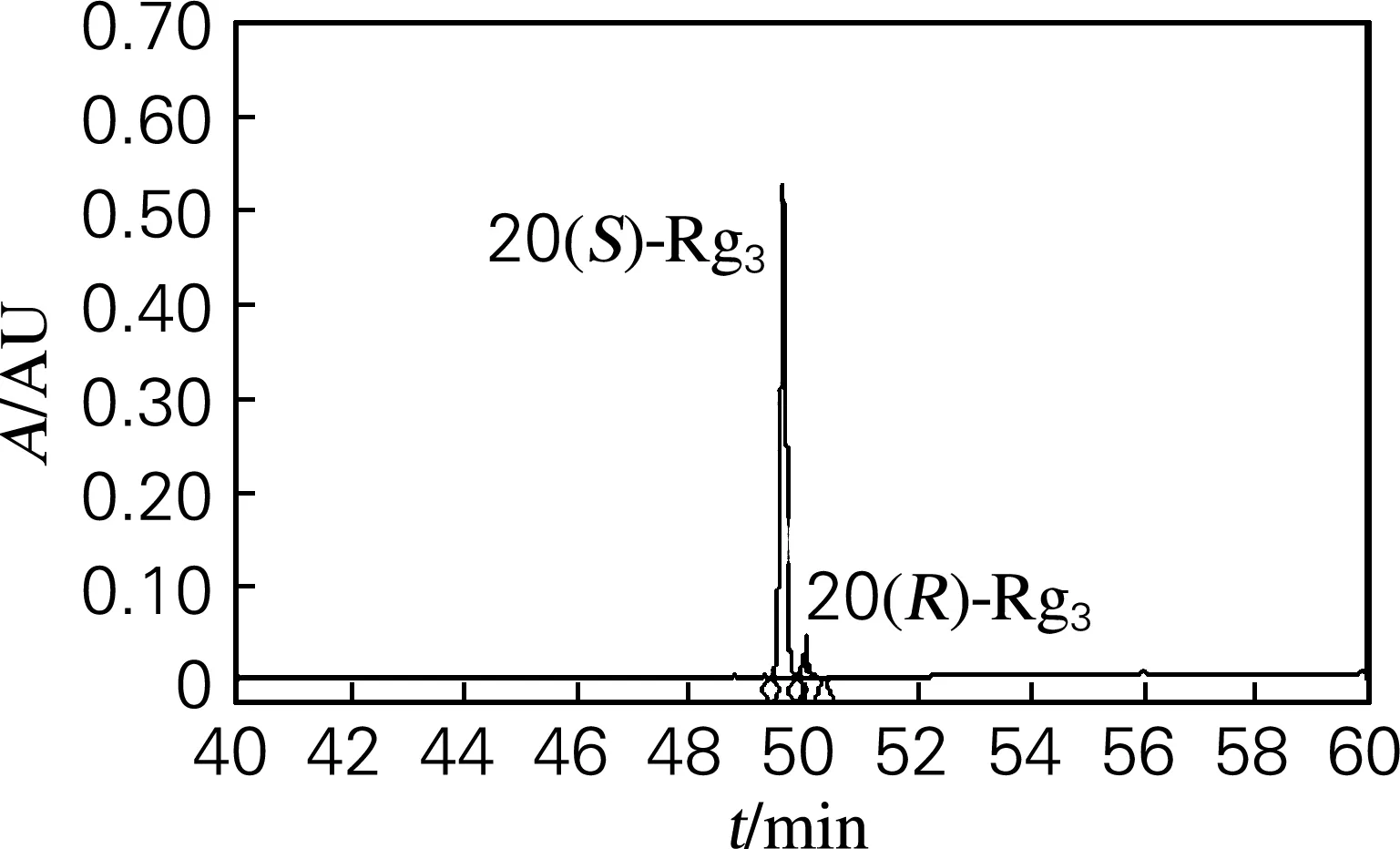
图4 20(S)-Rg3结晶HPLC检测图
精制前3 g的20(S)-Rg3粗品中,20(S)-Rg3质量分数为75.3%,20(R)-Rg3质量分数为14.0%。由图4可知,精制后,20(S)-Rg3结晶收集0.850 g,纯度达95.1%。
2.3.2 20(R)-Rg3的精制
称取3 g已分离得到的20(R)-Rg3粗品,加入吡啶与甲醇混合溶液,加热搅拌使其充分溶解后,加水至体积分数达到90%,自然冷结晶,过滤结晶,干燥后称重。采用HPLC检测结晶产品,结果如图5所示。

图5 20(R)-Rg3结晶HPLC检测图
精制前3 g的20(R)-Rg3粗品中,20(R)-Rg3质量分数为63.9%,20(S)-Rg3质量分数为5.74%。由图5可知,精制后,20(R)-Rg3结晶收集1.98 g,纯度为94.6%。
3 结 论
30 g红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1的混合物中分离单体,由于其混合物的溶解度不同,先分离出7.40 g纯度为64.0%的20(R)-Rg3粗品。然后采用硅胶柱层析法分离10.9 g纯度为75.3%的20(S)-Rg3及6.05 g的顺反异构体Rg5和Rk1的混合物。再采用重结晶法分别对已分离出的20(S)-Rg3、20(R)-Rg3粗品各3 g进行精制,得到1.98 g纯度为94.6%的20(R)-Rg3和0.850 g纯度为95.1%的20(S)-Rg3。
经实验发现,在甲醇溶液中,20(R)-Rg3的溶解度远小于20(S)-Rg3、Rg5和Rk1,尤其是在90%甲醇水溶液中最低,加入助溶剂吡啶,更有利于得到高纯度的20(R)-Rg3单体。但20(S)-Rg3、Rg5和Rk1在甲醇溶液中溶解度相近,在混合物中三者质量分数差不多时,很难通过重结晶法得到高纯度的20(S)-Rg3。因此,采用硅胶柱层析法先分离出含量较高的20(S)-Rg3,再多次采用重结晶法,才可得到20(S)-Rg3单体。至于拆分顺反异构体Rg5和Rk1,在人参二醇类皂苷Rb1等部分水解得到的二者混合物中,Rg5含量明显高于Rk1,但如何进一步精制得到单体,仍需进一步研究。
本论文从红参稀有皂苷20(S)-Rg3、20(R)-Rg3、Rg5和Rk1的混合物中分离得到高纯度的20(S)-Rg3单体,20(R)-Rg3单体及顺反异构体Rg5和Rk1的混合物,简便快速,为大规模工业生产提供了新的思路。但有关拆分顺反异构体Rg5和Rk1的单体的方法,仍需进一步研究。
[1] 金凤燮. 天然产物生物转化[M]. 北京:化学工业出版社, 2009:74-97.
[2] LU Ping, SU Wei, MIAO Zhan-hui, et al. Effect and mechanism of ginsenoside Rg3on postoperative life span of patients with non-small cell lung cancer[J]. Chinese Journal of Integrative Medicine, 2008, 14:33-36.
[3] KIM S M, LEE S Y, YUK D Y, et al. Inhibition of NF-B by ginsenoside Rg3enhances the susceptibility of colon cancer cells to docetaxel[J]. Archives of Pharmacal Research, 2009, 32:755-765.
[4] LEE W H, CHOI J S, KIM H Y, et al. Heat-processed neoginseng, KG-135, down-regulates G1 cyclin-dependent kinase through the proteasome-mediated pathway in hela cells[J]. Oncology Reports, 2009, 21:467-474.
[5] KIM S N, LEE J H, SHIN H, et al. Effects of in vitro-digested ginsenosides on lipid accumulation in 3T3-L1 adipocytes[J]. Planta Medica, 2009, 75:596-601.
[6] KIM J H. Cardioprotective effect of the mixture of ginsenoside Rg3and CK on contractile dysfunction of ischemic heart[J]. Journal of Ginseng Research, 2007, 31:23-33.
[7] KIM M, AHN B Y, LEE J S, et al. The ginsenoside Rg3has a stimulatory effect on insulin signaling in L6 myotubes[J]. Biochemical and Biophysical Research Communications, 2009, 389:70-73.
[8] LIM S, YOON J W, CHOI S H, et al. Effect of ginseng, a vinegar extract from Panax ginseng, on body weight and glucose homeostasis in an obese insulin-resistant rat model[J]. Metabolism, Clinical and Experimental, 2009, 58:8-15.
[9] PARK J H, KIM J M, HAN S B, et al. A new processed ginseng with fortified activity[C]// Adrances in Ginseng Research. Seoul Lorea:The Korean Society of Ginseng, 1998:146-159.
[10] 李海燕. 人参皂苷Rg3的分离提纯以及异构体的拆分[D]. 大连:大连轻工业学院, 2003.
[11] 李鹏,何克江,杨凌. 人参皂苷异构体的简易分离制备[J]. 中国新药杂志, 2004, 13(9):816-818.
