纳米钒酸铋的水热合成及其可见光光催化降解罗丹明B
2011-09-26龚焱,张秀芳,董晓丽,马春
龚 焱, 张 秀 芳, 董 晓 丽, 马 春
(大连工业大学 化工与材料学院 辽宁 大连 116034)
0 引 言
自从1972年日本东京大学教授Fujishima和Honda发现TiO2单晶电极在光的作用下不仅可分解水还可以分解其他物质以来[1],光催化反应在环境治理和能源开发方面得到了普遍的关注,关于光催化材料的研究开发,成为目前国内外研究的热点[2]。
目前,应用最为广泛的半导体光催化剂TiO2的带隙宽度为3.2 eV,仅在紫外光照射下有响应,对太阳光的利用效率很低。为解决这一问题,人们开始进行新型的可见光催化剂的开发[3-4]。钒酸铋(BiVO4)作为其中一种具有可见光活性的新型半导体光催化剂,得到了广泛的关注[5-6]。它在可见光作用下,能分解H2O和有机污染物[7]。Kudo A等[8]报道,具有单斜晶结构的BiVO4在可见光照射下,分解硝酸银水溶液有较高的放氧活性。水热合成[9-11]作为一种制备无机材料的可控方法显示出极大的优势:材料的尺寸和形貌可通过调节不同的水热条件控制,一步处理的便捷性使得水热制备法既迅速且易于重复。本研究以Bi(NO3)3·5H2O、NH4VO3等为反应物,采用了反应条件较温和的水热法合成新型的可见光催化剂BiVO4,对其进行表征,考察了其在可见光作用下对罗丹明B降解性能,并对其反应动力学进行了研究。
1 实 验
1.1 原料及试剂
硝酸铋[Bi(NO3)3·5H2O],偏钒酸铵(NH4VO3),氨水(NH3·H2O),硝酸(HNO3),无水乙醇,均为分析纯。
1.2 仪 器
X射线衍射仪,Shimadzu LabX-6000,日本;紫外-可见分光光度计,UV-160A,日本;721分光光度计,上海第三分析仪器厂;聚四氟乙烯反应釜,50 mL,长春市绿园区四海模具厂;VL-503台式离心机,上海安亭科学仪器厂;恒温磁力搅拌器,金坛市华峰仪器有限公司。
1.3 BiVO4纳米颗粒的制备
称取6.0 mmol(2.910 g) Bi(NO3)3·5H2O和6.0 mmol(0.702 g)NH4VO3分别溶解在10.0 mL 1.0 mol/L的HNO3溶液和去离子水中。将上述2种溶液混合,不断搅拌直至混合均匀。用浓度为1.0 mol/L NH3·H2O调节溶液的pH为7,同时不断搅拌使沉淀反应物混合均匀。将混合溶液移入内衬聚四氟乙烯的不锈钢反应釜中,在180 ℃下保温24 h,之后将样品取出,用去离子水和无水乙醇反复洗涤沉淀物3次,然后在80 ℃下干燥制得BiVO4光催化剂。
1.4 降解实验
称取50 mL一定浓度的罗丹明B溶液加入烧杯中,加入一定量光催化剂,在暗室中磁力搅拌1 h使催化剂保持均匀悬浮态,从而达到吸附平衡。采用500 W氙灯作为光源,在烧杯和光源之间通过加400 nm滤波片将波长小于400 nm的光滤掉。反应每隔一定时间取样,离心分离后取上清液,并用721分光光度计在553 nm处测量吸光度。在25 ℃的条件下,一定范围内的染料质量浓度ρ与吸光度值A呈正比关系,根据朗伯-比耳定律计算罗丹明B的脱色率:
式中,D为脱色率,%;ρ0为罗丹明B的初始质量浓度,mg/L;ρt为降解t时间后罗丹明B的质量浓度,mg/L;A0为罗丹明B溶液的初始吸光度值;At为降解t时间后的吸光度值。
2 结果与讨论
2.1 XRD分析
图1为180 ℃和pH=7条件下水热合成24 h的BiVO4催化剂的XRD谱图,在18.9°、28.8°、30.5°以及53.2°等发现特征峰,将其与标准衍射卡(JCPDS file No.14-0688)对比,可知图中的衍射峰均与标准谱图基本一致,说明所得产物为单斜晶相,并且结晶性良好。
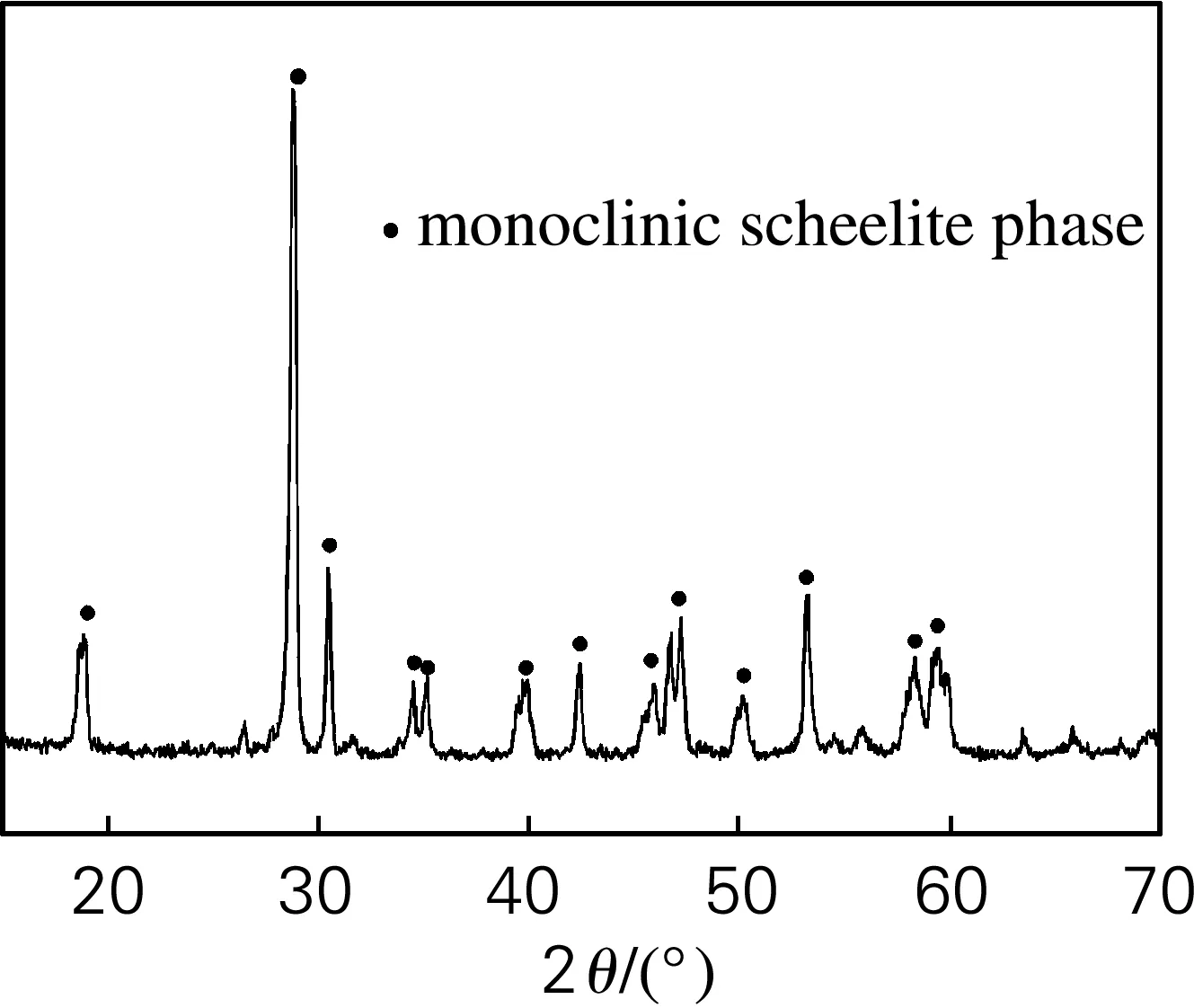
图1 180 ℃和pH=7条件下水热合成24 h的BiVO4催化剂的XRD谱图
Fig.1 XRD patterns of BiVO4catalyst (synthesized at 180 ℃ and pH=7 for 24 h)
2.2 DRS分析
BiVO4的DRS谱图见图2,从图2(a)可发现其在400~500 nm的可见光范围内有吸收,表明该材料可能具有可见光催化活性。半导体的禁带宽度可由Kubelka-Munk公式αhv=A(hv-Eg)n/2计算。其中,α为吸光系数;h为普朗克常数;v为入射光子的频率;A为比例系数;Eg为禁带宽度。由于BiVO4属于直接跃迁类的半导体,因此n取1,根据该方程以(αhv)2为纵坐标,(hv)为横坐标,得到(αhv)2与(hv)的关系曲线,将曲线中的直线部分延至(αhv)2=0处,则其与X轴的交点即为禁带宽度。由图可以估算出180 ℃水热合成24 h的BiVO4催化剂的禁带宽度约为2.46 eV,如图2(b)所示。
2.3 罗丹明B初始质量浓度的影响
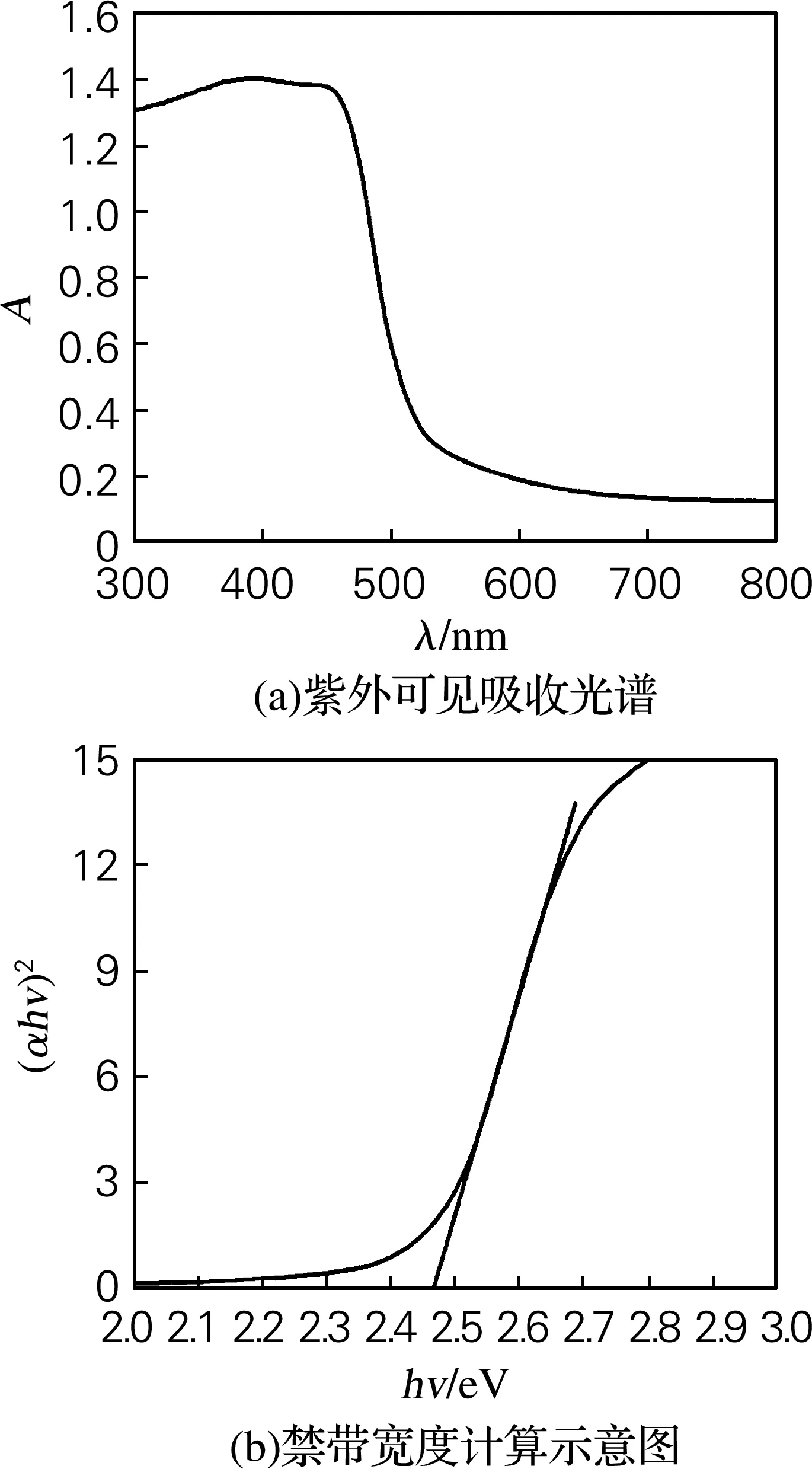
图2 BiVO4的紫外可见吸收光谱和BiVO4的禁带宽度计算示意图
Fig.2 UV-vis diffuse reflectance spectroscopy of BiVO4and calculation of the band gap by Kubelka-Munk function

图3 不同初始质量浓度罗丹明B脱色率的变化曲线
Fig.3 The removal rate vs. the original concentration of RhB
图3为制备出的BiVO4在投加量为3 g/L,反应时间为5 h条件下降解不同初始质量浓度的罗丹明B的脱色率的变化曲线。由图3可知,当初始质量浓度为10 mg/L时,去除率最高。随着初始质量浓度的不断增大,脱色率在不断减小。原因可能是由于染料质量浓度的增大引起色度增大,加大了对光的吸收,从而减少催化剂表面对光的有效利用,使其光催化降解率降低。另一种可能是由于染料质量浓度的增加,使更多的罗丹明B分子被吸附在催化剂的表面,导致参与光催化的活性基点变少影响了光催化效率。
2.4 催化剂用量的影响
在罗丹明B溶液初始质量浓度为10 mg/L,反应时间为5 h条件下不同催化剂用量处理罗丹明B的脱色率效果如图4所示。随着BiVO4用量的增加,罗丹明B的脱色率变大,反应速率增大,其原因是催化剂用量的加大,参与光解反应的催化剂颗粒增多,从而加快了光催化反应速率。当催化剂用量达到3 g/L时,脱色率最大。而当催化剂超过3 g/L,脱色率逐渐变小,这主要是由于悬浮颗粒会产生过量光反射从而影响光反应速率,且溶液浑浊度增大,阻挡了催化剂表面对光的利用,因此降解率也随之降低。
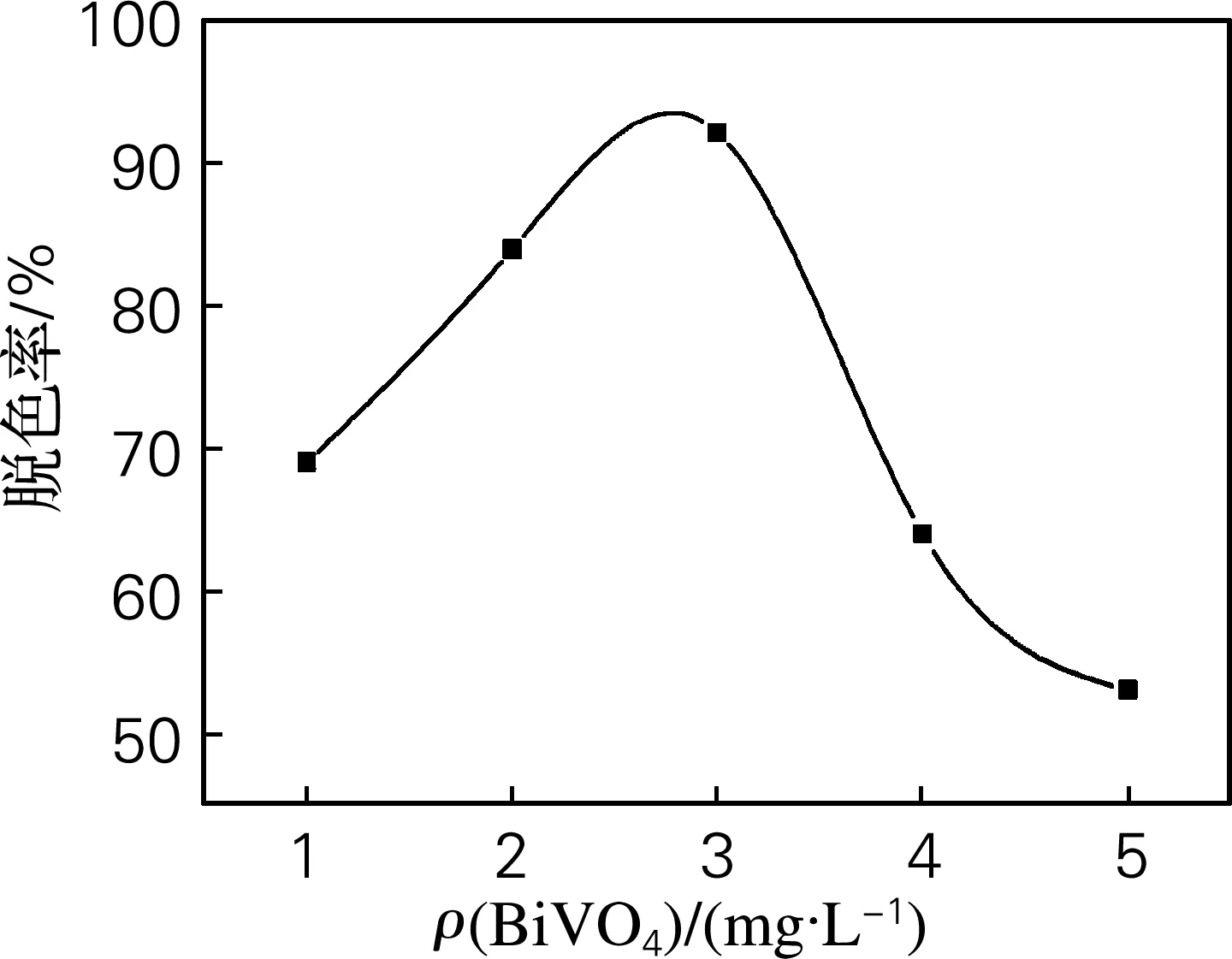
图4 不同催化剂用量降解罗丹明B的脱色率变化曲线
Fig.4 The removal rate of the RhB with the different catalyst quantity
2.5 动力学分析
图5(a)为最佳反应条件下的BiVO4降解罗丹明B质量浓度随时间变化曲线,在初始浓度为10 mg/L,催化剂投加量为3 g/L时,随着反应时间的不断增加,罗丹明B的质量浓度逐渐减少,反应5 h后,罗丹明B的脱色率为92.2%。通过以ln(ρ0/ρt)对时间作图,如图5(b)所示,回归得到一条直线,R=0.994,线性较好,因此该反应符合拟一级动力学模型。反应常数为0.497 h-1。
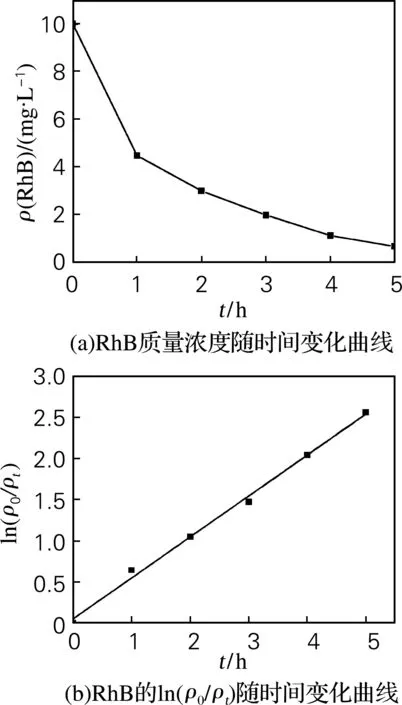
图5 光催化反应中RhB质量浓度随时间变化曲线和RhB的ln(ρ0/ρt)随时间变化曲线
Fig.5 The concentration vs. time and ln(ρ0/ρt) vs. time plotted for RhB degradation in photocatalytic process
3 结 论
采用水热法合成了单斜晶纳米BiVO4颗粒,在可见光条件下,催化剂投加量为3 g/L时,处理初始质量浓度为10 mg/L的罗丹明B溶液,反应5 h后,罗丹明B的脱色率达到92.2 %。并且该反应符合一级动力学模型,反应常数为0.497 h-1。钒酸铋作为一种可见光响应的半导体催化剂,在利用太阳光降解一些难降解的污染物方面将会得到广泛的应用。
[1] FUJISHIMA A, HONDA K. Electronchemical photolysis of water at semiconductor electrode[J]. Nature, 1972, 238:37-38.
[2] WANG R, HASHIMOTO K, FUJISHIMA A, et al. Light-induced amphi-philic surfaces[J]. Nature, 1997, 388:431-432.
[3] 陈崧哲,张彭义,祝万鹏,等. 可见光响应光催化剂研究进展[J]. 化学进展, 2004, 16(4):613-619.
[4] 程萍,顾明元,金燕苹. TiO2光催化剂可见光化研究进展[J]. 化学进展, 2005, 17(1):8-14.
[5] 涂海滨,张高科. 铋系光催化剂研究进展[J]. 天津化工, 2006, 20(3):11-13.
[6] SHANTHA K, SUBBANNA G N, VARMA K B R. Mechanically activated synthesis of nanocrystalline powders of ferroelectric bismuth vanadate[J]. Journal of Solid State Chemistry, 1999, 142:41-47.
[7] KUDO A. Development of photocatalyst materials for water splitting[J]. International Journal of Hydrogen Energy, 2006, 31(2):197-202.
[8] KUDO A, UEDA K, KATO H, et al. Photocatalytic O2evolution under visible light irradiation BiVO4in aqueous AgNO3solution[J]. Catalysis Letters, 1998, 53(2):229-230.
[9] 庞文琴. 无机合成[M]. 北京:高等教育出版社, 1991.
[10] 张爱平,张进治. 水热法制备不同形貌和结构的BiVO4粉末[J]. 物理学报, 2009, 58(4):2336-2344.
[11] ZHANG Li, CHEN Dairong, JIAO Xiuling, et al. Monoclinic structured BiVO4nanosheets: hydrothermal preparation, formation mechanism, and coloristic and photocatalytic properties[J]. Journal of Physical Chemistry B, 2006, 110(6):2668-2673.
