麦冬皂苷D的分离提纯
2011-09-26邓惠方,王东明,富瑶瑶,胡雪莲,鱼红闪,金凤燮
邓 惠 方, 王 东 明, 富 瑶 瑶, 胡 雪 莲, 鱼 红 闪, 金 凤 燮
(大连工业大学 生物工程学院, 辽宁 大连 116034)
0 引 言
麦冬有效成分主要是麦冬多糖和甾醇类皂苷,具有多种药理功能和较好的药用价值[1]。国内外学者从上世纪六、七十年代开始对皂苷类成分进行研究[2-3],先后从麦冬类植物中分离出数十种皂苷,其中具有代表性的麦冬皂苷D(ophiopogonin D),在川麦冬中含量较高[4],可作为川麦冬的质量标准。麦冬总皂苷提取的常规方法为水提法(即蒸煮法)、醇提法和酶提法[5]。车仁国等[9]对麦冬总皂苷的不同提取方法进行了比较研究。本文在此基础上采用醇提法以甲醇作为浸提液,提取麦冬总皂苷,经过脱色、脱脂处理,硅胶柱层析分离和高效液相色谱法相结合,得到纯度较高的麦冬皂苷D,满足常规分析检测对标准品的要求。
1 材料与方法
1.1 材 料
麦冬,市售,四川产;麦冬皂苷D标准品,上海尚谊化工科技有限公司;薄层层析板Silica Gel 60-F254,德国Merck公司;硅胶,青岛海洋化工厂;其他化学试剂均为分析纯。
1.2 方 法
1.2.1 麦冬总皂苷的提取
称取10 kg麦冬,粉碎后用3倍体积甲醇浸泡3次,每次2 d,浓缩,用皂苷溶液1/3体积的石油醚脱脂后,再用皂苷溶液1/3体积的水饱和正丁醇萃取3次,合并正丁醇层。水洗正丁醇层脱糖,最后将正丁醇层浓缩、干燥、收集、称重,得麦冬总皂苷。取少量干燥样品溶于甲醇进行TLC检测。
1.2.2 硅胶柱层析法分离纯化样品
制备样品胶:将麦冬总皂苷用少量的氯仿和甲醇溶解,加入待分离样品质量2.5倍的80~100目硅胶,水浴蒸干,不断搅拌,直至硅胶复为粉末状。
装柱:取300~400目硅胶作分离胶,在玻璃柱内铺放均匀后,装入样品胶,最上层置脱脂棉。
洗脱:先用氯仿通柱,然后分别按照体积比V(氯仿)∶V(甲醇)=9.5∶0.5、9∶1、8.5∶0.5、8∶2,V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5的梯度进行洗脱,TLC检测分离结果,最后收集麦冬皂苷D洗脱液,浓缩,蒸干得固体粉末。
1.2.3 薄层层析法(TLC)检测样品中皂苷成分
将1 mg麦冬皂苷溶于1 mL甲醇,微量点样器吸取标准品及样品,点样于薄层层析板,然后置于层析缸中展开,展开剂体积比为V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5,用10%硫酸溶液加热显色。通过对照样品斑点与标准品斑点来确定样品中所含有的麦冬皂苷D。
1.2.4 高效液相色谱法(HPLC)测定纯度
色谱仪,Waters 2695高效液相色谱分析仪,Waters 2996二极管阵列检测器及Empower色谱工作站对总皂苷进行检测。色谱条件:色谱柱,Kromasil (5 μm,250 mm×4.6 mm);柱温,35 ℃;进样量,10 μL;体积流量,1.0 mL/min;检测波长,199 nm。将待测人参皂苷样品和标准品用色谱甲醇溶解,经0.45 μm滤膜过滤,即为检测样品,样品及标准品质量浓度均为1 mg/mL。流动相,乙腈(A)-水(B)。初始时,φ(A)=30%,φ(B)=70%;20 min时,φ(A)=50%,φ(B)=50%;40 min时,φ(A)=90%,φ(B)=10%。
2 结果与讨论
2.1 麦冬总皂苷的提取
采用甲醇浸提法按方法“1.2.1”提取麦冬总皂苷。将10 kg麦冬经甲醇浸泡提取,石油醚脱脂,正丁醇萃取,水洗脱糖后干燥称重,得到麦冬总皂苷粉末18.1 g,提取率为0.181%。取少量干燥样品,溶于甲醇中进行TLC检测,检测结果如图1所示。由图1可知麦冬总皂苷中含有麦冬皂苷D。
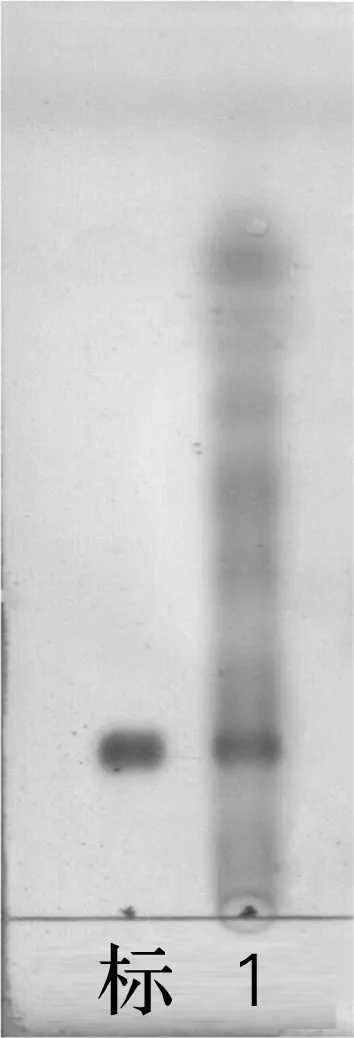
标,麦冬皂苷D标准品;1,麦冬总皂苷
2.2 麦冬皂苷的硅胶分离
将提取的18 g麦冬总皂苷,制成45 g样品胶,取300~400目硅胶360 g作为分离胶,按方法“1.2.2”进行分离,洗脱液分瓶收集,每瓶体积为200 mL,标号依次为1,2,3……分瓶取样。为了获得更多且纯度较高的麦冬皂苷D样品,用一个梯度洗脱同时用薄层层析跟踪检测,当薄层层析板上出现下个斑点时,更换极性大的梯度继续洗脱,共收集洗脱液83瓶,TLC检测结果如图2所示。 从图2可以看出,从44瓶开始有麦冬皂苷D样品洗出直到74瓶,但是第73瓶以后拖尾严重,说明有其他皂苷洗出。为了不影响纯度,回收44~73瓶,用旋转蒸发仪浓缩,水浴蒸干、称重,得到2.31 g麦冬皂苷D,得率为12.8%。第1瓶到43瓶可能是低糖基麦冬皂苷,共收得12.5 g。待分离样品共18.1 g,回收共得到17.2 g,回收率为95.6%。
2.3 高效液相色谱法检测麦冬皂苷D的纯度
采用HPLC方法检测分离后的麦冬皂苷D的纯度。精密称取分离获得的麦冬皂苷D样品1 mg,溶于1 mL色谱甲醇,完全溶解过0.45 μm滤膜,取滤液即得1 mg/mL的供试品,检测图谱如图3所示。从图3可知其出峰时间为27.198 min,峰面积占总峰面积的91.2%,麦冬皂苷D标准品的出峰时间为27.251 min,通过比较可以确定样品为麦冬皂苷D,纯度为91.2%。
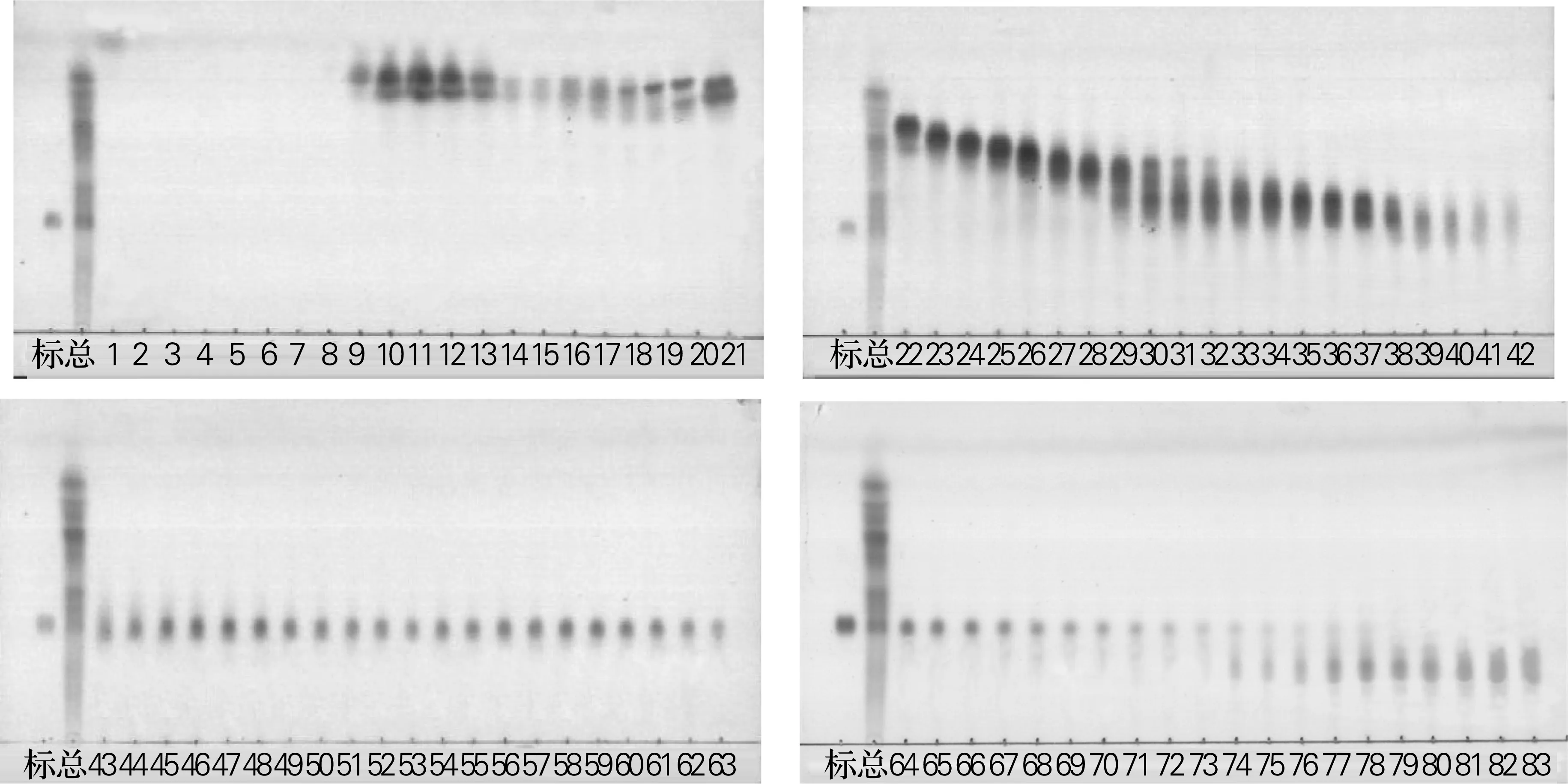
标,麦冬皂苷D标准品;总,麦冬总皂苷;1~83,硅胶柱洗脱分瓶收集的瓶编号
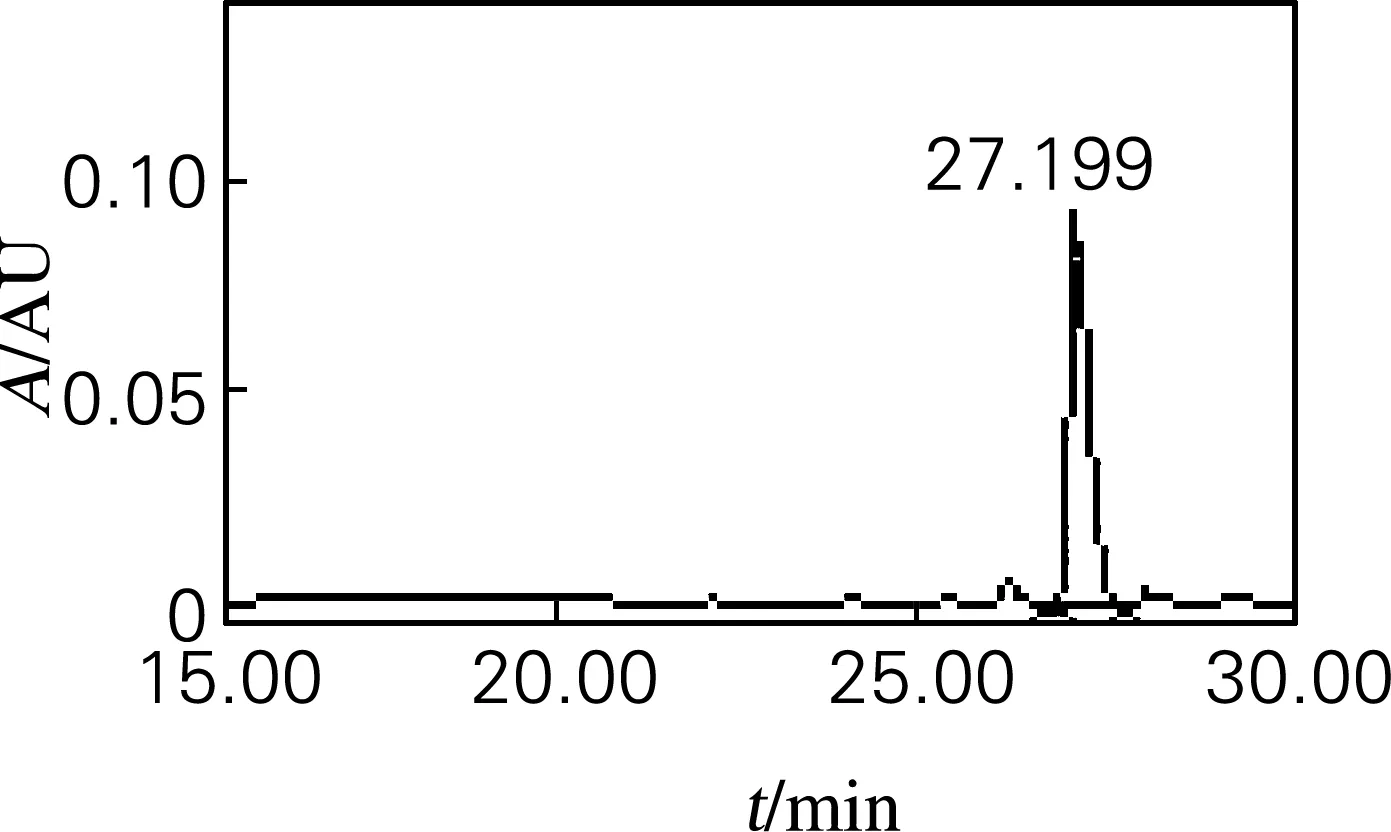
图3 麦冬皂苷D样品HPLC图
3 结 论
以10 kg麦冬为原料,采用甲醇浸提法提取麦冬皂苷,经石油醚脱脂、水饱和正丁醇萃取、去离子水水洗脱糖,得到麦冬总皂苷18.1 g,提取率为0.181%。应用硅胶柱层析法进行分离纯化,用氯仿-甲醇为洗脱剂,当V(氯仿)∶V(甲醇)=8∶2时分离得到较纯的麦冬皂苷D样品,减压浓缩干燥后得干品2.31 g,得率为12.8%,经高效液相色谱检测可测得麦冬皂苷D的纯度为91.2%。
用甲醇浸提法对麦冬总皂苷进行提取较其他常规提取方法简单可行且提取率高,经硅胶柱层析法简单分离后就可制得纯度较高的麦冬皂苷D,满足实验室对标准品的要求,为工业大规模生产提供理论依据。
[1] 刘吉华,余伯阳. 麦冬多糖精制方法的比较[J]. 植物资料与环境学报, 2003, 12(3):55-57.
[2] HAO Fu-dai, ZHONG Tao-ding, JIANG Xiong, et al. Two new steroidal glycosides fromOphiopogonjaponicus[J]. Chinese Chemical Letters, 2000, 11(10):901-904.
[3] YU Bo-yang, QIU Sheng-xiang, XU Guo-jun, et al. Steroidal glycosides from the subterranean parts of liriope spicata var.prolifera[J]. Phytochemistry, 1996, 43(1):201-206.
[4] 俞建平,马月光,邵建峰,等. ELSD-HPLC法测定浙麦冬、川麦冬中麦冬皂苷D含量的方法研究[J]. 中药新药与临床药理, 2002, 13(4):253-255.
[5] 王何,余伯阳,金凤燮,等.提取麦冬皂苷用酶的微生物筛选及其产酶条件[J]. 大连轻工业学院学报, 2007, 26(3):221-224.
(WANG He, YU Bo-yang, JIN Feng-xie, et al. Selection and study of the microorganism for the extraction of saponins fromOphiopogonjaponicus[J]. Journal of Dalian Institute of Light Industry, 2007, 26(3):221-224.)
[6] 车仁国,商秀梅,沈宏伟,等. 麦冬总皂苷不同提取方法的比较研究[J]. 安徽农业科学, 2008, 36(7): 2807-2809.
