生物传感器法测定蔗糖转化反应的速率常数*
——经典动力学实验的综合性设计示例
2011-09-25杨海朋柳文军苏轶坤肖飞戈早川汤皎宁
杨海朋 柳文军 苏轶坤 肖飞 戈早川 汤皎宁
(深圳大学材料学院深圳市特种功能材料重点实验室 广东深圳 518060)
测定化学反应的速率常数是物理化学实验中动力学部分的重要内容。根据不同化学反应的特点,实验教材常常采用不同方法测定反应的速率常数,如电导法、旋光法、分光光度法等[1]。这些实验方法由于有助于开阔学生的眼界,训练基本实验技能,已为众多高校物理化学实验教学所采用。此外,为了完善创新人才培养机制,提高本科生培养水平,还需要在教学中设置一些综合性实验[2]。本文介绍将“旋光法测定蔗糖转化反应的速率常数”这一经典动力学实验改造为综合性实验的探索。
生物传感器通常由生物识别元件(bioreceptor)和信号转换器件(transducer)两个部分组成,其中生物识别元件由生物活性物质(酶、抗原、抗体、激素等)或生物体本身(细胞、细胞器、组织等)构成,而信号转换器通常是一个独立的化学或物理敏感元件,可采用电化学、光学、热学、压电等多种不同原理工作。把生物识别元件同信号转换器件相结合,就可以构成多种多样的生物传感器[3-6]。纳米电化学生物传感器是将纳米材料作为一种新型的生物传感介质,与特异性分子识别物质如酶、抗原/抗体、DNA等相结合,并以电化学信号为检测信号的分析器件。由于生物传感器的生物识别单元选择性专一,可以获得很好的抗干扰能力和极高的灵敏度。包括电化学生物传感器在内的生物传感器自诞生以来就一直是科学工作者关注的热点[6-7]。
本实验设计根据蔗糖转化反应的特点,引入作者课题组最新制备的碳纳米管-聚环糊精葡萄糖生物传感器[5],通过对反应产物葡萄糖浓度的原位测定,计算出蔗糖转化反应的速率常数。把这一经典动力学实验与当前的科研热点内容相结合,使其成为一个综合性探索实验项目。
1 实验设计原理
在催化剂(H+离子或者蔗糖酶)存在的条件下,蔗糖在水中可以水解为葡萄糖和果糖,反应如下:
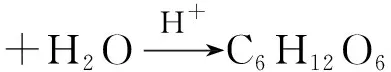
蔗糖水解反应是一个二级反应。但由于水是大量存在的,在反应过程中可以认为浓度不变;反应过程中的氢离子是催化剂,可以认为浓度不变。因此,蔗糖水解反应可作为一级反应来处理,又称为“假一级反应”。如果以c表示t时刻的反应物浓度,k表示反应速率常数,则反应的速率方程为:-dc/dt=kc。对此式积分可得:
lnc=-kt+b
(1)
式中b为积分常数。 在不同时间测定反应过程中的反应物浓度,以lnc对t作图,可以求出反应的速率常数k。
由于反应是不断进行的,因此需要即时分析出反应物蔗糖的浓度。在实验教材中是根据反应物蔗糖和产物葡萄糖及果糖旋光能力的不同,利用体系在反应进程中旋光度的变化来分析蔗糖浓度的变化[1]。
由于蔗糖分解产物是稳定存在的葡萄糖和果糖,蔗糖浓度降低速率等于葡萄糖或果糖浓度增加速率。因而传感器只要能够测定这3种物质中任意一种物质的浓度变化就可以了。本文采用纳米电化学葡萄糖生物传感器,通过检测葡萄糖浓度的变化计算反应速率常数。
设葡萄糖的浓度为cg,蔗糖初始浓度为c0,则蔗糖浓度c=c0-cg。葡萄糖浓度cg正比于传感器响应电流的大小,设比例系数为a,则cg=aI,c0=aI∞,I∞是反应终了时的电流强度(此时可认为蔗糖已全部转化为葡萄糖及果糖)。代入公式(1),得到:
ln(I∞-I)=-kt+b′
(2)
实验中测得I-t曲线和I∞,以-ln(I∞-I)对t作图,所得直线的斜率就是蔗糖转化反应的速率常数k。
2 实验示例
2.1 传感器制备
把一定量的碳纳米管(CNT)放入环糊精(CD)和预聚环糊精的混合液中超声混合,用微量进样器吸取混合液20μL,置于干净的玻璃片上,加入20μL 2.5%戊二醛和0.2mol/L盐酸的等比例混合液,搅拌均匀。再用微量进量器吸取20μL上述溶液滴到Pt电极上,在室温下自然晾干后,得到聚环糊精-碳纳米管(CDP-CNT)复合膜修饰电极。在CDP-CNT膜上滴加3μL 葡萄糖氧化酶(Gox)溶液和3μL 2.5%戊二醛溶液,待其在室温下干燥后即得到CDP-CNT复合膜修饰的纳米电化学葡萄糖生物传感器。
2.2 葡萄糖浓度测定
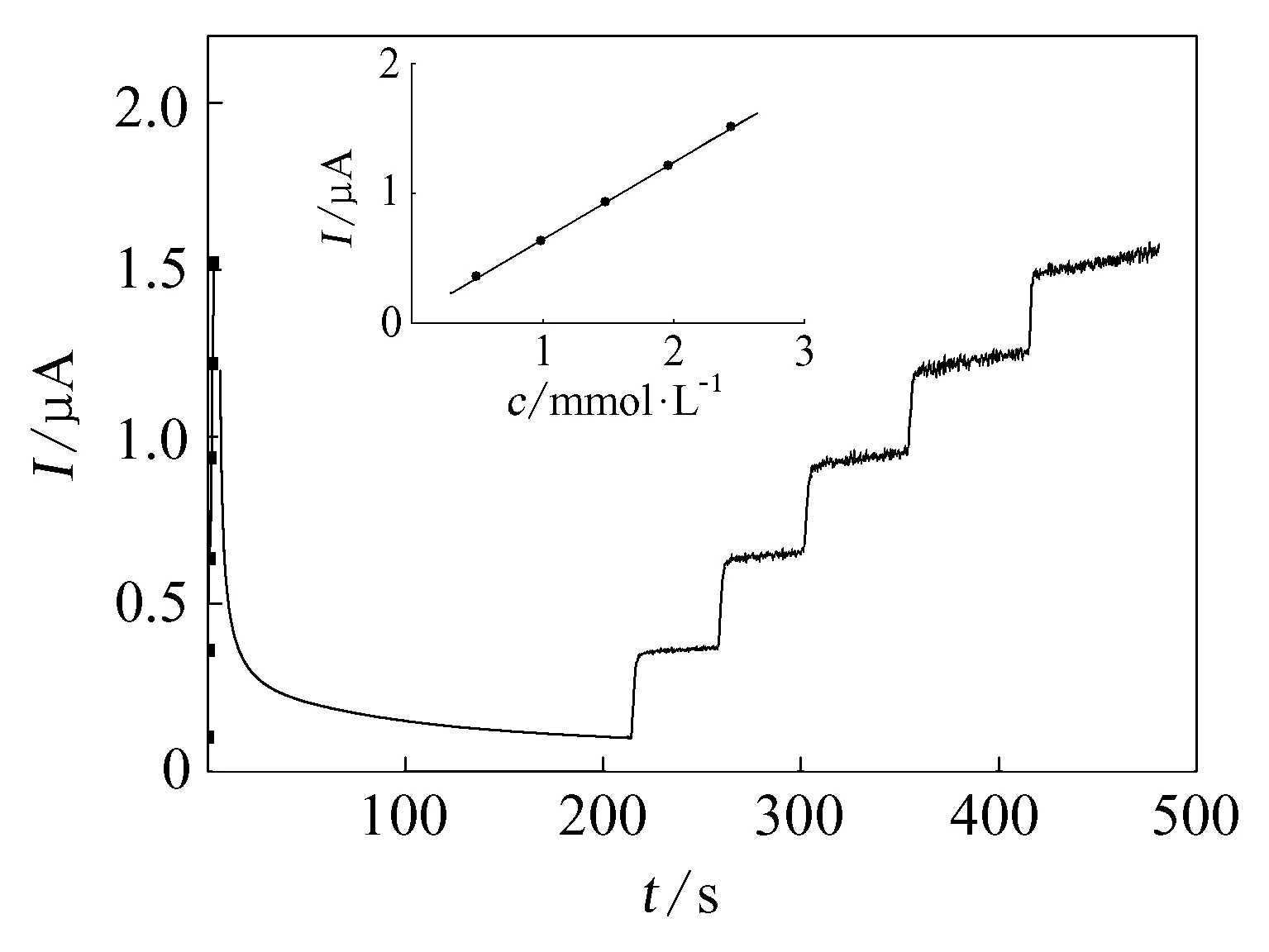
图1 连续加入葡萄糖溶液时传感器的电流响应曲线
以饱和甘汞电极为参比电极,铂丝电极为对电极,利用CHI660C电化学工作站测定体系的电流-时间信号[5]。电流测量过程为:在不含底物的缓冲溶液中施加一定电压,当背景电流趋于稳定后,加入一定量的底物溶液。随着底物溶液的注入,电极产生响应电流。图1显示在10mL缓冲溶液(pH 5.5)中连续加入50μL 0.1mol/L的葡萄糖溶液时,传感器对葡萄糖的电流响应曲线,所加电压为0.6V。可以看到电流从一个稳态到达另一个稳态的平衡时间小于2s,也就是说传感器对葡萄糖的响应时间小于2s,可以实现对反应产物葡萄糖浓度的原位测定。图1中插图是葡萄糖浓度c(mmol/L)与电流I(μA)的关系曲线,其线性拟合方程为I=0.055+0.60c(n=5,R=0.9998)。由此可见传感器响应电流的大小与葡萄糖浓度有很好的线性关系。
2.3 蔗糖转化反应速率常数测定
用pH 5.5 的缓冲溶液配制质量分数为33.3%的蔗糖溶液和0.1%的蔗糖酶溶液。在测试装置中加入8.0mL蔗糖溶液,在0.6V电压下测定电流-时间曲线,待背景电流稳定后,加入2.0mL蔗糖酶溶液,开始蔗糖转化反应。随着反应进行,反应产物葡萄糖的浓度不断增大,测得的电流也相应增大,一直测到电流趋于饱和时实验结束,饱和电流值即可认为是I∞。测量结果示于图2。以-ln(I∞-I)对t作图,所得曲线示于图3。图3中拟合线的斜率即蔗糖转化反应的速率常数k。数据拟合的线性方程为:y=9.9114+0.0162x(n=151,R=0.97),由此得到本实验条件下蔗糖转化反应的速率常数为k=0.0162s-1。
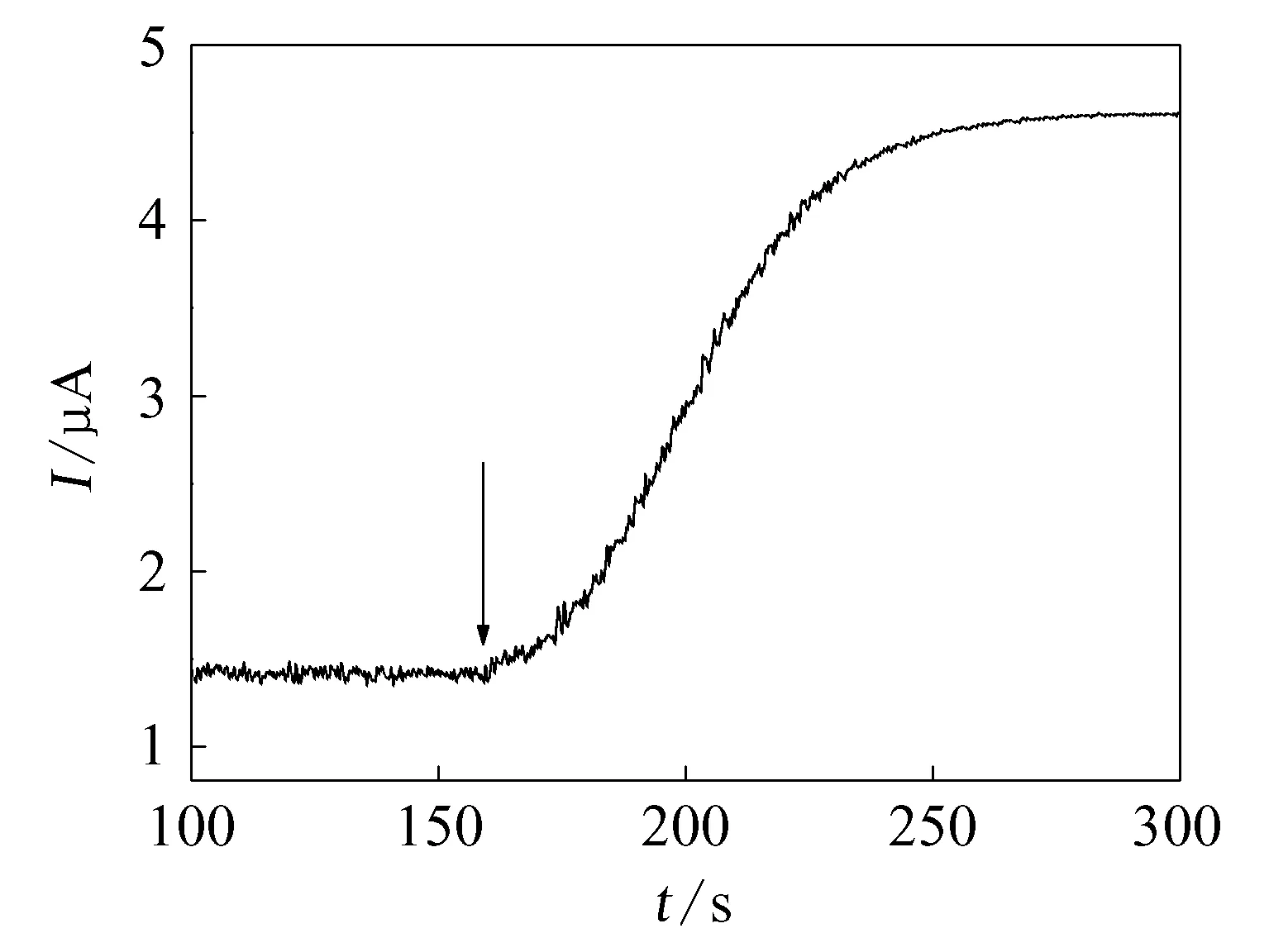
图2 蔗糖转化反应过程中传感器的电流响应曲线
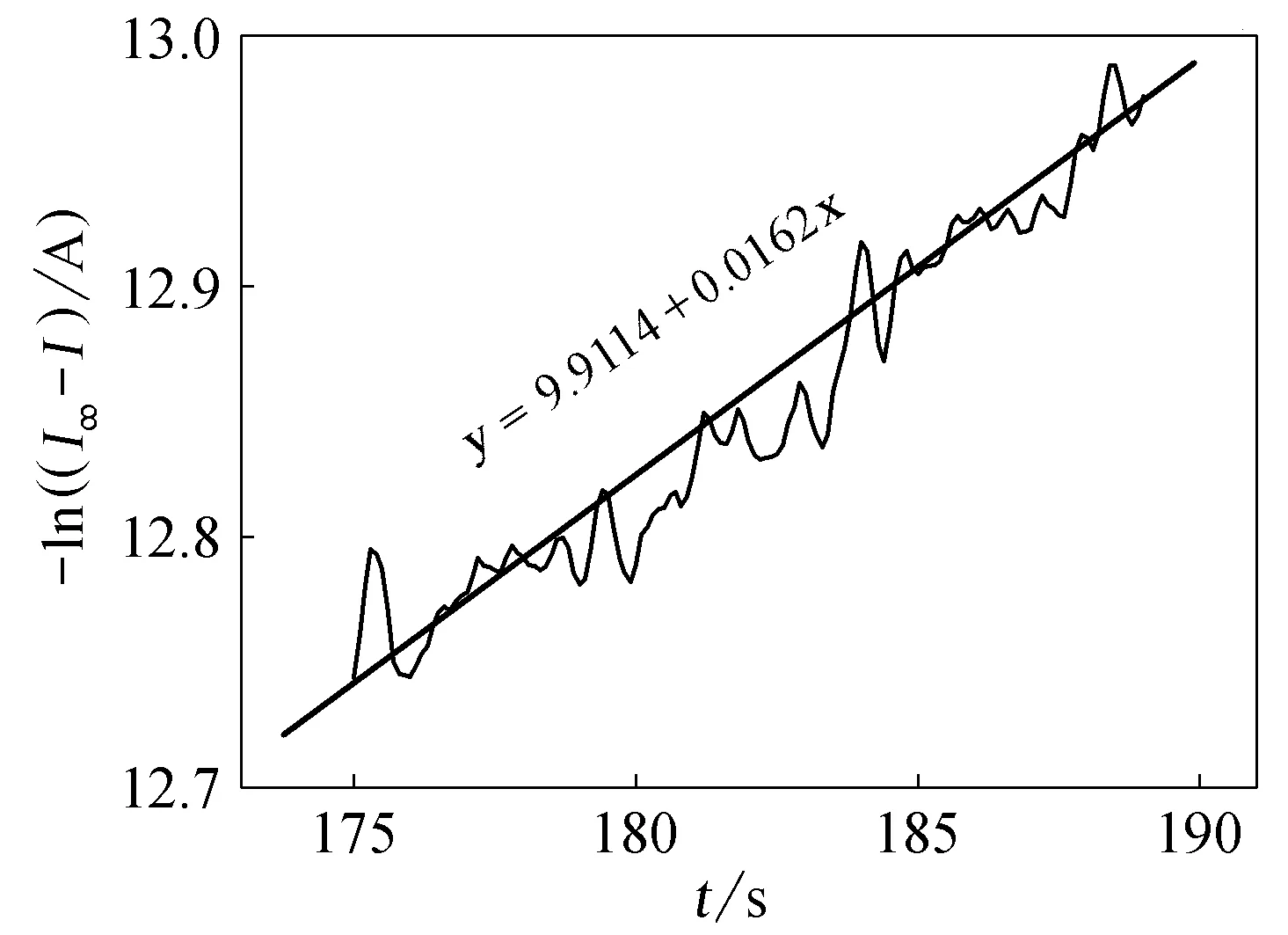
图3 利用葡萄糖响应电流值计算得到的-ln(I∞-I)-t关系曲线
3 结语
本文根据蔗糖转化反应的特点,引入当前科学研究的热点课题,把经典动力学实验改造成为一个综合性探索实验。在实际教学中,可根据课时的多少灵活安排。如传感器的制备和测试部分,可以要求学生自己查阅专业文献,写出详细的实验步骤,也可以由实验讲义直接提供实验步骤。综合性、探索性实验的设置,能够调动学生学习的主动性和创造性,有助于学生创新思维能力和综合素质的培养,是教学改革实践中的重要环节,也是提高教学质量的重要措施[2,8]。本文为综合性实验的一个实例,希望能够起到抛砖引玉的作用,以便在实验教学改革中设计出更多的综合性实验,提高本科生培养水平。
[1] 庄继华.物理化学实验.第3版.北京:高等教育出版社,2006
[2] 孟庆繁,逯家辉,王贞佐,等.实验室研究与探索,2004,23:85
[3] 董绍俊,车广礼,谢远武.化学修饰电极.修订版.北京:科学出版社,2003
[4] 麦智彬,谭学才,邹小勇.分析测试学报,2006,25:120
[5] Yang H P,Zhu Y F,Chen D C,etal.BiosensorandBioelectronics,2010,26(1):295
[6] Wang J,Musameh M,Lin Y.JAmChemSoc,2003,125:2408
[7] 杨海朋,陈仕国,戈早川,等.化学进展,2009,21:210
[8] 左铁镛.实验室研究与探索,2008,27:1
