响应面优化产碱性蛋白酶菌株的产酶条件
2011-09-25顾艳丽,张慧,刘赛男,李宪臻
顾 艳 丽, 张 慧, 刘 赛 男, 李 宪 臻
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
近年来,碱性蛋白酶作为工业催化剂得到广泛使用。与传统的化学催化剂相比,碱性蛋白酶具有催化能力强、底物专一性高等优点,已被应用于制革、银回收、医药、食品、饲料、化学工业、废物处理等生产及行业[1],尤其是作为无磷洗衣粉的添加剂使用,已使碱性蛋白酶商业制剂的销售占整个蛋白酶市场的1/3以上,显示出良好的使用性能和经济价值。但国产碱性蛋白酶己不能满足洗涤剂工业发展的需求,大规模工业用碱性蛋白酶主要依赖于国外进口。因此,寻找一种能分泌具有良好酶学特性并适用大规模洗涤剂工业生产的碱性蛋白酶高产菌种,具有重要的理论意义和应用价值。本研究在前期菌株筛选的基础上对筛选出的产碱性蛋白酶菌株I13进行产酶条件的响应面[2]优化,最终确定了该菌株较佳的产酶条件。
1 材料与方法
1.1 菌 株
实验室前期工作分离筛选获得的保藏菌种。
1.2 培养基
种子培养基:蛋白胨0.5 g,酵母粉0.5 g,干酪素0.1 g,葡萄糖1 g,氯化钠1 g, 0.1 mol/L磷酸盐缓冲液(pH 10.5) 100 mL,灭菌后用5 mol/L氢氧化钠调pH至10.5。
基本发酵培养基:葡萄糖1 g,酵母粉1 g,氯化锰0.05 g,干酪素0.1 g,氯化钠1 g,0.1 mol/L磷酸盐缓冲液(pH 10.5) 100 mL,灭菌后用5 mol/L氢氧化钠调pH至10.5。
1.3 培养方法
种子培养:将实验室的保藏菌种接一环到种子培养基中,于20 ℃、160 r/min的条件下进行振荡培养,取OD600=0.15的发酵液作为种子液。
发酵培养:取种子培养液以5%接种量接入发酵培养基,20 ℃、160 r/min振荡培养36 h,离心取上清液即为粗酶液。
1.4 酶活力的测定方法
采用Folin-酚法测定碱性蛋白酶活力。将150 μL粗酶液和150 μL 2%酪蛋白的磷酸缓冲溶液(pH 10.5)40 ℃预热3 min后混合,于40 ℃反应10 min,立即加入0.4 mol/L三氯乙酸(TCA)300 μL终止反应。于9 000 r/min离心10 min后取上清液300 μL,加入Na2CO31.5 mL、福林酚试剂300 μL,40 ℃显色20 min,于722S分光光度计测OD680。以TCA灭活后的酶液作为对照。在40 ℃、pH 10.5条件下每分钟催化水解酪蛋白产生1 μg酪氨酸所需要的酶量为一个酶活力单位。
1.5 Plackett-Burman设计筛选
采用Plackett-Burman设计法[2-4]和Minitab15数据处理软件[5]创建试验次数N=12的试验,对葡萄糖(A)、酵母粉(B)、NaCl(C)、MnCl2(D)、温度(F)、起始pH(G)、接种量(H)和装液量(J)8个因素进行考察,另设2个虚拟列(E、K),以考察试验误差,以酶活力为响应值考察各因素对产酶影响的显著性。
1.6 最陡爬坡试验
最陡爬坡法[6]以试验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,建立有效的响应面拟合方程。
1.7 响应面分析
响应曲面分析法(RSM)中的试验设计(Box-Behnken)是一种寻找多因素系统中最佳条件的数学统计方法。本试验利用Minitab15 数据处理软件设计一个三因素三水平共15个试验点的试验,得到最佳的产酶条件,以提高酶活力。
2 结果与讨论
2.1 Plackett-Burman设计筛选结果
根据前期单因素试验确定的最佳碳源、氮源等条件,选用试验次数N=12的试验设计,对10个因素(8个实际因素、2个虚拟因素)进行考察,分别对应于表1的10列,每个因素取2个水平,以碱性蛋白酶活力为响应值。选择置信度较高的因素作为显著因素进一步考察,试验设计及结果如表1所示,各因素主效应分析结果如表2所示。

表1 筛选试验设计及试验结果

表2 Plackett-Burman设计的因素与水平
由表1、2可以看出,接种量、酵母粉和培养温度这3个因素对酶活力影响极显著,其他5个因素对酶活力影响显著,所以将接种量、酵母粉和培养温度这3个因素进一步进行优化。由表2可看出,接种量对发酵产酶有显著正效应,酵母粉和培养温度对发酵产酶有显著负效应。若要提高产酶量,应该加大接种量,减少酵母粉浓度,降低培养温度。而其他条件的取值根据各因素效应的正负和大小,正效应的因素取较高值,负效应的因素取较低值。
2.2 最陡爬坡试验
由Plackett-Burman筛选出的3个主要因素的效应和大小比例设计其最陡爬坡路径,其中接种量有显著正效应,应增加;酵母粉和培养温度有显著负效应,应减少。设计结果如表3所示。

表3 最陡爬坡试验设计及其结果
由表3可以看出,最优产酶条件在试验3和试验5之间,故以试验4的条件为响应面试验的中心点。
2.3 响应面分析结果
2.3.1 Plackett-Burman设计及结果
以Plackett-Burman设计筛选出的3个极显著因素,结合最陡爬坡试验,选取试验4为中心点,采用Box-Behnken试验设计对菌株I13的产酶活力进行三因素三水平的响应面分析试验,共12个析因点和3个区域中心点(零点)。析因点是自变量取值在各因素所构成的三维顶点,区域中心点用以估计试验。各参数所代表的因素及水平如表4所示。

表4 Box-Behnken试验设计的因素与水平
利用Minitab15数据处理软件对15个试验点的响应值进行分析,以酶活力为响应值,经二次多元回归拟合,确定酶活力的预测值对酵母粉、温度、接种量的二元多次回归方程。试验结果如表5所示。

表5 Box-Behnken设计及试验结果
回归方程为
Y=315.7+7.02A-9.31B+19.76C-
54.71A2-28.09B2-30.89C2-
0.23AB+0.61AC-0.83BC
对回归方程求一阶偏导数等于零,可得到3个方程:
7.02-109.42A-0.23B+0.61C=0
(1)
-9.31-0.23A-56.18B-0.83C=0
(2)
19.76+0.61A-0.83B-61.78C=0
(3)
联立方程组(1)、(2)、(3)求解,得出模型的极值点:A=0.07,B=-0.16,C=0.32。产碱性蛋白酶菌株产酶的最优理论条件为:酵母粉质量浓度为10.2 g/L,温度为14.68 ℃,接种量为5.32%。由回归方程可以确定最大酶活力为321.34 U/mL。
2.3.2 二次回归拟合及方差分析
由回归系数的显著性分析(表6)可知该模型是显著的,回归方程中C、A2、B2、C2对Y值影响极显著,B对Y值的影响显著,其他项的系数均不显著,说明试验因子的线性和二次项对响应值都有很大关系,而交互项的影响相对较小。
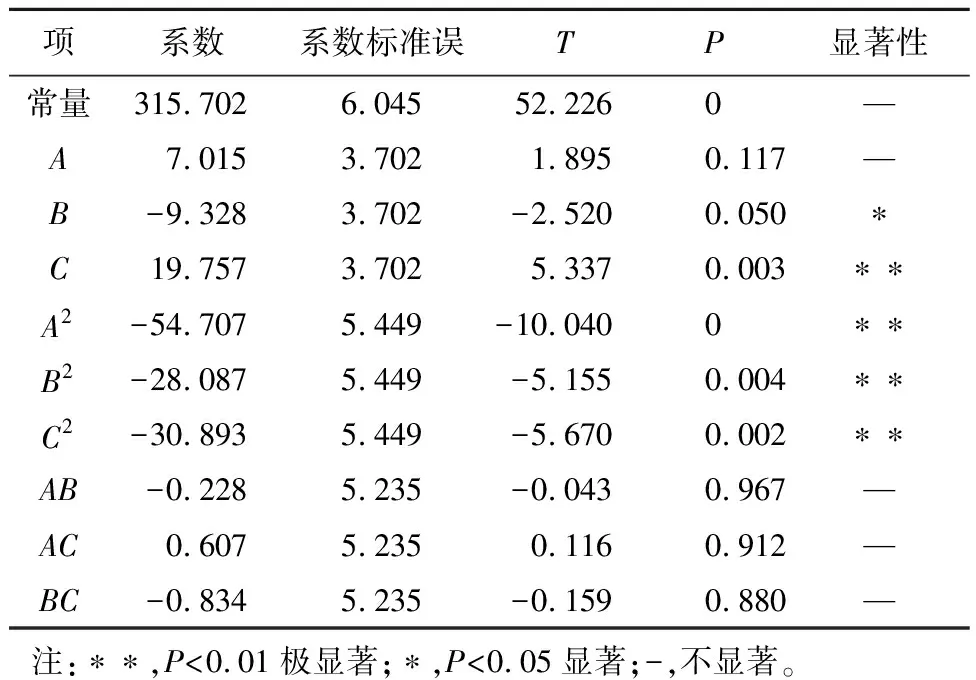
表6 回归系数显著性分析
由方差分析结果(表7)可知,模型的复相关系数的平方R2=97.29%,失拟项P=0.997,没有显著性的影响,说明二次回归方程的拟合程度很好,失拟较小,不需引入更高次数的项。该模型可以用于产碱性蛋白酶菌株产酶条件优化的理论预测。

表7 模型方差分析
2.3.3 响应曲面及等高线分析
将表5的试验结果经Minitab15分析软件处理,绘制其响应面曲线及等值线,见图1~3。图1~3直观地给出了各个因子对酶活力影响的曲面图及等高线图,酵母粉、培养温度和接种量都存在着相关性。图1表明,当接种量位于中心水平时,酵母粉和培养温度对酶活力影响的交互作用较显著,因为等高线的形状反应了交互作用的显著性,等高线图接近圆形则交互作用不显著,等高线图呈椭圆形则交互作用显著。由曲面图及等高线图可以直观看出酵母粉和培养温度的交互作用较显著。

图1 酵母粉(A)和培养温度(B)对酶活力影响的曲面图及等高线图
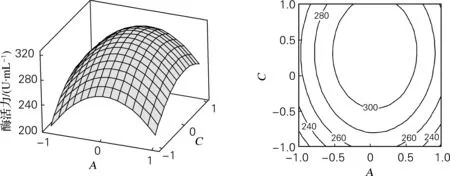
图2 酵母粉(A)和接种量(C)对酶活力影响的曲面图及等高线图

图3 接种量(B)和培养温度(C)对酶活力影响的曲面图及等高线图
图2是当培养温度位于中心水平时的交互作用较显著,酵母粉和接种量对酶活力影响的曲面图及等高线图。可以看出等高线图呈椭圆形,交互作用较显著。
图3是当酵母粉位于中心水平时,接种量和培养温度对酶活力影响的曲面图及等高线图。可以看出等高线图呈圆形,交互作用不显著。
2.3.4 最佳产酶条件的确定及验证试验
由求得的最优回归方程得到酶活力达到最大值时,酵母粉质量浓度为10.2 g/L,温度为14.68 ℃,接种量为5.32%,此时的最大酶活力为321.34 U/mL。为检验结果的可靠性,采取响应面分析法求得的最佳条件进行3次平行试验,结果得出酶活力分别为320.56、322.17、323.05 U/mL,均值为321.93 U/mL,与理论预测值基本吻合,平均误差为0.18%。因此,利用响应面分析法得到菌株I13最佳产酶条件真实可靠,具有实际意义。
3 结 论
碱性蛋白酶是在碱性范围内水解蛋白质肽键的酶类,是应用于工业生产中最为广泛的酶类之一。本研究是对前期筛选出的一株产碱性蛋白酶高产菌种用响应面法对其产酶条件进行优化。利用Minitab15数据处理软件优化了产碱性蛋白酶菌株的产酶条件,确定了接种量、酵母粉和培养温度这3个对酶活力影响极显著因素,用响应面曲线及等值线拟合出一个二次回归方程,找出产酶的最优组合为:酵母粉质量浓度10.2 g/L、培养温度14.68 ℃和接种量5.32%。用此最佳产酶条件进行了3次平行试验,其均值与理论预测值基本吻合。因此,经过响应面法的优化,碱性蛋白酶活力可达到321.34 U/mL,比优化前提高了151%。
[1] 胡学智, 王俊. 蛋白酶生产和应用的进展[J]. 工业微生物, 2008, 38(4):49-61.
[2] FRANCIS F, SABU A, NAMPOOTHIRI K M, et al. Use of response surface methodology for optimizing process parameters for the production of α-amylase byAspergillusoryzae[J]. Biochemical Engineering Journal, 2003, 15(2):107-115.
[3] LI Chan, BAI Jinghua, CAI Zhaoling, et al. Optimization of a cultural medium for bacteriocin production byLactococcuslactisusing response surface methodology[J]. Journal Biotechnology, 2002, 93(1):27-34.
[4] FAN Yaoting, LI Chenlin, LAY Jiunn-jyi, et al. Optimization of initial substrate and pH levels for germination of sporing hydrogen-producing anaerobes in cow dung compost[J]. Bioresource Technology, 2004, 91: 189-93.
[5] 姚峻,郭继强,赵睿,等. 响应面法优化提取大麦根中磷脂酶条件的研究[J]. 食品工业科技, 2009, 30(10):203-205.
[6] 赵国华,胡惠康,李楹,等. 氧化物修饰电极降解有机污染物的电催化特性[J]. 中国环境科学, 2003, 23(4):385-389.
