[Cu(Phen)(5-Fu)2](NO3)2配合物与牛血清白蛋白相互作用的荧光光谱研究
2011-09-24刘新光林晓芳谭荧飞陈伟贤冯杰雄朱敏豪吴都督
陈 稚,刘新光,林晓芳,谭荧飞,陈伟贤,冯杰雄,朱敏豪,吴都督
(广东医学院分析中心,广东东莞 523808)
[Cu(Phen)(5-Fu)2](NO3)2配合物与牛血清白蛋白相互作用的荧光光谱研究
陈 稚,刘新光,林晓芳,谭荧飞,陈伟贤,冯杰雄,朱敏豪,吴都督
(广东医学院分析中心,广东东莞 523808)
以Cu(Ⅱ)作为中心离子,5-氟脲嘧啶(5-Fu)和邻菲咯啉(Phen)作为配体,合成了[Cu(Phen)(5-Fu)2](NO3)2配合物;利用元素分析和红外光谱分析了配合物的组成和化学结构;利用荧光光谱考察了其与牛血清白蛋白(BSA)的相互作用.结果表明,配合物与BSA作用可导致BSA内源荧光猝灭;其猝灭机理为静态猝灭,速率常数为7.38×1012L·mol-1·s-1,结合常数 Ka=2.13×106L·mol-1,结合位点数 n=1.39.与此同时,该配合物能够猝灭BSA分子表面95.4%的色氨酸(Trp)残基,是良好的BSA淬灭剂.
铜(Ⅱ)配合物;牛血清白蛋白;相互作用;荧光光谱
Abstract:A complex[Cu(Phen)(5-Fu)2](NO3)2was designed and synthesized with Cu(NO3)2,fluorouracil(5-Fu),and 1,10-phenanthrotine(Phen)as the starting materials.The composition and chemical structure of resultant complex were analyzed by means of elemental analysis and infrared spectrometry.The interaction of[Cu(Phen)(5-Fu)2](NO3)2with bovine serum albumin(BSA)in Tris-HCl buffer system(p H=6.50)was studied using fluorescence spectrometry.It was found that the interaction between the complex and BSA resulted in quenching of endogenous fluorescence of BSA.The quenching process could be described with static quenching mechanism,with quenching rate constant being 7.38×1012L ·mol-1·s-1,binding constant being 2.13×106L ·mol-1and binding site number being 1.39.In the meantime,the complex could quench 95.4%of tryptophan(Trp)residue on the surface of BSA,showing promising potential as a candidate quenching agent for BSA.
Keywords:copper(Ⅱ)complex;bovine serum albumin;interaction;fluorescence spectrometry
蛋白质和金属配合物及药物分子相互作用的研究是近年来的研究热点之一[1].血清白蛋白是血浆中最为丰富的蛋白质,它具有广泛的结合能力,能与许多内源及外源性化合物结合.药物分子进入人体后,通常与血清白蛋白以分子间作用力结合,实现在血浆中储存、运输、到达靶部位进而发生药理作用,因而其作为体外研究药物的结合与运输模型备受重视[2].而5-氟脲嘧啶(5-Fu)是目前研究较多的抗癌药物之一,它能抑制胸腺嘧啶核苷酸合成酶的作用,阻断脱氧嘧啶核苷酸转换成胸腺嘧啶核苷酸,干扰DNA的合成,对食管癌、肝癌具有较好的治疗作用[3].研究5-Fu与血清白蛋白的相互作用,有利于了解药物与蛋白质的作用机制,为5-Fu的修饰和病理研究提供理论基础.另外,Cu是人体中重要的微量元素,它能调节体内铁的吸收和血红蛋白的合成,是多种酶的辅基,在生命活动中起着重要的作用[4].因此,研究Cu(Ⅱ)对药物与蛋白质结合的影响,有助于了解药物在体内的输送和作用机制,阐明金属离子在体内的生理作用.
虽然目前研究5-Fu与血清白蛋白相互作用的文献较多[5-6],但以5-Fu为配体的Cu(Ⅱ)配合物与血清白蛋白的作用研究尚未有文献报道,因此,作者以Cu(Ⅱ)为中心离子,5-Fu和邻菲咯啉(Phen)为配体,合成了[Cu(Phen)(5-Fu)2](NO3)2配合物,并利用荧光光谱考察了该配合物与牛血清白蛋白(BSA)的相互作用,并探讨其作用机理.
1 实验部分
1.1 试剂
牛血清白蛋白:生化试剂,上海丽珠东风生物技术有限公司;三羟甲基氨基甲烷:分析纯,中国医药集团上海化学试剂公司;5-氟脲嘧啶,1,10-邻菲咯啉:分析纯,天津科密欧化学试剂公司;Cu(NO3)2,无水乙醇,NaCl:分析纯,广东番禺化学试剂厂.
1.2 配合物的合成
在加热到80℃并搅拌条件下,依次将1 mmol Cu(NO3)2,3 mmol 5-Fu,10 mmol Phen的无水乙醇溶液混合,待有沉淀生成后,降低反应温度至40℃,反应5 h,静置过夜,抽滤.产品经无水乙醇和乙醚洗涤,真空干燥后即得.
1.3 配合物分析
配合物的Cu(Ⅱ)含量用二甲酚橙作指示剂,用 EDTA络合返滴定法测定,C、H、N元素分析用 Flash EA1112型元素分析仪(美国OI公司)测定,红外光谱用FTS175C-UMA500型傅利叶红外光谱仪(美国Bio-Rad公司)测定.
1.4 配合物与BSA的相互作用
牛血清白蛋白和配合物均用0.05 mol·L-1,p H=6.50的三羟甲基氨基甲烷(Tris)-HCl缓冲溶液配制,以0.10 mol·L-1NaCl溶液维持离子强度,所用水为二次蒸馏水.
荧光光谱测定过程:在28℃下,移取2.0 mL 1.0×10-5mol·L-1BSA于1 cm石英池中,用微量进样器逐次加入1.0×10-4mol·L-1配合物的水溶液进行荧光实验,每次加入溶液后混合均匀,以290 nm为激发波长,在天津F-4600日立荧光光谱仪(天津市金贝尔科技有限公司)上记录220~550 nm波长范围内的发射光谱,狭缝2 nm,扫描速度2 400 nm/min,电压700 V.
2 结果与讨论
2.1 配合物的表征
2.1.1 配合物的结构
配合物为蓝绿色粉末状固体,配合物Cu(Ⅱ)的含量和C、H、N元素分析数据,以及按预期配合物化学式[Cu(Phen)(5-Fu)2](NO3)2计算的理论值见表1.由表1中数据可见,实验值与理论值基本一致,因此确定配合物的化学式为[Cu(Phen)(5-Fu)2](NO3)2.

表1 配合物的元素分析Table 1 Data of elemental analysis %
2.1.2 配合物的红外光谱
表2列举了2种配体的主要红外特征吸收峰在形成配合物前后的变化.由表2可见,5-Fu的νC=O和νC=C在配合物中均发生了红移,但酮基位移较大,这说明与Cu(Ⅱ)配位的可能是羰基上的氧.而邻菲咯啉的红外光谱也发生了变化:C-H振动由858 cm-1和739 cm-1移动至852 cm-1和734 cm-1,频率变化不大,说明phen的基本骨架未变;C=N伸缩振动由原来的1 587 cm-1移动到1 571 cm-1,向低波数移动了17 cm-1,这与文献报道相似[7];而C=N伸缩振动则由1 645 cm-1移动到1 632 cm-1;这些特征峰不同程度地向低波数移动,表明邻菲咯啉的2个N原子上的孤对电子可能与Cu(Ⅱ)发生双齿配位,形成了鳌合环.而这2种配体主要吸收峰波数发生移动的表现,说明此两种配体确实与Cu(Ⅱ)发生了作用.

表2 配体和配合物的主要红外吸收峰Table 1 Principal IR band frequencies of the complex and ligands cm-1
2.2 配合物与BSA的作用
2.2.1 BSA的荧光猝灭效应
蛋白质分子中色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)可作为内源荧光探针检测蛋白质的构象变化.A类蛋白质(不含 Trp,只含Phe和 Tyr)荧光光谱主要表现 Tyr的特征,最大发射波长约为304 nm.B类蛋白质(含有 Trp)荧光光谱则主要表现 Trp的特征,最大荧光发射在310~360 nm之间.处于蛋白质分子表面的 Trp残基具有350~353 nm的荧光发射峰,而包埋于蛋白质内部的 Trp残基的荧光发射峰在326~342 nm之间,处于非极性环境的 Trp残基的荧光发射峰在310~324 nm附近[8].
BSA由于含有色氨酸,酪氨酸和苯丙氨酸残基,因而具有较强的内源荧光;而配合物溶液荧光强度很弱,对BSA的荧光发射光谱无影响.本实验以290 nm为激发波长,记录220~550 nm波长范围内的发射光谱,结果如图1所示.由图1可以发现,BSA在350 nm附近有一强的荧光发射峰,说明是由BSA分子表面的Trp残基产生.随着配合物浓度的增加,虽然BSA的荧光发射光谱的峰位和峰形不变,但其内源荧光产生有规律的猝灭,即其荧光强度逐渐降低,表明BSA与配合物发生了作用.
2.2.2 配合物对BSA的荧光猝灭机理
如果荧光体BSA与猝灭体配合物是由于热运动等发生碰撞而引起BSA的荧光猝灭,则这种动态猝灭服从Stern-Volmer方程:

其中 F0为猝灭体不存在时荧光体的荧光强度,F为加入猝灭体后的荧光强度,Kq为双分子猝灭常数,[Q]为猝灭体浓度(即配合物浓度),τ0为猝灭体不存在时荧光体的荧光寿命,KD为Stern-Volmer常数.根据公式(1),将350 nm处的 F0/F对所加入配合物总浓度[Q]作图,得到该配合物对BSA的Stern-Volmer猝灭曲线(见图2):F0/F=7.38×104[Q]+0.501,r=0.997.该曲线的斜率即为配合物的 KD值.由于生物分子的荧光寿命τ0约为10-8s,因此可计算得到配合物表观猝灭常数 Kq(Kq= KD/τ0)为7.38×1012L·mol-1·s-1.各种猝灭剂对生物分子的最大扩散碰撞猝灭常数约为2.0×1010L·mol-1·s-1[9],而实验所得的表观猝灭常数 Kq远大于其扩散控制的猝灭常数2.0×1010L·mol-1·s-1,所以猝灭过程不可能是因为分子扩散和碰撞所引起的动态猝灭,而是由于配合物与BSA发生配位引起的静态猝灭.
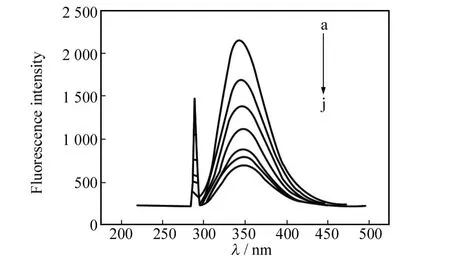
图1 配合物浓度对BSA荧光光谱的影响Fig.1 Effects of the complex on the fluoresence emission spectra of BSA

图2 BSA与配合物作用的Stern-Volmer方程曲线Fig.2 Stern-Volmer quenching plot of BSA withincreasing concentration of complex
2.2.3 配合物与BSA的结合位点数 n、结合稳定常数 K的计算
对于静态猝灭,由荧光强度与猝灭剂浓度的关系,可求得荧光分子与猝灭剂的结合常数.设BSA有 n个相同且独立的结合位点,则有:

则结合稳定常数 K为:

式(3)中[BSA]、[Q]和[QnBSA]分别为作用达到平衡时的游离BSA的浓度、配合物浓度以及配合物-BSA复合物的浓度.
若荧光体BSA的总浓度为[BSA]0,则[BSA]0=[QnBSA]+[BSA].当[Q]>[BSA]0时,可以用猝灭剂配合物的起始浓度代替其平衡浓度,则:

在静态猝灭中,体系的荧光强度 F与其游离浓度成正比(所生成的配合物-BSA复合物是非荧光性的),即:

由(4)和(5)式可推得:

以lg[(F0-F)/F]对lg[Q]作图,应为一条直线,直线斜率为结合位点数n,而由直线截距可以求得配合物与BSA结合的稳定常数 K值(见图3).由图3的数据,最后求得结合常数 K=2.13×106L·mol-1,结合位点数n=1.39.可见,配合物与BSA可形成一个结合位点,而且结合常数比较大,说明两者之问具有较强的结合力,配合物可以在体内被蛋白质运输、储存.
2.2.4 配合物猝灭BSA分子中Trp残基的百分数
由Stern-Volmer方程推导可得[8]:
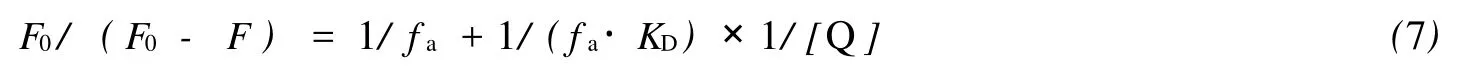
其中 fa为可被荧光猝灭剂接近的发色基团占总的发色基团的百分比;KD为可被荧光猝灭剂Q所接近的发色基团的Stern-Volmer猝灭常数.作 F0/(F0-F)~ 1/[Q]曲线如图4,求得 fa=0.954,即配合物能够猝灭BSA分子中95.4%的 Trp残基.由此可见,作者合成的[Cu(Phen)(5-Fu)2](NO3)2配合物对于BSA来说是一种很好的淬灭剂,它与BSA有特定的结合位点,但结合部位的定位及结合过程中构象如何变化还有待于进一步研究.

图3 lg(F0-F)/F与lg[Q]关系曲线图Fig.3 The relationship between lg(F0-F)/Fand lg[Q]
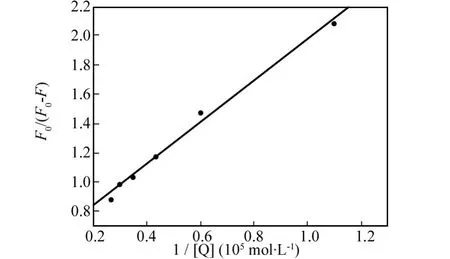
图4 F0/(F0-F)与1/[Q]关系曲线图Fig.4 The relationship betweenF0/(F0-F)and 1/[Q]
3 结论
以Cu(Ⅱ)为中心离子,5-Fu和 Phen为配体,合成了[Cu(Phen)(5-Fu)2](NO3)2配合物,并在p H为6.50的条件下,用荧光光谱法研究了该配合物与BSA结合反应的特征.该配合物对BSA具有荧光猝灭作用,该猝灭过程为静态猝灭,结合位点数 n=1.39,具有一个结合位点;其结合常数为2.13×106L·mol-1,与BSA具有较强的相互作用,能够结合形成较稳定的配合物.另外,该配合物能够猝灭BSA分子中表面95.4%的 Trp残基,是一种很好的BSA淬灭剂.
[1]王小锋,陈昌云.镧-邻菲咯啉-氟尿嘧啶配合物与DNA相互作用[J].分析化学,2009,37(1):157-157.
[2]吴锦绣,李梅,柳召刚,等.荧光法研究稀土与血清白蛋白相互作用的进展[J].稀土,2009(2):86-90.
[3]孙洁胤,周芝芳,刘放.5-氟脲嘧啶在大鼠肠道吸收动力学及其结肠吸收促进剂的研究[J].浙江省医学科学院学报,2004,15(1):18-22.
[4]黄钰婷,任祥祥,刘海峰,等.邻菲咯啉合铜配合物与牛血清白蛋白的相互作用[J].化学研究,2009,20(2):37-40.
[5]贾华丽,李艳霞,橄笑娜.5-氟脲嘧啶与牛血清白蛋白相互作用的光谱研究[J].周口师范学院学报,2010,27(2):67-70.
[6]贾华丽,王春杰,王小光.荧光光谱法研究5-氟脲嘧啶与牛血清白蛋白的相互作用[J].光谱实验室,2010,27(2):651-654.
[7]赵永亮,连锡山.肉桂酸-邻菲咯啉-稀土三元固体配合物的合成[J].内蒙古大学学报:自然科学版,1993,24(5):553-554.
[8]黄新河,刘鑫,李佳,等.秋水仙碱与牛血清白蛋白相互作用的光谱性质研究[J].四川大学学报:自然科学版,2005,42(2):377-381.
[9]刘雪锋,夏咏梅,方云,等.三种香豆素类中药小分子与牛血清白蛋白的相互作用[J].化学学报,2004,62(16):1484-1490.
Fluorescence spectrometric study of interaction between complex[Cu(Phen)(5-Fu)2](NO3)2and bovine serumalbumin
CHEN Zhi,LIU Xin-guang,LIN Xiao-fang,TAN Ying-fei,CHEN Wei-xian,FENGJie-xiong,ZHU Min-hao,WU Du-du
(Center of Analysis,Guangdong Medical College,Dongguan523808,Guangdong,China)
O 623.662
A
1008-1011(2011)02-0025-05
2010-11-08.
广东省大学生创新实验项目(KY1037)与广东省卫生厅项目(B2009190).
陈稚(1979-),女,硕士,研究方向为药物分析和生物化学.
