异丙酚抑制脂多糖致大鼠脑损伤时p38 MAPK的活化
2011-09-14曹慧灵邓必高
曹慧灵, 但 伶, 邓必高
(重庆医科大学附属第二医院麻醉科,重庆400010)
脂多糖(lipopolysaccharide,LPS)系革兰氏阴性菌细胞壁组成成分,目前已明确,LPS通过复杂的信号转导机制引起一系列级联反应,可导致细胞变性和死亡,表现为组织结构损害和器官功能衰退[1]。其中p38 MAPK信号通路在介导细胞对LPS的激活反应中发挥着重要作用[2]。p38 MAPK激活后可诱导诱导型一氧化氮合酶(inducible-nitric oxide synthase,iNOS)表达上调[3]。异丙酚是一种镇静催眠静脉麻醉药,大量研究证明异丙酚具有脑保护作用,异丙酚可以降低LPS诱发的促炎细胞因子表达[4]。最近的研究发现,异丙酚可以通过抑制MAPK信号通路来发挥其抗炎作用[5]。但异丙酚对大鼠LPS性脑损伤时p38 MAPK通路的活化尚未见报道,本研究拟通过观察异丙酚对大鼠LPS性脑损伤时p38 MAPK通路活化和iNOS表达的影响,探讨其减轻LPS性脑损伤的机制。
材料和方法
1 材料
1.1 动物 健康清洁级SD大鼠72只,6周龄,雌雄不限,体重200-250g,由重庆医科大学动物实验中心提供。
1.2 主要试剂 LPS(E.coli,055∶B5,Sigma),异丙酚(批号为0912211 XLH,四川国瑞药业有限责任公司),兔抗大鼠磷酸化p38 MAPK(p-p38 MAPK)多克隆抗体和兔抗大鼠iNOS多克隆抗体均购自Bioworld,RIPA裂解液(强)(碧云天生物技术研究所),辣根酶标记山羊抗兔IgG和ECL化学发光液均购自Pierce,SABC免疫组化试剂盒和DAB显色试剂盒均购自武汉博士德公司。
2 方法
2.1 大鼠LPS性脑损伤模型的制备和分组 动物被随机分为3组:正常对照组(C组)、LPS组(LPS组)和LPS+异丙酚组(LPS+P组),各组按观察时点分为 6、24、48、72 h 4个亚组。参照文献[6]的方法,仰卧位固定大鼠,颈正中切口,充分暴露并分离左颈总动脉、左颈外动脉和左颈内动脉。将左颈外动脉结扎,然后用微动脉钳夹闭左颈总动脉近心端,穿刺左颈总动脉远心端,LPS组、LPS+P组经由左颈内动脉注射LPS 1 mg/kg,15 s内注射完毕,LPS+P组注射LPS后立即腹腔注射异丙酚100 mg/kg,C组分别于左颈内动脉和腹腔给予与LPS和异丙酚等容量的生理盐水。
2.2 标本制备 各组动物观察至相应时点经麻醉后快速断头取脑,在冰盘上迅速分离大脑皮质,-80℃低温冰箱保存待测p-p38 MAPK。在鼠脑中后1/3处,经冠状面切取脑片厚约3 mm,置于4%多聚甲醛中固定,石蜡包埋切片,用于iNOS表达的测定和光镜观察,其余脑组织用于测定脑含水量。
2.3 脑组织形态学观察 取大脑皮质石蜡包埋,切片,HE染色后,光镜下观察病理学结果。
2.4 脑组织含水量的测定 称脑组织湿重后,将其放入80℃烘箱内烘烤36 h,称干重,计算脑组织含水量,脑组织含水量=[(湿重-干重)/湿重]×100%。
2.5 Western blotting法检测脑皮质p-p38 MAPK的表达取脑皮质组织0.02 g匀浆,经RIPA裂解液提取蛋白,再用考马斯亮蓝法测定蛋白含量。测完蛋白含量后,计算含50 μg蛋白的溶液体积为上样量上样,经10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,用湿法将蛋白条带电转至硝酸纤维素膜上,5%脱脂奶粉封闭1 h,兔抗大鼠p-p38 MAPK多克隆抗体(1∶500)4℃孵育过夜,辣根酶标记山羊抗兔IgG(1∶5 000)37℃孵育2 h,采用化学发光法显色,暗室中曝光、显影、定影。抗鼠β-actin作为内参照校正加样蛋白浓度。采用Quantity One 4.6.2软件进行蛋白条带灰度分析,以反映p-p38 MAPK表达水平。
2.6 脑组织iNOS表达的测定 采用免疫组织化学方法进行检测,石蜡切片经常规脱蜡、水化,滴加iNOS多克隆抗体(1∶100)后,按SABC试剂盒说明常规进行免疫组化染色,用PBS代替iNOS多克隆抗体作为阴性对照。光镜下胞浆中有棕黄色颗粒的细胞为iNOS表达阳性细胞。光镜下观察并拍照,每张切片任选6个高倍视野,采用Image-Pro Plus 6.0图像分析系统进行图像分析,以表达阳性细胞的吸光度反映iNOS表达水平。
3 统计学处理
采用SPSS 17.0软件进行统计学分析,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,脑含水量与p-p38 MAPK、iNOS作直线相关分析。
结 果
1 光镜结果
C组各时点HE染色大脑皮层结构清晰,细胞形态未见异常;LPS组大脑皮层可见弥散性灶性水肿区,神经细胞周围空晕增宽及细胞核固缩;LPS+P组各相应时点上述损伤程度较LPS组减轻,见图1。

Figure 1.Pathological changes of brain tissues at 6 h(HE staining,×200).A:control group;B:LPS group;C:LPS+P group.图1 6 h光镜下大脑皮质组织的病理学结果
2 脑组织含水量的表达
与C组比较,LPS组各时点脑组织含水量升高(P<0.05),与LPS组相比,LPS+P组脑组织含水量表达水平降低(P <0.05),见表1。
3 p-p38 MAPK和iNOS蛋白表达
与C组比较,LPS组脑组织p-p38 MAPK和iNOS表达水平均于6 h开始增加,24 h达高峰,48 h及72 h各指标仍高于C组(P<0.05);与LPS组相比,LPS+P组各时点pp38 MAPK和 iNOS表达水平降低(P<0.05),见表2和图 2、3。
4 相关性分析
脑组织含水量与p-p38 MAPK、iNOS蛋白表达水平呈正相关(r=0.692,r=0.769,P <0.05)。
讨 论
本研究通过颈内动脉注射LPS制备脑损伤模型,HE染色光镜下见LPS组神经细胞周围空晕增宽及细胞核固缩,表明发生了脑损伤。脑组织含水量是反映脑损伤重要指标,本研究结果表明,与C组比较,LPS组各时点脑组织含水量升高,提示LPS性脑损伤模型制备成功。
表1 不同时点脑组织含水量的比较Table 1.Comparison of brain water content(BWC)at different time points(%.±s.n=6)
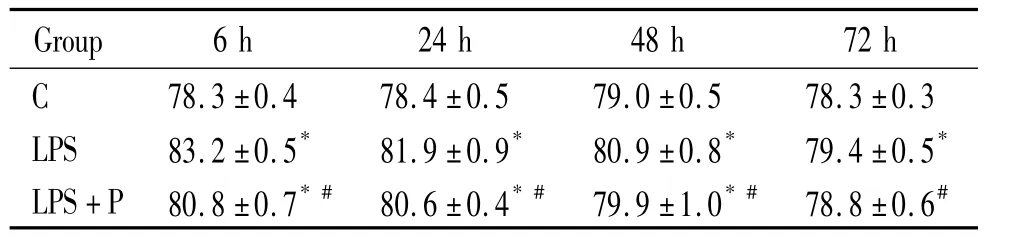
表1 不同时点脑组织含水量的比较Table 1.Comparison of brain water content(BWC)at different time points(%.±s.n=6)
*P<0.05 vs C group;#P<0.05 vs LPS group.
Group 6 h 24 h 48 h 72 h C 78.3 ±0.4 78.4 ±0.5 79.0 ±0.5 78.3 ±0.3 LPS 83.2 ±0.5* 81.9 ±0.9* 80.9 ±0.8* 79.4 ±0.5*LPS+P 80.8 ±0.7*# 80.6 ±0.4*# 79.9 ±1.0*# 78.8 ±0.6#
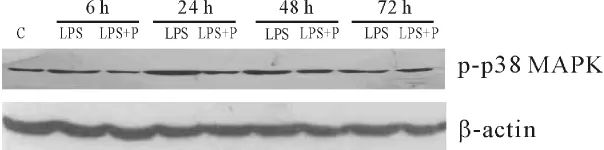
Figure 2.Western blotting photograph showed the expression of p-p38 MAPK in brain cortex.图2 Western blotting检测各组大鼠脑皮质p-p38MAPK表达
表2 不同时点p-p38 MAPK和iNOS的表达水平Table 2.Expression of p-p38 MAPK and iNOS in brain tissues at different time points(±s.n=6)
*P <0.05 vs C group;#P <0.05 vs LPS group.
Index Group 6 h 24 h 48 h 72 h p - p38 MAPK C 5.4 ±0.4 5.3 ±0.4 5.5 ±0.5 5.3 ±0.3 LPS 13.0 ±0.7* 19.6 ±0.7* 14.7 ±0.8* 12.6 ±0.8*LPS+P 8.0 ±0.9*# 10.2 ±0.5*# 9.0 ±0.8*# 7.5 ±1.5*#iNOS C 0.008 ±0.003 0.008 ±0.003 0.011 ±0.003 0.009 ±0.003 LPS 0.070 ±0.008* 0.119 ±0.009* 0.084 ±0.007* 0.061 ±0.003*LPS+P 0.055 ±0.004*# 0.091 ±0.004*# 0.064 ±0.006*# 0.045 ±0.005*#
p38 MAPK是1993年在脂多糖刺激小鼠巨噬细胞中首次发现的一种新的磷酸化蛋白激酶,属于MAPK的亚类之一,是信号由细胞表面转导到细胞内部的重要传递者,在调节炎症反应中具有重要作用[2]。p38 MAPK受到不同的细胞外刺激,包括LPS、促炎症因子、紫外线等作用下,三肽区的苏氨酸、酪氨酸双磷酸化而被最终激活,p38 MAPK被上游的分子磷酸化后,即移入细胞核内,进一步磷酸化下游的蛋白激酶和转录因子,从而上调炎症细胞因子TNF-α、IL-1β等基因表达[7]。有报道 p38 MAPK信号通路可导致iNOS激活[8]。正常脑组织中iNOS几乎不表达,iNOS活化后可诱导产生大量NO,一方面NO作为炎症介质,经弥散进入细胞后,通过激活鸟苷酸环化酶,使环磷酸鸟苷水平升高而发挥舒血管作用,引起血管通透性增加,并导致间质水肿;另一方面NO与O2-结合生成过氧亚硝酸盐阴离子(ONOO-),而ONOO-是一种较强的氧自由基,可诱导细胞膜发生脂质过氧化反应,引起细胞膜完整性受损,抑制线粒体呼吸,导致细胞水肿、破裂、线粒体肿胀和溶酶体破裂[9]。本研究结果表明LPS组各时点脑组织p-p38 MAPK和iNOS表达高于C组,p-p38 MAPK蛋白水平在LPS组6 h开始升高,24 h达高峰,72 h仍有较高表达,且p-p38 MAPK、iNOS与脑含水量表达水平呈正相关,即p-p38 MAPK的时相变化水平与脑损伤病变过程基本一致,提示p38 MAPK通路参与LPS致大鼠脑损伤的发生和发展过程,其作用机制可能与p38 MAPK促进iNOS激活从而导致组织损伤有关。
异丙酚的脑保护作用机制包括抑制炎症细胞因子的表达、抗氧化特性、调节 γ-氨基丁酸受体等。最新研究表明在LPS刺激的RAW264.7细胞中异丙酚可抑制iNOS表达和NO生物合成[10],异丙酚也可以通过抑制p38 MAPK激活,减轻细胞水肿[11]。本研究结果表明,与LPS组比较,LPS+P组脑损伤程度减轻,p-p38 MAPK与iNOS表达下调,提示异丙酚可能通过抑制p38 MAPK活化和iNOS表达,从而减轻LPS性脑损伤。
[1]Ning H,Wang H,Zhao L,et al.Maternally- administered lipopolysaccharide(LPS)increases tumor necrosis factor alpha in fetal liver and fetal brain:its suppression by low - dose LPS pretreatment[J].Toxicol Lett,2008,176(1):13-19.
[2]姚 琳,余书勤,张锡然.内毒素诱导p38 MAPK信号转导作用的研究进展[J].中国病理生理杂志,2004,20(12):2357-2362.
[3]Bhat NR,Feinstein DL,Shen Q,et al.p38 MAPK-mediated transcriptional activation of inducible nitric-oxide synthase in glial cells.Roles of nuclear factors,nuclear factor κB,cAMP response element - binding protein,CCAAT/enhancer-binding protein-β,and activating transcription factor-2[J].J Biol Chem,2002,277(33):29584-29592.
[4]Li S,Bao H,Han L,et al.Effects of propofol on early and late cytokines in lipopolysaccharide-induced septic shock in rats[J].J Biomed Res,2010,24(5):389 -394.
[5]Jawan B,Kao YH,Goto S,et al.Propofol pretreatment attenuates LPS-induced granulocyte-macrophage colony-stimulating factor production in cultured hepatocytes by suppressing MAPK/ERK activity and NF-κB translocation[J].Toxicol Appl Pharmacol,2008,229(3):362-373.
[6]Yu PL,Zhou PF,Yang YJ,et al.Brain edema model induced with typhoid endotoxin in rabbits[A].In:Inaba Y,Klalzo I,Spatz M.eds.Brain edema[M].Berlin:Springer Vertag,1985.113 -116.
[7]Kaminska B.MAPK signalling pathways as molecular targets for anti-inflammatory therapy-from molecular mechanisms to therapeutic benefits[J].Biochim Biophys Acta,2005,1754(1 -2):253 -262.
[8]Ruano D,Revilla E,Gavilan MP,et al.Role of p38 and inducible nitric oxide synthase in the in vivo dopaminergic cells'degeneration induced by inflammatory processes after lipopolysaccharide injection [J]. Neuroscience,2006,140(4):1157-1168.
[9]Guzik TJ,Korbut R,Adamek-Guzik T.Nitric oxide and superoxide in inflammation and immune regulation[J].J Physiol Pharmacol,2003,54(4):469 -487.
[10]Lee CJ,Tai YT,Lin YL,et al.Molecular mechanisms of propofol-involved suppression of NO biosynthesis and inducible iNOS gene expression in LPS-stimulated macrophage - like RAW 264.7 cells[J].Shock,2010,33(1):93-100.
[11]潘彩飞,祝胜美.异丙酚通过抑制p38激活下调氨处理的大鼠脑星形胶质细胞AQP4的表达并减轻细胞水肿[J].中国病理生理杂志,2010,26(1):96-100.
