活血益气方药物血清对转染VEGF165脐静脉内皮细胞分泌NO、eNOS的影响1)
2011-09-13张冬梅吴爱明娄利霞李丽娜吕晞滢
张冬梅,陈 萌,吴爱明,娄利霞,李丽娜,吕晞滢
活血益气方由黄芪、党参、丹参、川芎、赤芍等药物组成,是以活血益气法为指导思想而构建的经验方。大量研究显示,本方不仅在临床观察中防治心肌梗死后心力衰竭(心衰)有效,而且在多项动物实验研究中也证实有逆转心肌梗死后心室重构的作用[1,2]。促进梗死边缘区血管新生是活血益气方治疗缺血性心脏病的作用机制之一,其促血管新生作用可能与其诱导缺血心肌局部血管内皮生长因子(vascular endothelial growth factor,VEGF)表达有关[3]。VEGF165是 VEGF家族中发挥生物学效应的主要成分,是VEGF-A最丰富的异构体[4]。因此,为了进一步探讨活血益气方对缺血性心脏病治疗性血管生成的作用机制,我们通过构建pcDNA3.1-VEGF165重组质粒,转染至人脐静脉内皮细胞(HUVEC)中,构建HUVEC细胞VEGF信号通路激活细胞模型,离体观察活血益气方及其拆方药物血清对VEGF165基因转染脐静脉内皮细胞分泌一氧化氮(NO)、内皮型一氧化氮合成酶(eNOS)的影响,以期部分揭示活血益气方作用的细胞学机制。
1 材料与方法
1.1 HUVEC-2 人脐静脉内皮细胞HUVEC-2(Cat No.200t-5n,Cell application)购自北京清源浩生物科技有限公司。
1.2 动物 成年健康雄性Sprague-Dawley大鼠,体重250 g~270 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2009-0080。
1.3 仪器 超净工作台(北京半导体一厂),二氧化碳培养箱(Heraeus GBB16,德国),IMT-2倒置显微镜(OLYMPUS,日本),LDZ5-2低速自动平衡离心机(北京雷勃尔),HHW21-420电热恒温水浴箱(天津泰斯特),THZ-C恒温振荡器(北京太仓),PHS-3B精密PH计(上海雷磁),酶标仪(ClinicBio,美国)。GeneQuant紫外分光光度计(Pharmacia,美国),DYCZ-24DN型电泳仪、DYCZ-40D型电泳仪(北京六一厂)。
1.4 药物和试剂 活血益气方由黄芪60 g、党参60 g、丹参10 g、川芎10 g、赤芍10 g等药物组成。益气方由黄芪 60 g、党参60 g等药物组成;活血方由丹参10 g、川芎10 g、赤芍10 g等药物组成。所有药物均采用免煎颗粒,由北京未名天人中药有限公司生产。常温干燥保存。
培养基 Medium 200(Cat No.M-200-500,GIBCO),生长因子LSGS(Cat No.S-003-10,GIBCO),购自北京清源浩生物科技有限公司。pcDNA3.1空质粒购自Invitrogen life technologies公司,pcDNA3.1-VEGF165质粒[Bam HI/sal I fragment of VEGF165 encoding,Region(ORF)in pcDNA3.1 Bam HI/NoT I site]的构建及测序鉴定由北京泛基诺科技有限公司完成。TIAN pure Midi Plasmid Kit(dp107-02),由天根生化科技北京有限公司提供。BCA法蛋白定量试剂盒(NO.P1511),RIPA裂解液(NO.P1053),5×loading buffer(NO.B1007),NC硝酸纤维素膜(NO.2110),Super ECL Plus超敏发光液(NO.P1010),蛋白 Marker(NO.P1100),NO assay kit(E1030),均购自北京普利莱基因技术有限公司。Fugene HD transfection reagent(NO.04709705001,Roche),兔抗人VEGF抗体及羊抗兔IgG,购自武汉博士德生物工程有限公司。人eNOS酶联免疫分析试剂盒(NO.HRZ-H0210,R&D公司,进口分装),购自北京优博奥生物科技有限公司。
1.5 药物血清的制备 参照文献[5]换算出大鼠等效剂量。按照活血益气方组 15.86 g/(kg·d),活血方组3.17 g/(kg·d),益气方组12.68 g/(kg·d)的剂量给正常SD大鼠灌服中药制剂,每日1次,持续给药1周,末次给药后 1 h,无菌条件下由腹主动脉取血,取血清,56℃灭活 30 min,分装,-80℃冻存备用。另选正常大鼠喂以等量生理盐水,以同样方法制备生理盐水药物血清。
1.6 pcDNA3.1-VEGF165质粒的提取和纯化 将构建的pcDNA3.1-hVEGF165质粒转化至感受态大肠杆菌中,经氨苄西林抗性筛选,DNA测序验证后,大量扩增阳性克隆。用TIAN pure Midi Plasmid Kit按照说明书抽提、纯化质粒重组体。收集质粒溶液后,用Genequant紫外分光光度计测得溶液A 260/A 280,计算质粒的浓度和纯度。
1.7 pcDNA3.1-VEGF165质粒的瞬时转染 Medium 200与LSGS按比例添加。常规培养HUVEC,至95%融合后,按照2×105/mL的密度种入6孔板,每孔3 m L,培养24 h。根据Fugene HD说明书操作,转染pcDNA3.1-hVEGF165质粒。质粒∶Fugene HD按照 2∶3(μg/μL)以M edium 200配制,室温静置孵育15 min后,加入细胞长至80%~90%融合的6孔板中,37℃,5%CO2培养。转染4 h后,以添加血清的新鲜Medium200-LSGS培养基终止转染。转染后HUVEC细胞常规培养于6孔板中,加入5%活血益气方及其拆方含药动物血清、5%生理盐水药物血清培养48 h,阴性对照组不加药物血清,仅加入Medium 200-LSGS培养。空白对照组HUVEC既不进行质粒转染,也不加入药物血清,仅以Medium 200-LSGS常规培养。取细胞上清,3 000 r/min离心20 min后,分装于1.5 mL ep管中,每管500μL,冻存于-80℃冰箱中备用。
1.8 Western blot测定HUVEC细胞VEGF蛋白的表达 以0.01 mol/L PBS轻轻洗涤细胞两次,每孔加入100μL RIPA裂解液,置冰上裂解20 min后,用干净的细胞刮刷将细胞刮于孔的一侧,然后用移液器将细胞碎片和裂解液移至1.5 m L离心管中,4℃,12 000 r/min离心5 min,取上清。取2μL样品,按照说明书,采用BCA蛋白定量试剂盒检测。剩余样品按比例加入5×loading buffer,100℃煮20 min,分装后-80℃保存。每个样品取100μg置于10%SDS-PAGE凝胶上电泳分离,4℃条件下转移至NC膜上。室温下用5%脱脂奶粉封闭1 h。VEGF抗体以封闭液按照1∶1 000的比例稀释,与NC膜一起封闭在杂交袋中4℃旋转过夜后,与1∶6 000比例稀释的羊抗兔IgG,室温孵育1 h。用SuperECL Plus超敏发光液按试剂说明要求显影、曝光。用 Quantity one分析软件将图片上每个特异条带灰度值数字化。目的蛋白的灰度值除以内参β-actin(1∶2 000)的灰度值以校正误差,所得结果即为样品中VEGF蛋白相对表达量。
1.9 重氮反应法(Griss法)测定HUVEC细胞NO的分泌 取100 mmol/L NaNO2标准品8μL,加入992μL蒸馏水中,得到1 000μL的800μmol/L标准品。从800μmol/L管取出200μL加入200μL蒸馏水的400μmol/L管,然后依次取样用蒸馏水倍比稀释,得到 200 μmol/L、100 μmol/L、50 μmol/L、25 μmol/L、12.5μmol/L、6.25μmol/L、3.13μmol/L、1.56μmol/L 管。最后设置不加标准品的零浓度管。取50μL标准品或细胞上清样品,加入96孔板中。每孔加入50μL Griess R1,室温避光放置5 min。然后,每孔加入50μL Griess R2,充分混匀,室温避光放置5 min,30 min内,在492 nm测定吸光度。以平均吸光度OD值为X轴,标准品浓度为Y轴,用Excel作图并得到标准曲线公式。将样品OD值代入公式计算NO浓度。
1.10 ELISA法测定HUVEC细胞eNOS的分泌 按照说明书配制标准品,设空白对照孔,标准品孔 36 U/L、24 U/L、12 U/L、6 U/L、3 U/L,每孔 50μL。待测样品孔中,每孔先加入40μL样品稀释液,然后再加入待测细胞上清样品10μL(样品最终稀释度为5倍)。加样时将样品加于酶标孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后置37℃温育30 min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后,在餐巾纸上扣干。重复5次。每孔加入酶标试剂50μL,空白孔除外。用封板膜封板后37℃温育30 min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 s后,在餐巾纸上扣干。重复5次。每孔先加入显色剂A 50μL,再加入显色剂B 50μL,轻轻振荡混匀,37℃避光显色15 min。每孔加入终止液50μL,终止反应时孔中蓝色立即转为黄色。以空白空调零,450 nm波长,15 min内测定每孔OD值。根据标准曲线计算相应样品浓度,并乘以稀释倍数。
2 结 果
2.1 pcDNA3.1-VEGF质粒的提取和纯化 所提取的pcDNA3.1-VEGF165质粒 A260/A 280在1.7~1.8之间,浓度约为0.7μg/μL。
2.2 含药血清对转染后HUVEC细胞VEGF蛋白表达的影响阴性对照组、药物血清各组与空白对照组比较,均可促进HUVEC细胞表达VEGF蛋白(P<0.01)。活血益气方药物血清组、活血方药物血清组、益气方药物血清组与阴性对照组比较,其VEGF蛋白表达虽高于阴性对照组,但仅活血益气组与阴性对照组比较有统计学意义。活血方组、益气方组、生理盐水组VEGF蛋白表达低于活血益气方组,差异有统计学意义。详见图 1、图2。
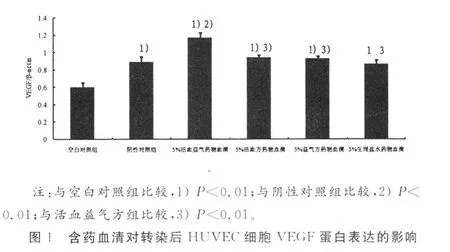

2.3 含药血清对转染后HUVEC细胞分泌NO的影响 各药物血清组、阴性对照组与空白对照组比较,能促进HUVEC细胞分泌 NO(P<0.05或P<0.01)。活血益气药物血清组、活血药物血清组、益气药物血清组三者比较,差异无统计学意义。详见表1。
表1 含药血清对转染后HUVEC细胞分泌NO的影响( ±s)

表1 含药血清对转染后HUVEC细胞分泌NO的影响( ±s)
组别 n NO(μmol/L)空白对照组 6 93.86±37.28阴性对照组 6 227.50±68.001)5%活血益气药物血清组 6 372.26±71.821)3)5%活血药物血清组 6 338.22±92.871)2)5%益气药物血清组 6 353.91±26.131)3)5%生理盐水药物血清组 6 270.25±43.941)4)与空白对照组比较,1)P<0.01;与阴性对照组比较,2)P<0.05,3)P<0.01;与活血益气药物血清组比较,4)P<0.01
2.4 药物血清对转染后HUVEC细胞分泌eNOS的影响 阴性对照组、活血益气药物血清组、活血药物血清组、益气药物血清组、生理盐水药物血清组,其HUVEC细胞分泌的eNOS含量均高于空白对照组(P<0.01)。各药物血清组中,仅活血益气药物血清组eNOS含量高于阴性对照组(P<0.01)。活血药物血清组、益气药物血清组eNOS含量低于活血益气药物血清组(P<0.01)。详见表2。
表2 药物血清对转染后HUVEC细胞分泌eNOS的影响( ±s)
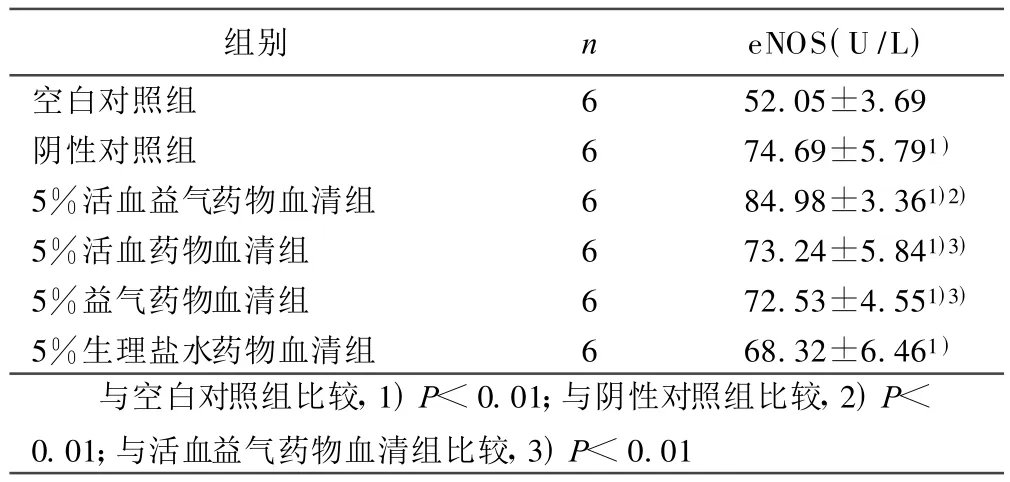
表2 药物血清对转染后HUVEC细胞分泌eNOS的影响( ±s)
组别 n eNOS(U/L)空白对照组 6 52.05±3.69阴性对照组 6 74.69±5.791)5%活血益气药物血清组 6 84.98±3.361)2)5%活血药物血清组 6 73.24±5.841)3)5%益气药物血清组 6 72.53±4.551)3)5%生理盐水药物血清组 6 68.32±6.461)与空白对照组比较,1)P<0.01;与阴性对照组比较,2)P<0.01;与活血益气药物血清组比较,3)P<0.01
3 讨 论
VEGF是一种特异性的与血管生长有关的生长因子,在血管新生的起始阶段及其后的血管形成、稳定过程中发挥着关键作用[6]。前期实验结果显示,活血益气方可以诱导缺血心肌局部VEGF表达,促进梗死边缘区血管新生[3],但其具体作用机制不明。
VEGF广泛分布在人体各组织的细胞浆中,主要在血管内皮细胞中表达。血管内皮细胞既是血管形成的结构基础,也是VEGF作用的靶细胞。由于内皮细胞自身VEGF表达水平较低,无法形成有效浓度。因此,本实验通过构建 pcDNA3.1-VEGF165重组质粒,外源性转染VEGF165基因,使之在内皮细胞中高表达、高分泌。在此基础上观察活血益气方药物血清对转染VEGF165基因的HUVEC细胞的影响,探讨活血益气方治疗性血管新生的作用机制。实验结果显示,转染后的HUVEC细胞中VEGF蛋白的表达明显高于空白对照组,上清液中NO和eNOS的分泌也明显增多。表明质粒转染成功,转基因后HUVEC的NO、eNOS分泌能力增强。
NO由血管内皮细胞释放,不仅可以单独诱导内皮细胞的迁移和增殖,蛋白酶的释放以及增加血管通透性有关[7],而且调节各种血管生成因子而影响血管生成[8],促毛细血管的管腔形成[9]。也是血管生成必需的调节因子。
研究显示,NO在VEGF信号活动中起着一定的作用,尤其是对VEGF的促内皮细胞增殖及迁移作用[10]。NO不仅可通过低氧诱导因子-1及其DNA黏结活性的增强来诱导VEGF基因转录,进而上调VEGF的表达[11];还可通过激活可溶性鸟苷酸环化酶,调节细胞内的cGMP水平而发挥上调VEGF表达的作用[12]。而VEGF对血管通透性的影响是又通过促进血管内皮细胞分泌NO和前列环素来发挥生物效应[13],增强内皮完整性,抑制血管平滑肌细胞增殖,增加内皮抗血栓等血管保护作用。
eNOS是调节NO生成的关键酶。内皮细胞中,在Ca2+和热休克蛋白的介导下,VEGF通过 PI3激酶/Akt信号通路使eNOS磷酸化,激活eNOS[14],促进NO生成,调节血管的通透性和紧张性以及血管新生。eNOS的表达增加有利于冠脉侧支循环的生成[15]。
本实验结果显示,活血益气方不仅可以促进转染后HUVEC表达VEGF蛋白,还可以促进其分泌NO及eNOS。提示,活血益气方能通过促进直接促进NO的分泌,或通过促进eNOS分泌,催化生成NO,来参与VEGF的血管新生过程,对缺血心肌的血管新生实现调节。其中,活血方和益气方单用均可以促进转染后HUVEC细胞分泌NO,但对eNOS的分泌未见明显影响,其具体作用机还有待进一步研究。
[1] 王硕仁,赵明镜.活血、益气方药对心肌梗塞后心力衰竭大鼠血流动力学的影响[J].北京中医药大学学报,2001,24(7):37-39.
[2] 王振涛,王硕仁,赵明镜.活血和益气方药对心肌梗死后左心衰大鼠左心室重构影响的比较研究[J].中国中西医结合杂志,2002,22(5):376-378.
[3] 张冬梅,吴爱明,娄利霞,等.活血益气方对心梗后大鼠缺血心肌血管新生及 VEGF表达的影响[J].辽宁中医杂志,2010,37(8):1602-1604.
[4] Sugihara T,Wadhwa R,Kaul SC,et al.A novel alternatively spliced form of murine vascular endothelial growth factor VEGF165[J].J Biol Chem,1998,273(5):3033-3038.
[5] 徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:202-204.
[6] Ferrara N.VEGF and the quest for tumor angiogenesis factors[J].Nat Rev Cancer,2002,2(10):795.
[7] Dulak J,Jozkowicz A.Nitric oxide and angiogenic activity of endothelial cells director VEGF dependem effect[J].Cardiovases,2002,56:487-488.
[8] Dan G,Duda DF,Rakesh KJ.Role of eNOS in neovascularization:NO for endothelial progenitor cells[J].Trends M ol Med,2004,10(4):143-145.
[9] 周国伟,张建军.促血管新生治疗的机制与应用国外医学[J].国外医学:血管疾病分册,2000,27(3):90-93.
[10] 关勤,刘志勇.分子搭桥技术研究进展[J].东南大学学报(医学版),2006,25(3):212-224.
[11] Sandau KB,Fandrey J,Brune B.Accumulation of HIF-1 aunde the influence of nitric oxide[J].Blood,2001,97:1009-1015.
[12] Jenkins DC,Charles IG Thomsen LL,et al.Role of nitric oxidein ttnnor growth[J].Proc Nat I Acad Sci USA,1995,92:4392-4396.
[13] Oh SJ,Jeltsch MM,Birkenhager R,etal.VEGF and VEGF-Capecific induction of angiogenesis and lymphangiogenesis in the differentiated avianchorioallant oicm-embrane[J].Develop Biol,1997,188:96.
[14] Govers R,Rabelink TJ.Cellluar regulation of endothelial nitric oxide synthase[J].Am J Phy siol Renal Physiol,2001,280:F193-F206.
[15] Cai Weijun,Elisabeth Kocsis,Luo Xuegang,et al.Expression of endothelial nitric oxide synthasein the vascularrwall during arteriogenesis[J].Mol Cell Biochem,2004,264:193-200.
