淋巴囊肿病毒mcp基因变异特征及其基因型分析
2011-09-13闫秀英吴灶和简纪常鲁义善孙修勤
闫秀英,吴灶和,简纪常,鲁义善,孙修勤
(1.广东海洋大学广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江524025; 2.国家海洋局第一海洋研究所海洋生态研究中心,山东青岛266061)
淋巴囊肿病毒mcp基因变异特征及其基因型分析
闫秀英1,吴灶和1,简纪常1,鲁义善1,孙修勤2
(1.广东海洋大学广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江524025; 2.国家海洋局第一海洋研究所海洋生态研究中心,山东青岛266061)
淋巴囊肿病毒是引起多种海、淡水鱼淋巴囊肿病的病原,且不同淋巴囊肿病毒分离株间存在一定的差异。本文对25株淋巴囊肿病毒分离株mcp基因的变异特征进行分析,结果表明:分离自同一宿主的淋巴囊肿病毒mcp基因序列并非完全一致,有些同宿主分离株间存在着较少的变异,其MCP蛋白序列间的变异位点多位于不规则结构域、属于非蛋白相互作用位点;分属不同基因型淋巴囊肿病毒分离株MCP蛋白序列间的变异位点也多位于不规则结构域,变异位点为蛋白相互作用位点的比率仅占21.98%。金头鲷淋巴囊肿病毒分离株LCDV-sa是一种新的淋巴囊肿病毒基因型,此25株淋巴囊肿病毒可分为7个基因型。对淋巴囊肿病毒变异的研究,可加深对其感染机制的认识,有助于了解其传播途径,可为淋巴囊肿病的防控提供重要的理论依据。
淋巴囊肿病毒;mcp基因;变异;基因型
淋巴囊肿病毒(Lymphocystis disease virus, LCDV)属于虹彩病科(Iridoviridae)、淋巴囊肿病毒属(L ym phocystivirus)[1],可引起全球140多种淡、海水鱼发生淋巴囊肿病[2-3],也可在多种海、淡水鱼细胞中扩增并引起宿主细胞产生病变现象[4-5]。淋巴囊肿病毒一直受到国内外学者的广泛关注。
淋巴囊肿病毒是双链DNA病毒,目前已获得LCDV-1(欧洲株)和LCDV-C(中国株)全基因组序列[6-7],但二者基因组差异很大,如LCDV-1基因组为102,653 bp,编码195个ORF,而LCDV-C基因组为186 250 bp,编码240个ORF。比较LCDV-1和LCDV-C基因组发现,mcp基因相似率最高,为78.9%[8]。在淋巴囊肿病毒属,mcp基因是相当保守的,但同时也存在着足以区分相近淋巴囊肿病毒分离株的变异。mcp基因的进化,适宜作为淋巴囊肿病毒系统关系分析的分子标记[9]。目前的资料表明淋巴囊肿病毒应该存在多种基因型,已经发现的有:淋巴囊肿病毒基因型I(包括LCDV-1)、淋巴囊肿病毒基因型II (包括牙鲆分离株等)、淋巴囊肿病毒基因型III(包括岩鱼分离株)[8]、淋巴囊肿病毒基因型IV(包括军曹鱼和鲈鱼分离株)、淋巴囊肿病毒基因型V(包括玻璃鱼分离株)、淋巴囊肿病毒基因型VI(包括珍珠鱼分离株)[10-11]。
本文对25株不同淋巴囊肿病毒分离株mcp基因变异特征及其基因型进行分析,从而为了解病毒感染的地缘分布和在不同宿主群体中的差异奠定基础,同时,也为了解病毒在感染过程中与环境因子间的作用特征和进化趋势提供理论依据。
1 材料与方法
1.1 材料
本文所用的25株淋巴囊肿病毒分离株和石斑鱼虹彩病毒GIVmcp基因序列取自GenBank数据库。表1为各淋巴囊肿病毒分离株[5-6,8,10,11-13]和石斑鱼虹彩病毒的名称、缩略名、采集地、宿主和mcp基因序列的GenBank编号。
1.2 方法
1.2.1 mcp基因序列分析 通过DNAStar软件并结合人工调整,对mcp基因DNA序列进行排序;用MEGA5.0[14]和DnaSP[15]软件分析变异位点、信息位点和遗传距离。
1.2.2 淋巴囊肿病毒系统关系分析 利用Mode1 T est[16]对淋巴囊肿病毒的mcp序列做进化模式模拟,并将不同的模拟结果作为参考值构建系统树。用MEGA5.0[14]软件,构建最大简约树(ME)、最大似然树(ML)、邻接树(NJ)和UPGMA树。用MrBayes软件进行Bayesian分析,并采用genera1 time reversible +gamma+invariants(GTR+G+I)序列进化模型和Markov Chain Monte Carlo(McMc)取样方式估计系统发生关系。MrBayes分析参数为:nst=6,rates=gamma,进行10 000 000次重复检验后,统计所得结果,获得系统树的支系结构和各支的置信度。后验概率和系统树枝长计算参数为:bumin=500,contype= allcompat。
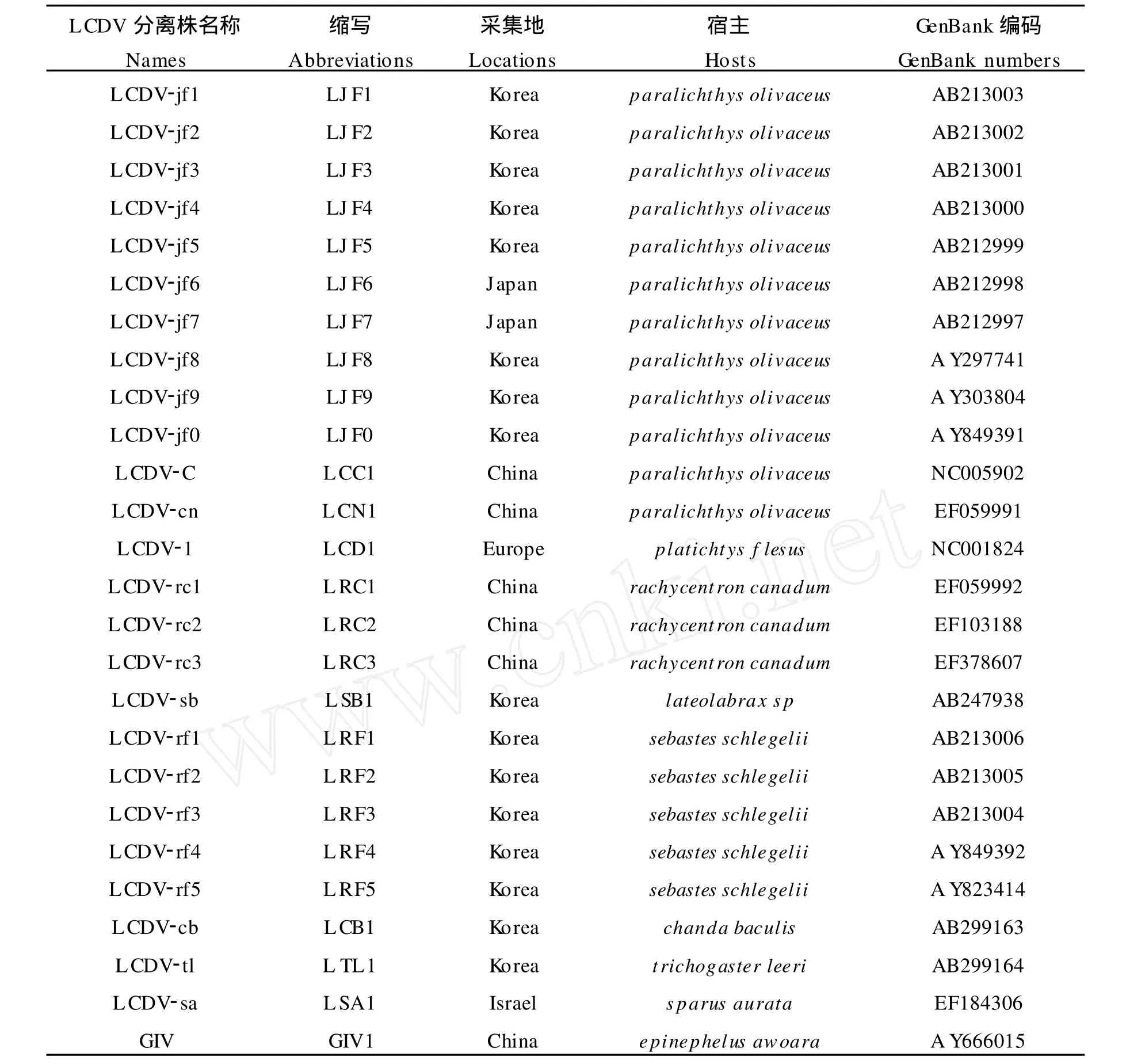
表1 淋巴囊肿病毒分离株的名称、缩略名、采集地、宿主和mcp基因序列的GenBank编号Table 1 The abbreviations of LCDV isolates,collected locations,hosts and accession numbers ofmcpgene sequences in GenBank
用PAUP[17]软件进行运算,Heuristic搜索采用二分支方式构建系统树支系(TBR branch swapping),并加入随机序列重复抽样;系统树各支的置信度,通过Bootstrap[18]重复抽样1000次后获得。
1.2.3 MCP蛋白序列分析 通过DNAstar软件并结合人工调整,对MCP蛋白序列进行排序;用Blast软件分析其变异位点。
1.2.4 MCP蛋白二级结构预测 应用Jpred、Net-SurfP、DLP-SVM、Porter、PSIpred、PredictProtein软件对MCP蛋白序列进行二级结构预测。
1.2.5 MCP三级结构和功能结构域预测 SWISS-3DIMAGE软件进行MCP蛋白三维结构模拟。用Smart软件对MCP蛋白的功能结构域进行预测分析。
2 结果
2.1 mcp基因序列分析
所分析的25株淋巴囊肿病毒分离株mcp基因部分序列长度为1323 bp,含有352个信息位点、457个变异位点,其中,位于第3位密码子的变异位点有320个、比率为70%;位于第2位密码子的变异位点有47个;位于第1位密码子的变异位点有90个。

表2 淋巴囊肿病毒分离株两两间的mcp基因序列相似度(对角线之上)和遗传距离(对角线之下)[×1000]Table 2 The identity rate ofmcpgene sequemce(upper diagonal)and the divergence(lower diagonal)among LCDV isolation[×1000]
从中国牙鲆分离的LCC1、LCN1与从韩国牙鲆分离的LJ F1、LJ F2、LJ F3、LJ F5、LJ F8、LJ F9mcp基因序列完全相同;从韩国牙鲆分离到的LJ F0、LJ F4的mcp基因序列存在3个变异位点;从日本牙鲆分离到的LJ F6、LJ F7的mcp基因序列存在4个变异位点;从中国、韩国和日本牙鲆分离到的LCN1、LJ F0、LJ F4、LJ F6、LJ F7的mcp基因序列间存在9个变异位点。
从韩国岩鱼分离到的LRF1、LRF2、LRF3的mcp基因序列完全相同,而从该鱼分离到的LRF1、LRF4、LRF5的mcp基因序列间存在12个变异位点。
从中国军曹鱼分离到的LRC1、LRC2的mcp基因序列完全相同,但从该鱼分离到的LRC1、LRC3的mcp基因序列间存在4个变异位点。
2.2 淋巴囊肿病毒系统关系分析结果
基于mcp基因序列,应用多种软件所构建的系统树的拓扑结构是一致的,置信度也基本相同。图1为基于mcp基因序列构建的UPGMA树,可见此系统树包括7个分支:LCDV-1为一分支,位于系统树的基部,与其它淋巴囊肿病毒分离株的系统关系较远;岩鱼淋巴囊肿病毒分离株和珍珠鱼淋巴囊肿病毒分离株各独为一支,且二者聚为一大支,表明二者亲缘关系较近;金头鲷淋巴囊肿病毒分离株和玻璃拉拉鱼淋巴囊肿病毒分离株各独为一支,且二者也聚为一大支,表明二者亲缘关系较近;军曹鱼淋巴囊肿病毒分离株和鲈鱼淋巴囊肿病毒分离株为一支,且二者小分支间的距离很小,说明二者亲缘关系很近;牙鲆淋巴囊肿病毒分离株为一支,位于系统树的顶部,且它们的亲缘关系非常近。

图1 基于mcp基因序列构建的UPGMA树(数字为置信度)Fig.1 The UPGMA tree of LCDV isolations based onmcpgene sequence(The number shows the degree of belief)
2.3 MCP蛋白序列分析结果
所分析存在差异的15株淋巴囊肿病毒MCP蛋白部分序列长度为441 aa,共有91个氨基酸位点发生变异。
15株淋巴囊肿病毒分离株MCP蛋白序列变异位点见图2。可见从韩国牙鲆分离到的LJ F0、LJ F4的 MCP蛋白序列存在2个变异位点,从日本牙鲆分离到的LJ F6、LJ F7的MCP蛋白序列存在3个变异位点,从中国、韩国、日本牙鲆分离到的LCN1、LJ F0、LJ F4、LJ F6、LJ F7的MCP蛋白序列间存在6个变异位点。从韩国岩鱼分离到的LRF1、LRF4、LRF5的mcp基因序列间存在8个变异位点。从中国军曹鱼分离到的LRC1、LRC3的MCP蛋白序列间存在2个变异位点。

图2 淋巴囊肿病毒MCP蛋白序列变异位点(灰色为变异位点)Fig.2 Sequence alignment of MCP of LCDV(the yellow denote the variable sites)
2.4 MCP二级结构预测结果
应用Jpred、NetSurfP、DLP-SVM、Porter、PSIpred、PredictProtein软件对MCP蛋白序列进行二级结构预测的结果基本一致,图3显示了MCP蛋白序列二级结构和蛋白相互作用位点。

图3 淋巴囊肿病毒MCP蛋白序列二级结构和蛋白相互作用位点预测(灰色为变异位点)Fig.3 Predicted secondary structure and protein-protein interaction sites of MCP of LCDV(the yellow denote the variable sites)注:H=α-helix;E=β-strand;C=random coil;P=protein-protein interaction sites
2.5 MCP三级结构和功能结构预测结果
应用SWISS-3DIMAGE软件对MCP蛋白三维结构模拟的结果见图4。

图4 MCP蛋白三维模拟结构Fig.4 The three dimensional model structure of MCP

图5 MCP功能结构域Fig.5 Motifs of MCP
图5 为MCP蛋白结构域的预测结果,可见MCP蛋白序列中的236-456 aa片段是Capsid功能结构域。
3 讨论
自然界中任何物种都存在变异,而为了适应在不同宿主细胞中的增殖,病毒可能会发生更多的基因变异。变异是生物体进化的根本原因,是生物进化的规律。病毒进化一般具有2条途径,一是病毒与宿主共同进化,一是病毒选择多种宿主,从而具有更为广阔的生存环境。一般而言,DNA病毒进化依照第一条途径[19]。
病毒的变异和进化,是病毒与宿主细胞和病毒与宿主个体及群体相互作用的结果。病毒的进化使病毒结构和特性不断发生适应性变化,甚至还有一些新种的出现。在病毒和细胞相互作用的过程中,由于宿主本身的原因,使病毒发生突变的概率是很大的。对病毒标准种的基因序列多样性进行分析研究,可了解病毒感染空间的地缘分布和对不同宿主群体的差异[20]。
迄今为止,已在欧、亚、美洲等地分离到多株淋巴囊肿病毒,有报道说不同宿主的淋巴囊肿病毒存在着变异[6-7,10,21]。本研究发现,有些分离自同一种宿主鱼、不同或相同地域的淋巴囊肿病毒分离株,其mcp基因序列是一致的,如韩国岩鱼分离株LRF1、LRF2、LRF3,中国军曹鱼分离株LRC1和LRC2,中国牙鲆分离株LCC1、LCN1和韩国牙鲆分离株LJ F1、LJ F2、LJ F3、LJ F5、LJ F8、LJ F9。其中韩国和中国地理位置较近,在两国分离到的牙鲆淋巴囊肿病毒可认为来自同一地域。但有些分离自同一种宿主鱼、同一地域的淋巴囊肿病毒分离株,其mcp基因序列也存在着变异,如LRF1、LRF4、LRF5的mcp基因序列间存在12个变异位点,LRC1、LRC3的mcp基因序列间存在4个变异位点,LJ F0、LJ F4的mcp基因序列间存在3个变异位点,LJ F6、LJ F7的mcp基因序列间存在4个变异位点。分离自同一宿主——牙鲆、不同地域(中国、韩国、日本)的淋巴囊肿病毒分离株LCN1、LJ F0、LJ F4、LJ F6、LJ F7的mcp基因序列间存在9个变异位点。这说明分离自同一宿主鱼的淋巴囊肿病毒变异较少,与地域的关系不大。
LJ F0、LJ F4 MCP蛋白序列间存在的2个变异位点中,1个位于β折叠区,1个位于不规则结构域,非P位点;LJ F6、LJ F7 MCP蛋白序列间存在的3个变异位点都位于不规则结构区,非蛋白相互作用位点;LCN1、LJ F0、LJ F4、LJ F6、LJ F7 MCP蛋白序列间存在的6个变异位点中,有4个位于不规则结构域,2个位于折叠区,非蛋白相互作用位点;LRF1、LRF4、LRF5 MCP基因序列间存在的8个变异位点中,有2个位于不规则结构域,4个位于折叠区,2个位于螺旋区,非蛋白相互作用位点;LRC1、LRC3 MCP蛋白序列间存在2个变异位点都位于不规则结构域,非蛋白相互作用位点。可见,来自同一宿主的淋巴囊肿病毒MCP蛋白序列存在更少的变异,变异位点多位于不规则结构域(57.14%),其次是折叠区(33.33%),再次是螺旋区(9.52%),而且变异位点全为非蛋白相互作用位点。
病毒的基因型分型目前还没有统一的标准,进行核苷酸序列分析是病毒基因型分型的方法之一。Okamoto[22]首先进行HBV核苷酸全序列分析,提出核苷酸序列差异度≥8%或同源性≤92%为分型界限。而且在淋巴囊肿病毒中,mcp基因是全基因组中相当保守的基因[9],是分析LCDV基因型的合适分子标记。由LCDV各分离株间的遗传距离(见表2)和构建的系统树(见图1)分析可得,此25株淋巴囊肿病毒可分为7个基因型,即淋巴囊肿病毒基因型I(LCDV-1)、淋巴囊肿病毒基因型Ⅱ(牙鲆分离株)、淋巴囊肿病毒基因型Ⅲ(岩鱼分离株)、淋巴囊肿病毒基因型Ⅳ(军曹鱼和鲈鱼分离株)、淋巴囊肿病毒基因型Ⅴ(玻璃拉拉鱼分离株)、淋巴囊肿病毒基因型Ⅵ(珍珠鱼分离株)、淋巴囊肿病毒基因型Ⅶ(金头鲷分离株),其中金头鲷淋巴囊肿病毒分离株LCDV-sa是1种新的基因型——淋巴囊肿病毒基因型Ⅶ。本研究的结论与闫秀英[10]和Hossain[11]的相关研究结论相符,不支持Kitamura[21]和Kvitt[23]的相关结论3个基因型的认定。本研究结果发现,淋巴囊肿病毒基因型和其宿主存在很大的关系,体现了淋巴囊肿病毒与宿主共进化的进化途径。
淋巴囊肿病毒mcp基因变异的主要原因是基因突变,由图2和图3比较可知,同宿主淋巴囊肿病毒分离株变异位点是一致的,不同基因型淋巴囊肿病毒分离株MCP蛋白序列间的多数变异位点位于不规则结构域(62.6%);变异位点为蛋白相互作用位点的比率仅为21.98%,大部分变异位点为非蛋白相互作用位点。由图3和图5可见,在MCP蛋白序列中,前90 aa(未知功能结构区)变异很少,且不是蛋白相互作用位点,推测淋巴囊肿病毒mcp基因的进化可能并未改变MCP蛋白的基本结构和基本功能。
淋巴囊肿病毒变异的深入研究,可加深其感染机制的认识,这对淋巴囊肿病的防治将产生重要影响。随着不同淋巴囊肿病毒分离株基因组全序列的测定,将能更清楚地阐明淋巴囊肿病毒的系统进化关系,为了解其传播途径和淋巴囊肿病防控提供重要的理论依据。
[1] Samalecos C P.Analysis of the structure of fish lymphocystis disease virions from skin tumours of pleuronectes[J].Arch.Virol, 1986,91(1-2):1-10.
[2] Tidona C A,Darai G.Lymphocystis disease virus(Iridoviridae) [M].//Granoff A,Webster R G,eds.Encyclopedia virology, USA:Academic Press.1999.
[3] Bunkley-Williams L,Williams E H Jr,Phelps R P,et al.Does lymphocystis occur in pacora,Plagioscion surinamensis(Sciaenidae),from Colombia[J]?Acta Tropica,2002,82:7-9.
[4] 孙修勤,洪旭光,张进兴,等.牙鲆淋巴囊肿病毒在牙鲆鳃细胞系FG29307中的增殖[J].高技术通讯,2002,12(1):94-96.
[5] Zhang Q Y,Ruan H M,Li Z Q,et al.Infection and propagation of lymphocystis disease virus isolated from the cultured flounder Paralichthys olivaceus in grass carp cell lines[J].Disease of A-quatic Organisms,2003,57(1):27-34.
[6] Tidona C A,Darai G.The complete DNA sequence of lymphocystis disease virus[J].Virology,1997,230:207-216.
[7] Zhang Q Y,Feng X,Jian X,et al.Complete genome sequence of lymphocystis disease virus[J].Journal of Virology,2004(5): 6982-6994.
[8] Kitamura S I,Jungl SJ,Kiml W S,et al.A new genotype of lymphocystivirus,LCDV-RF,from lymphocystis diseased rockfish [J].Arch Virol,2006,151:607-615.
[9] Tidona C A,Schnitzler P,Kehm R,et al.Is the major capsid protein of iridoviruses a suitable target for the study of viral evolution [J]?Virus Genes,1998,16:59-66.
[10] 闫秀英,孙修勤,吴淑勤,等.军曹鱼淋巴囊肿病毒的系统关系研究及基因型分析[J].高技术通讯,2007,17(10):1087-1091.
[11] Hossain M,Song J Y,Kitamura S I,et al.Phylogenetic analysis of lymphocystis disease virus from tropical ornamental fish species based on a major capsid protein gene[J].Journal of Fish Diseases,2008,31:473-479.
[12] 付小哲,石存斌,李宁求,等.军曹鱼淋巴囊肿病毒主衣壳蛋白基因全序列分析[J].病毒学报,2007,23(5):412-416.
[13] Kim T J,Jung T S,Lee J I.Expression and serological application of a capsid protein of an iridovirus isolated from rock bream, Oplegnathus fasciatus(Temminck&Schlegel)[J].J Fish Dis, 2007,30(11):691-699.
[14] Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution,2007,24:1596-1599.
[15] Rozas J,Rozas R.DnaSP version 3:an integated program for molecular population genetics and molecular evolution analysis[J].Bioinformatics,1999,15:174-175.
[16] Posada D,Crandall K.Modeltest:testing the model of DNA substitution[J].Bioinformatics,1998,14(9):817-8018.
[17] Swofford D L.PAUP:Phylogenetic analysis using parsimony and other methods[M].Sinauer Assoaates Sunderland,Massachusetts.1999.
[18] Felsenstein J.Confidence limits on phylogenies:An approach using the bootstrap[J].Evolution,1985,39:783-791.
[19] 黄文林.分子病毒学[M].北京:北京人民卫生出版社.2002.
[20] 李琦涵,姜莉.病毒感染的分子生物学[M].北京:化学工业出版社.2004.
[21] Kitamura S I,Jung S J,Oh M J.Diferentiation of Lymphocystis Disease Virus Genotype by Muhiplex PCR[J].The Joumal of Microbiology,2006(4):248-253.
[22] Okamoto H,Tsuda F,Sakugawa H,et al.Typing hepatitis B virus by homology in nucleotide sequence:comparison of surface antigen subtypes[J].J Gen Virol.1988,69(10):2575-2583.
[23] Kvitt H,Heinisch G,Diamant A.Detection and phylogeny of L ymphocystivirusin sea breamS parus auratabased on the DNA polymerase gene and major capsid protein sequences[J].Aquaculture,2008,275:58-63.
Abstract: Lymphocystis disease virus(LCDV)can cause lymphocystis disease in more than 140 fish species in seawater and freshwater,and there is some variations among different strains.We analyzed the mcpgene sequence in 25 LCDV isolations,results showed not all of themcpgene sequence in LCDV isolated from the same host is consistent.There are a few variant sites between different nucleotide acids among themcpgene sequences of some LCDV isolated from the same host,these sites usually locate on the random coil,only 21.98%are on the oprotein-protein interaction sites according to the software prediction.LCDV isolated fromsparus auratais attributed a new lymphocystis diseae virus genotype.The 25 LCDV isolations are respectively attributed seven genotypes.The research on variation of lymphocystis diseae virus can help to know more the spreading way.These can provide important academic basis for preventing and controlling lymphocystis disease.
Key words: lymphocystis disease virus;mcpgene;variation;genotype
责任编辑 于 卫
Sequence Variation in mcp Gene of Lymphocystis Disease Virus and the Genotype Analysis
YAN Xiu-Ying1,WU Zao-He1,J IAN Ji-Chang1,LU Yi-Shan1,SUN Xiu-Qin2
(1.Guangdong Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Guangdong Ocean U-niversity,Zhanjiang 524025,China;2.First Institute of Oceanography SOA,Qingdao 266061,China)
Q319;Q931
A
1672-5174(2011)04-039-07
国家科技支撑计划项目(2007BAD29B05);广东省科技计划重大专项(2008A020100014)资助
2010-07-28;
2010-11-21
闫秀英(1978-),女,讲师。E-mail:yanxiuying1201@126.com
