辛伐他汀对脓毒症大鼠肝功能的影响
2011-09-12赵鹤龄河北省人民医院重症医学科河北石家庄05007
赵鹤龄 陆 鹏 (河北省人民医院重症医学科,河北 石家庄 05007)
重度脓毒症和脓毒症休克是危重疾病监护病房(ICU)病人主要死亡原因之一,尽管相关指南及集束化治疗的实施,如早期充分抗生素治疗、早期目标导向液体复苏、肺保护性通气、小剂量糖皮质激素、控制血糖等措施,但脓毒症死亡人数仍以每年1.5%的比例增加〔1〕。脓毒症的发病机制主要认为是失控的炎症级联反应,最终导致器官衰竭及死亡,相关研究也主要集中在对炎症反应的调控〔2〕。本研究应用盲肠结扎及穿孔(CLP)方法制作大鼠脓毒症模型,观察辛伐他汀预处理对脓毒症大鼠肝功能的影响,为临床脓毒症防治提供理论依据。
1 材料与方法
1.1 实验动物 清洁级健康雌性Wistar大鼠80只,体重200~250 g(河北医科大学实验动物中心,合格证编号:909043)。饲养于恒温(20℃)清洁饲养室,喂养普通大颗粒饲料,给予充足水分,通风良好,温度适宜,所有大鼠实验前均于饲养室适应性饲养1 w。实验前禁食12 h,自由饮水。80只大鼠随机分为4组,正常对照组(8只);假手术组(24只);脓毒症模型组(24只);辛伐他汀干预后造模组(24只)。除正常组外其他各实验组按留取标本处死大鼠时间点(造模后6、24 h和48 h),随机分为3组,每组8只。
1.2 药物干预与造模 辛伐他汀干预后组每只大鼠按辛伐他汀20 mg·kg-1·d-1将辛伐他汀片(杭州默沙东制药有限公司H19990366)碾碎后溶于1 ml生理盐水灌胃,其余各组给予等量生理盐水。给药时间为14 d后,按传统方法制作大鼠CLP脓毒症模型,造模后大鼠出现精神倦怠、躁动、寒战、腹胀、眼角分泌物增多、竖毛等表现,直肠温度较造模前升高或降低1℃视为造模成功的标志。观察期间出现死亡的动物将其排除,并重新造模补充。
1.3 标本收集与检测 正常对照组大鼠给药14 d后即留取血液标本,余各组在标本留取时间点从大鼠颈动脉取血2~3 ml后处死大鼠,离心机3 000 r/min,10 min取上清液,并放于-70℃冰箱保存待检。应用大鼠谷氨酸脱氢酶(GLDH)ELISA检测试剂盒和大鼠谷胱甘肽硫转移酶(GST)ELISA检测试剂盒(R&D美国)检测大鼠血清GLDH和GST水平。
1.4 统计学处理 应用SPSS10.0统计软件,计量资料数据以±s表示,组间差异采用单因素方差分析及Q检验。
2 结果
2.1 血清GST和GLDH变化 造模组大鼠血清GST和GLDH造模后进行性升高,明显高于正常对照组和假手术组大鼠同时间点血清GST和GLDH水平(P<0.05),造模后按6、24、48 h各时间点进行各组间比较,造模组较未造模组各时间点GST及GLDH均显著升高(P<0.05);而辛伐他汀干预组大鼠各时间点血清GST和GLDH水平明显低于脓毒症模型组大鼠(P<0.05)。见表1,表2。
表1 各组血清GLDH比较(± s,pg/ml,n=8)
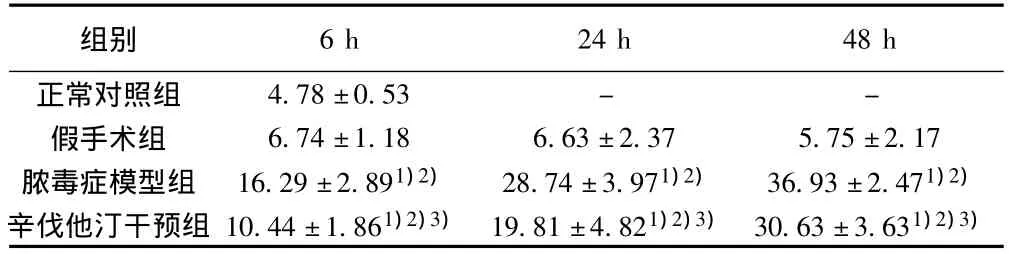
表1 各组血清GLDH比较(± s,pg/ml,n=8)
与正常对照组比较:1)P<0.05;与假手术组比较:2)P<0.05;与脓毒症模型组比较:3)P<0.05;下表同
组别6 h 24 h 48 h正常对照组4.78±0.53 - -假手术组 6.74±1.18 6.63±2.37 5.75±2.17脓毒症模型组 16.29±2.891)2) 28.74±3.971)2) 36.93±2.471)2)辛伐他汀干预组 10.44±1.861)2)3) 19.81±4.821)2)3) 30.63±3.631)2)3)
2.2 大鼠一般表现 假手术组大鼠在手术后2~3 h后可自由饮水及活动,未表现出任何异常状态。脓毒症模型组及辛伐他汀干预后造模组在手术后2~3 h后大鼠可自由饮水,6~8 h出现精神倦怠、躁动、寒战、腹胀、眼角分泌物增多、竖毛等表现,直肠温度较造模前升高或降低1℃,提示造模成功。
表2 各组血清GST比较(± s,ng/ml,n=8)

表2 各组血清GST比较(± s,ng/ml,n=8)
组别6 h 24 h 48 h正常对照组23.13±0.99 - -假手术组 25.16±2.64 24.33±2.58 26.86±1.40脓毒症模型组 50.6±3.071)2) 71.53±5.341)2) 102.48±5.281)2)辛伐他汀干预组 38.29±4.651)2)3) 49.41±5.951)2)3) 72.74±7.411)2)3)
3 讨论
本项研究证实,CLP脓毒症大鼠血清GLDH和GST水平明显升高,辛伐他汀预处理的脓毒症大鼠血清GLDH和GST水平尽管高于对照组大鼠,但较未处理的脓毒症大鼠显著降低,提示辛伐他汀预处理对脓毒症大鼠肝功能损害具有一定程度的保护作用。
GST是一组具有解毒和结合功能的同工酶,在肝细胞中主要分布于胞浆。其分子质量较转氨酶小,更易透过肝细胞膜,肝脏损伤时血清峰值出现比转氨酶早,因此血清GST是反映急性肝细胞损伤极为敏感的指标。又由于因其半衰期短(1~8 h),较早比转氨酶降至正常,从而有助于识别肝细胞损伤的终止〔3〕。GLDH主要分布于肝脏,是肝线粒体的特异性酶,肝线粒体外含量几乎为零,故可作为肝损害的特异性指标。一旦肝细胞发生病变累及线粒体时,GLDH即有显著性升高〔4,5〕。本研究提示肝细胞损伤随脓毒症进展进一步加重。
感染时促炎因子如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6、IL-8 等大量释放促进了脓毒症的发展〔6,7〕,进而使可诱导型一氧化氮合酶(iNOS)表达的增加,一氧化氮(NO)产生增加,导致内皮细胞功能及血管机能异常〔8〕。同时存在时间依赖性的白细胞增殖、迁移、黏附的增加和P选择素在血管内皮的表达。脓毒症期间除了因组织灌注不足,引起细胞缺血、缺氧而损伤线粒体外,细菌产生的内毒素可直接作用于细胞,产生大量氧自由基并抑制能量生成〔9〕。氧自由基可导致线粒体内部的氧化应激反应,使线粒体内膜发生脂质过氧化以及内膜蛋白中巯基发生氧化而丧失功能,导致线粒体膜电位下降〔10〕,进而引起线粒体钙超载、呼吸功能障碍和DNA损伤,最终使ATP合成受阻,细胞能量供应不足,凋亡调控系统激活而发生细胞凋亡。此外,细胞因子通过增加组织因子(TF)和纤溶酶原激活物抑制物-1(PAI-1)释放和活化诱导凝血功能紊乱,导致微循环中微血栓生成,使微循环受阻,影响器官灌注,脓毒症时多种途径的共同作用最终导致了肝脏及其他器官功能障碍。
他汀类药物属羟甲基戊二酰辅酶(HMG-CoA)抑制剂,临床中广泛用于降血脂治疗,他汀类药物除了降脂作用以外还有一系列有益的生物学效应,被称为“多效性作用”。他汀类药物抑制多种炎症急性期反应物的产生,从而抑制NO产生,维护内毒素休克时受损的血管反应性。他汀类药物可通过下调内皮细胞黏附分子P选择素、CD11b、CD18的表达和抑制淋巴细胞功能相关抗原介导的白细胞黏附从而减少白细胞对内皮的黏附。并可明显减低脂多糖诱导的和金黄色葡萄球菌毒素诱导的白细胞的增殖与迁移。同样可以通过改变组织纤溶酶原激活剂(tPA)和PAI-1的水平与活性而促进纤维蛋白溶解,减低纤维蛋白原的水平。
他汀类药物的多种抗炎机制发挥对大鼠炎症及缺血/缺氧状态肝脏的保护作用。线粒体发生损伤的主要原因为缺氧,而肝线粒体的特异性酶GLDH升高说明脓毒症导致肝脏微循环灌注不足,引起肝细胞的缺血、缺氧而发生损伤。本研究表明辛伐他汀可能具有改善脓毒症时肝脏微循环作用。其机制与他汀类药物抗炎、免疫调节、改善微循环等多种作用有关。是否他汀类药物也与在缺血/再灌注损伤状态时一样能够减少脓毒症大鼠肝细胞凋亡,以及在脓毒症状态时肝脏保护的确切机制等尚需深入研究。
1 Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care〔J〕.Crit Care Med,2001;29(7):1303-10.
2 Leaver SK,Finney SJ,Burke-Gaffney A,et al.Sepsis since the discovery of Toll-like receptors:disease concepts and therapeutic opportunities〔J〕.Crit Care Med,2007;35(5):1404-10.
3 Chouker A,Martignoni A,Schauer RJ,et al.Alpha gluthathione S-transferase as an early marker of hepatic ischemia/reperfusion injury after liver resection〔J〕.World J Surg,2005;29(4):528-34.
4 O'Brien PJ,Slaughter MR,Polley SR,et al.Advantages of glutamate dehydrogenase as a blood biomarker of acute hepatic injury in rats〔J〕.Lab Anim,2002;36(3):313-21.
5 Difraia R,Wilquet V,Ciardiello MA,et al.NADP+dependent glutamate dehydrogenase in the antarctic psychrotolerant bacterium psychrobacter sp,TAD1,charaterization,protein and DNA sequence,and relationship to other glutamate dehydrogenases〔J〕.Eur J Biochem,2000;267(1):121-31.
6 Andrews P,Azoulay E,Antonelli M,et al.Year in review in intensive care medicine,2006 II.Infections and sepsis,haemodynamics,elderly,invasive and noninvasive mechanical ventilation,weaning,ARDS〔J〕.Int Care Med,2007;33(2):214-29.
7 Marshall JC.Such stuff as dreams are made on:mediator-directed therapy in sepsis〔J〕.Nat Rev Drug Discov,2003;2(5):391-405.
8 Vo PA,Lad B,Tomlinson JA,et al.Autoregulatory role of endotheliumderived nitric oxide(NO)on lipopolysaccharide-induced vascular inducible NO synthase expression and function〔J〕.J Biol Chem,2005;280(8):7236-43.
9 Crouse E,Exline M,Knoell D,et al.Sepsis:Links between pathogen sensing and organ damage〔J〕.Curr Pharm Des,2008;14(19):1840-52.
10 Schenkman KA,Arakaki LS,Ciesielski WA,et al.Optical spectroscopy demonstrates elevated intracelluar oxygenation in an endotoxic model of sepsis in the perfused hear〔tJ〕.Shock,2007;27(6):695-700.
