催化氧化法处理含芳胺模拟废水的研究
2011-09-03柴多里杨保俊吴亚利
柴多里, 洪 虹, 杨保俊, 吴亚利
(合肥工业大学化学工程学院,安徽合肥 230009)
芳胺类物质作为重要的有机中间体,在医药、农药、印染等化工领域都有着广泛的应用[1]。芳胺类化合物具有很高的毒性,对人体有致畸或致癌作用[2]。许多国家都制定了严格的芳胺排放标准,根据我国的污水综合排放标准[3],芳胺类化合物废水的二级排放标准质量浓度≤2 mg/L。因此芳胺类化合物工业废水的处理是一个十分值得重视的问题。
处理芳胺废水的常用方法有物理法、生化法和化学法[4]。物理法中活性炭是目前废水处理中普遍采用的吸附剂,可用于各类废水的处理,但是其再生循环使用较为复杂[5-6]。在处理废水时,采用溶剂萃取法溶剂回收过程中易造成二次污染。生化法由于芳胺废水的毒性强、可生化性差,处理浓度大的废水时,效果较差。化学法以Fenton及类Fenton氧化法为高级氧化技术中的一种重要方法,Fenton反应是利用Fe2+催化H2O2分解产生◦OH,从而引发有机物的氧化降解反应[7]。Fenton法因其具有反应条件温和、操作简单、费用较低以及环境友好等优点,被广泛地应用于各种有机废水的高级氧化处理研究中[8-9],但催化剂不能循环使用及因催化剂的流失而引起的二次污染是其主要缺陷。
近年来,非均相类Fenton法处理有机废水引起了人们广泛关注[10-11],采用此种方法,催化剂易于分离循环使用,避免了催化剂可能带来的二次污染,而且废水处理使用催化剂用量也较少,可降低废水的处理成本。本文以自制的Fe3O4纳米颗粒作为催化剂,处理含芳胺的模拟废水,不仅具有较高的芳胺去除率,而且催化剂可循环使用,克服了传统的Fenton氧化法处理废水过程中的催化剂产生的二次污染的现象。
1 实验部分
1.1 试剂和仪器
试剂:苯胺、对硝基苯胺模拟废水;H2O2(30%);催化剂纳米Fe3O4粉体以FeSO4◦7H2O为铁源自制。
仪器:722N分光光度计(上海精密科学仪器有限公司);XJ-Ⅲ型COD消解装置(广东省环境保护仪器设备厂);pHS23C型精密pH计(上海雷磁仪器厂);D/max-γB12kW型 X-射线衍射仪(CuKαλ=0.154 nm)(日本理学电机公司);H-800透射电镜(Hitachi公司,加速电压为200 kV)。
1.2 实验方法
取100 mL含芳胺(苯胺484.3 mg/L,对硝基苯胺300 mg/L)的模拟废水、一定量的Fe3O4、H2O2(15%)加入500 mL三口烧瓶中,用H2SO4调节初始pH值,在设定的温度下搅拌反应至设定的时间后过滤,固体催化剂留作循环使用,滤液作进一步分析用。
1.3 芳胺废水的分析方法
芳胺重氮化后用氢氧化钠溶液调节反应pH值到12.2,再与邻甲氧基苯酚作用形成偶氮化合物,并通过分光光度法测定废水芳胺的剩余质量分数[12]。芳胺废水的去除率为:

其中,D为芳胺废水的去除率;ρ0、ρt分别为催化氧化降解前、后芳胺废水质量浓度 。
COD测定采用XJ-Ⅲ型COD消解装置进行消解(消解温度为(160±1)℃,消解时间为25 min),然后通过分光光度法进行测定。
2 结果与讨论
2.1 Fe3O4粉体的晶体结构及形貌分析
所制备Fe3O4样品的 XRD图如图1a所示,图1a中所有衍射峰均可指标化为立方晶型Fe3O4的特征衍射峰(JCPDS No.75-1609),未发现明显的杂质衍射峰,表明实验条件下所制备的样品为纯相立方晶型的Fe3O4。Fe3O4样品典型的TEM图片如图1b所示,从图1b可以看出,分散在铜网上的样品主要呈颗粒状形貌,轮廓分明,分散性良好,颗粒直径为20~50 nm。

图1 Fe3O4样品的XRD和T EM图
2.2 反应时间对含芳胺模拟废水去除率的影响
反应时间对模拟废水中芳胺去除率的影响如图2所示。
由图2可知,随着反应时间的增加,模拟废水中苯胺的去除率上升趋势较迅速,当反应达到60 min后,随着时间的增加,去除率不再有显著的上升趋势。可以看出苯胺废水反应达到一定阶段后,模拟废水中芳胺去除率基本保持稳定,再增加反应时间意义不大。模拟废水中对硝基苯胺去除率随反应时间的增加,呈明显上升趋势,当反应达到4 h后随着反应时间增加,去除率变化不太明显。反应时间较长可能是由于对硝基苯胺中的硝基为吸电子基团,使得苯环上的电子云密度下降,导致催化氧化降解对硝基苯胺的难度增大。

图2 时间对模拟废水中芳胺去除率的影响
2.3 温度对含芳胺废水去除率的影响
反应温度对废水中芳胺去除率的影响如图3所示。
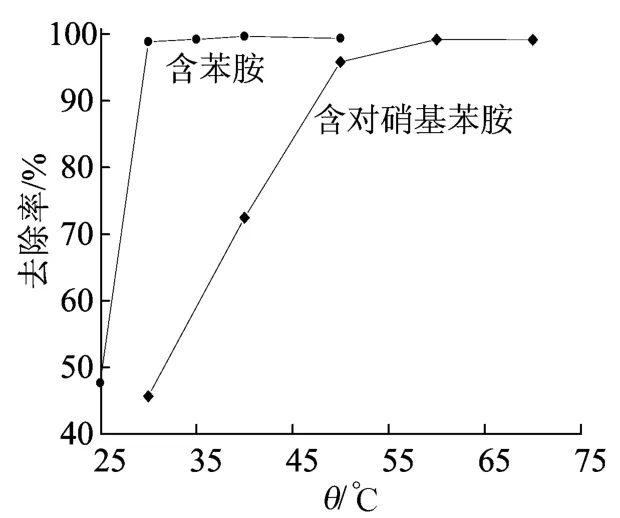
图3 温度对模拟废水中芳胺去除率的影响
由图3可以看出,随着温度从25℃升高到30℃,模拟废水中苯胺去除率迅速上升,当温度上升至40℃时达到最大并保持稳定,超过40℃后,去除率改变不大。这可能是由于适当升高反应温度会加快分子间反应速率,促进◦OH的生成,而反应温度过高,会导致H2O2的热分解速度加快,使H2O2发生了无效分解,使得模拟废水中的苯胺化合物不能被充分地氧化降解[13]。
由图3还可看出,温度由30℃上升至50℃时,模拟废水中对硝基苯胺去除率逐渐上升,当温度达到60℃时,去除率达到最大且不再有明显上升趋势。对硝基苯胺受硝基吸电子基团的影响,需要的反应温度较高。而温度升高,◦OH的活性也升高,对硝基苯胺的降解率也随着提高,而温度过高会使模拟废水中一部分H2O2挥发转变为O2和H2O,从而不利于生成◦OH,也不利于对硝基苯胺的降解。
2.4 pH值对含芳胺模拟废水去除率的影响
pH值对模拟废水中芳胺去除率的影响如图4所示。

图4 pH值对模拟废水中芳胺去除率的影响
由图4可以看出,模拟废水pH值为1~3.5时,随着pH值增大,苯胺去除率也随之上升,pH值在3.5时去除率达到最大,pH值为3.5~6时模拟废水中苯胺的去除率逐渐下降。其原因可能是Fenton试剂或类Fenton试剂是在适当的pH值下发生作用的,当pH值较高时,不仅抑制了◦OH的产生,而且使催化剂表面形成的Fe2+和Fe3+与◦OH结合形成Fe(OH)2和Fe(OH)3沉淀,从而使催化剂失去催化活性;pH值较低时,苯胺以胺盐的形式存在[14],在水中的溶解度较大,不利于芳胺分子在催化剂上的吸附和迁移,从而使催化剂的利用率降低,只有当pH值较适合时,有利于催化剂表面Fe2+和Fe3+之间的转化和◦OH的产生,从而使该类Fenton反应顺利进行[15]。当pH值在3.6时,模拟废水中对硝基苯胺的去除率达到最大,pH值较低或较高时模拟废水的去除率呈下降趋势。这是因为pH值较高时,催化剂表面产生Fe2+易形成水合络合物从而导致对H2O2的有效分解反应过程中催化能力大大下降,且过高的pH值还可能使◦OH转化为O-,从而失去◦OH的强氧化能力[16-17],pH值过低时,则会破坏催化剂表面Fe2+与Fe3+之间的转换平衡,影响催化反应的进行。
2.5 H2O2对含芳胺模拟废水去除率的影响
H2O2用量对模拟废水中芳胺去除率的影响如图5所示。图 5表明,当每 100 mL废水中H2O2用量为0.2~0.6 mL时,随着用量的增加,模拟废水中苯胺去除率不断上升,每100 mL废水中H2O2的用量为0.6~1.0 mL时,苯胺去除率上升较缓慢,当H2O2用量为在1.0~1.2 mL时苯胺去除率有所下降。
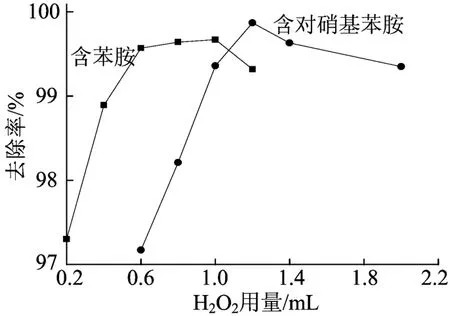
图5 H2O2用量对模拟废水中芳胺去除率的影响
其原因可能是随着H2O2用量的增加,产生的◦OH的量增加,模拟废水中苯胺去除率增大;当H2O2用量过大时,不但不能通过分解产生更多◦OH,反而增加了副反应机会,副反应方程式为:

该副反应使得H2O2发生无效分解,从而使溶液中◦OH减少[18],同时使催化剂表面产生的Fe2+迅速被氧化为Fe3+,这样既消耗了H2O2又抑制了◦OH的生成,而导致氧化效率的降低[19-20]。
每100 mL废水中H2O2用量为0.6~1.2 mL时,随着用量的增加,模拟废水中对硝基苯胺的去除率不断上升,而当每100 mL废水中H2O2的用量为1.2~2.0 mL时,去除率缓慢下降。当H2O2用量过高时,会使催化剂表面产生的Fe2+迅速被氧化为Fe3+,从而既消耗了H2O2,又抑制了◦OH的生成。过量的H2O2不但不能产生更多的◦OH,反而是◦OH的清除剂。
2.6 Fe3O4对含芳胺模拟废水去除率的影响
Fe3O4用量对模拟废水中芳胺去除率的影响如图6所示。
从图6可知,当每100 mL废水中Fe3O4用量从3 mg上升至9 mg时,模拟废水中苯胺去除率不断上升,当每100 mL废水中Fe3O4的用量为9~15 mg时,苯胺去除率开始缓慢下降。这是由于H2O2分解产生的◦OH量随着催化剂Fe3O4用量的增加而加快,使得氧化降解反应逐渐充分进行反应,所以模拟废水的去除率也较高;当Fe3O4用量超过一定量后,催化剂表面产生过量的Fe2+使H2O2分解速度过快,在短时间内使◦OH含量达到很高,部分◦OH来不及与芳胺化合物反应便发生自由基相互间的反应,降低了◦OH的有效利用率,因而使模拟废水去除率降低。同时过量的Fe3O4增加了氧化剂H2O2消耗量,使得用于产生◦OH的H2O2减少[21-22]。
从图6可以看出,当每100 mL废水中Fe3O4用量为5~11 mg时,模拟废水中对硝基苯胺去除率随着用量增加而不断上升,Fe3O4的用量为11~15 mg时,对硝基苯胺去除率反而降低。此结果说明随着Fe3O4用量的增加,加快了H2O2的分解,水中◦OH的含量增高,对硝基苯胺氧化降解速度加快,去除率增大。但催化剂表面产生的Fe2+用量过多,在反应开始的很短时间内即产生大量的◦OH,而部分◦OH来不及与对硝基苯胺反应,彼此之间结合生成水,同时催化剂表面产生的Fe2+被◦OH氧化成Fe3+,从而降低反应效率[23]。

图6 Fe3O4用量对模拟废水中芳胺去除率的影响
2.7 对比试验
取100 mL含苯胺的模拟废水,在优化条件的基础上使用H2O2(15%)而不使用催化剂时,苯胺的降解结果如图7所示。

图7 H2O2对模拟废水中苯胺去除率的影响
2.8 催化剂的循环使用试验
在优化条件下处理苯胺模拟废水试验后,过滤处理后的催化剂洗涤、烘干。催化剂损失率约为15%,按催化剂的损失量成比例地减少苯胺废水处理量和H2O2的添加量。催化剂循环使用催化效果见表1所列。

表1 催化剂循环过程中苯胺降解结果
从表1可以看出,随着催化剂使用次数的增加,废水中苯胺的去除率基本稳定无变化,因此催化剂的催化效果不随使用次数的变化而变化。由此可以说明,纳米Fe3O4催化剂在实验进行过程中一直保持着良好的催化效果。
2.9 最优化工艺条件下COD测定
处理苯胺废水初选优化条件为:反应时间为60 min,温度为40℃,pH值为3.5,H2O2(15%)的用量为1 mL,催化剂Fe3O4用量11 mg,在此条件下处理后的废水去除率为99%,通过COD消解装置检测后,苯胺废水 COD去除率为79.5%;处理对硝基苯胺废水初选优化条件为:反应时间为4 h,温度为60℃,pH值为 3.6,H2O2(15%)的用量为1.2 mL,催化剂Fe3O4用量9 mg,在此条件下处理后的废水去除率为99%,通过COD消解装置检测后,对硝基苯胺废水的COD去除率为75.7%。
3 结束语
本文针对传统的Fenton法处理废水中均相催化剂难与反应介质分离、易流失和引起二次污染的不足,制备了具有较高活性的纳米Fe3O4催化剂,并对其在类Fenton法催化氧化含芳胺模拟废水方面的应用进行了研究。结果表明,采用本方法后模拟废水中芳胺的去除率可达到99%。废水中芳胺的去除降低了废水的生物毒性,提高了废水的可生化性,为后续的生化处理提供了必要条件。
[1]马 毅,姜 燕,吴桂峰.苯胺废水处理研究[J].上海化工,2007,32(8):20-22.
[2]朱兆连,李爱民,陈金龙,等.芳香胺废水治理技术研究进展[J].工业安全与环保2008,34(1):4-5.
[3]GB 8978-1996,污水综合排放标准[S].
[4]沈晓莉,吴利霞.对硝基苯胺废水处理技术研究进展[J].化工生产与技术,2008,15(6):49-51.
[5]范明霞,皮科武,龙 毅,等.吸附法处理焦化废水的研究进展[J].环境科学与技术,2009,32(4):103-106.
[6]张 旋,王启山.高级氧化技术在废水处理中的应用[J].水处理技术,2009,35(3):18-22.
[7]Feng J Y,Hu X J,Yue P L.Discoloration and mineralization of orangeⅡby using a bentonite clay-based Fe nanocomposite film as a heterogeneous photo-Fenton catalyst[J].Water Research,2005,39(1):89-96.
[8]王其仓,刘有智,白 雪,等.Fenton试剂法处理有机废水的技术进展[J].化工中间体,2009(12):25-29.
[9]彭书传,崔康平,周元祥,等.H2O2-Fe2+氧化法处理棉浆泊黑液[J].合肥工业大学学报:自然科学版,2001,24(3):426-429.
[10]Bossmann S H,Oliveros E.New evidence against hydroxyl radicals as reactive intermediate in the thermal and photochemically enhanced Fenton intermediate in reaction[J].Phy s Chem A,1998,102(28):5542-5550.
[11]Chen J X,Zhu L Z.Catalytic degradation of orangeⅡby UV-Fenton with hydroxyl-Fe-pillared bentonite in water[J].Chemosphere,2006,65(7):1249-1255.
[12]杨晓芬,赵美萍,李元宗,等.水中苯胺类化合物的分光光度法测定[J].分析化学,2002,30(5):540-543.
[13]柴多里,刘忠煌,杨保俊.类Fenton试剂处理焦化废水[J].化工进展,2009(Z2):103-106.
[14]严文瑶,陈银合,赵志恒.非均相催化氧化降解水中苯胺的实验研究[J].江苏工业学院学报,2008,20(1):48-50.
[15]王春敏,吴少艳,王维军.Fenton试剂处理苯酚废水的研究[J].当代化工,2006,35(1):26-28.
[16]苏荣军.芬顿试剂氧化污水及无机离子影响的研究[J].哈尔滨商业大学学报:自然科学版,2008,24(2):210-217.
[17]曲晓萍,吴晓辉,陆晓华,等.活性炭-微波辐射深度处理焦化废水[J].华中科技大学学报:城市科学版,2005,22(4):79-81.
[18]Chlicker O S,Ebert M,Fruth M,et al.Degradation of TCE with iron:the role of competing chromate and nitrate reduction[J].Ground Water,2000,38(3):403-409.
[19]谢春娟,朱 琅,李 剑.Fenton试剂氧化苯胺的影响因素及机理研究[J].净水技术,2007,2(2):13-16.
[20]田依林,李明玉,马同森,等.Fenton试剂氧化水中芳香族化合物的机理[J].污染防治技术,2003,16(1):12-15.
[21]Liu Mingchun,Huang Yaohui.Kinetics of 2,6-dimethy laniline deg radation by electro-Fenton process[J].Journal of Hazardous Materials,2009,161(2):1484-1490.
[22]王炳坤,北尾高岭,木曾祥秋.采用Fenton试剂处理废水中难降解的苯胺类化合物[J].环境化学,1987,6(5):80-84.
[23]黄卫红,阮介兵,陈义群.微波辅助芬顿试剂降解联苯胺废水的研究[J].环境科学与技术,2009,32(8):130-133.
