水稻Y58S核心种子不同世代群体的育性变化
2011-08-28周飞捷刘爱民肖层林刘玉龙邓晓娟
周飞捷,刘爱民,肖层林*,刘玉龙,邓晓娟
(1湖南农业大学农学院,长沙,410128;2 湖南隆平种业有限公司,长沙,410125)
两系法杂交水稻育成的关键在于水稻光温敏核不育材料的发现和光温敏核不育系的育成[1~4]。由于温敏核不育系的育性受温度变化的影响会发生波动,使得制种和繁殖都存在一定的风险[5~7],为了保证光温敏核不育系在制种和繁殖中的安全性,在选育光温敏核不育系时,对不育起点温度的选择由原来的 24.0℃降为 23.5℃以下[8]。光温敏核不育系普遍存在育性转换起点温度随着世代的增加发生遗传漂移现象,为此,袁隆平提出了光温敏核不育系核心种子生产程序和方法[9~11],对光温敏核不育系保纯繁殖提供了技术支撑,同时为两系杂交水稻制种纯度提供了保障。
Y58S是湖南杂交水稻研究中心选育的籼型光温敏核不育系,经湖南省多点生态试验及冷水处理池处理和人工气候室鉴定,育性转换起点温度为22.5~23.0℃,在一定温度范围内有微弱的光敏互补作用。Y58S具有育性转换起点温度低、配合力强、抗逆性好、综合性状优良等特点,2005年通过湖南省品种审定委员会审定[12]。由于近年来在利用Y58S制种的群体中出现了农艺性状、育性转换起点温度均有变化的个体,加大了田间除杂的难度,为此,笔者以Y58S核心种子繁殖1至3代种子和未经核心种子生产程序而多代繁殖的种子为材料,研究Y58S群体育性的变化规律,旨在为Y58S的防杂保纯和保证所用种源的纯度提供依据。
1 材料与方法
1.1 材 料
Y58S经冷水处理方法生产的核心种子繁殖的第1、2、3代种子和未经核心种子生产程序多代繁殖的种子(对照)。
1.2 方 法
试验于2010年在湖南农业大学科研基地进行。供试种子均于4月16日播种,5月15日移栽,每个材料移栽1 000个单株,株行距17 cm×20 cm,中等肥力水平管理。每个材料定30株(3点,每点10株),每3 d记载1次主茎叶龄,在倒三叶至剑叶伸出期间,剥检幼穗分化进度。
1.2.1 育性波动温度处理
当幼穗分化至第Ⅳ期,每个材料随机取300株移入盆中,每盆4株。幼穗分化至第Ⅴ期初,移入冷水处理池,用恒温23.0℃的冷水处理6 d,灌水深度以淹没植株生长点2 cm为准。冷水处理结束后,标记剑叶与倒二叶叶枕平的穗子。于开花期连续3 d对标记穗进行花粉镜检,保留标记穗,考查自交结实率。
1.2.2 繁殖温度处理
将 1.2.1处理单株上未标记的穗子刈割再生,再生苗幼穗分化至第Ⅳ期末时,移入冷水处理池,用恒温21.5℃冷水处理12 d,灌水深度以淹没植株生长点2 cm为准。冷水处理结束后,标记剑叶与倒二叶叶枕平的穗子。于开花期连续3 d对标记穗进行花粉镜检,再考查自交结实率。
1.2.3 田间单株花粉镜检
在田间的700个单株中,于开花期随机选择300株,连续3 d进行花粉镜检。
2 结果与分析
2.1 各世代群体不育期的花粉镜检结果
据调查,2010年7月1–11日,田间日平均温度 25.7~32.0℃,平均温度为29.4℃(表1),说明此时段温度已高于供试材料育性转换起点温度。于开花期对 Y58S各世代的种子种植的群体进行花粉镜检,结果表明:由核心种子繁殖的第1、2、3代种子和对照种子种植的群体,无花粉株率分别为55.33%,52.33%,48.33%,43.67%,第1、2代差异不显著,与第3代差异显著,与对照的差异极显著。

表1 2010年7月1~11日田间温度(℃)
各世代及对照种子种植的群体,典败花粉株率均在41.33%~45.00%,差异不显著。由第1、2代种子种植的群体,圆败花粉株率显著低于第3代和对照种子种植的群体,第1代与第2代差异不显著,第3代与对照种子种植的群体差异不显著。第1代种子种植的群体中,染败和正常花粉株率均为 0。第 2、3代种子种植的群体中,染败花粉株率分别为1.00%,2.33%,差异不显著,但与对照种子种植的群体的染败花粉株率(4.00%)差异显著。由核心种子繁殖的第 1、2代种子种植的群体中,正常花粉株率均为0,第3代种子种植的群体中正常花粉株率1.00%。由此可见,以冷水处理方法生产的核心种子连续繁殖2代用于制种,其不育的安全性高;第3代种子用于制种有一定风险;未经核心种子生产程序多代繁殖的种子(对照),育性敏感期在日平均温度25.7~32.0 ℃,平均温度为29.4 ℃天气条件下,有2.67%的单株产生正常花粉(表2),不能用于制种。
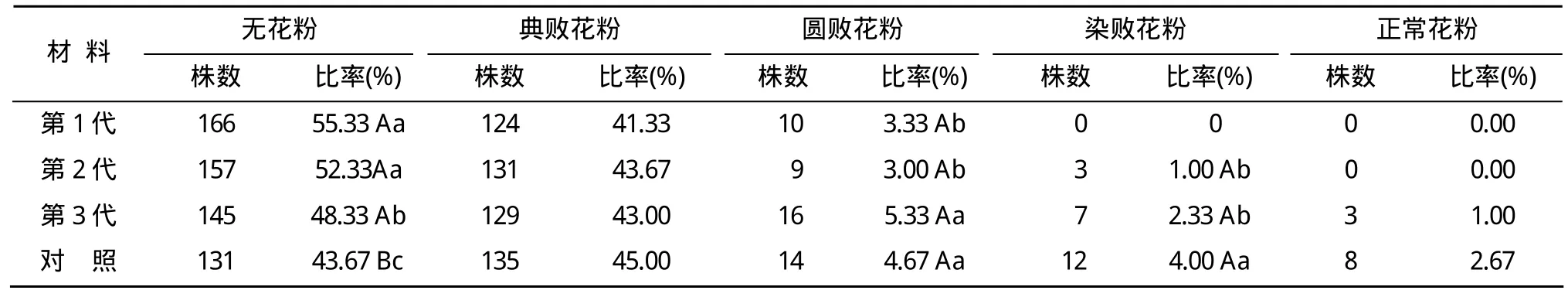
表2 Y58S不同世代群体在不育期的花粉镜检结果
在花粉镜检中,发现未经核心种子生产程序多代繁殖的种子种植的300个单株中,有1株的可育花粉率达96%,在田间表现株高、株叶形态、穗粒形状、颜色等性状均与其他完全不育单株一致,只是在抽穗时存在程度较轻的卡颈现象,笔者认为这种植株为Y58S的“同形可育株”。
2.2 各世代群体育性波动期的花粉镜检结果
在育性敏感期,连续6 d对供试材料采用平均温度23.0℃的冷水处理,抽穗开花期对各世代种子种植的群体花粉进行镜检,结果列于表3。处理后,各世代种子种植的群体主要表现为无花粉株率大幅度降低,且表现随种子繁殖世代增加,无花粉株率极显著降低。第1、2、3代及对照种子种植的群体,典败花粉株率分别为62.67%,60.33%,58.33%,57.00%,群体间差异不显著。圆败花粉株率也随种子繁殖世代增加而极显著提高。各世代种子及对照种子种植的群体内均产生了染败花粉单株,世代间差异达显著或极显著水平。由核心种子繁殖的第1、2代种子种植的群体中产生正常花粉株率分别为0、0.67%,第 3代及对照种子种植的群体中产生正常染色花粉的株率分别为1.33%,3.0%。由此证明,Y58S育性敏感期以23.0℃冷水处理6 d,育性波动较小,一方面说明,用Y58S制种,在其育性敏感期,即使出现连续6 d温度23.0℃的天气状况,由核心种子繁殖的第 1、2代种子也不会发生不育性波动而导致制种的失败。但另一方面也提示,随着核心种子繁殖世代的增加,群体育性波动程度将逐渐增加。
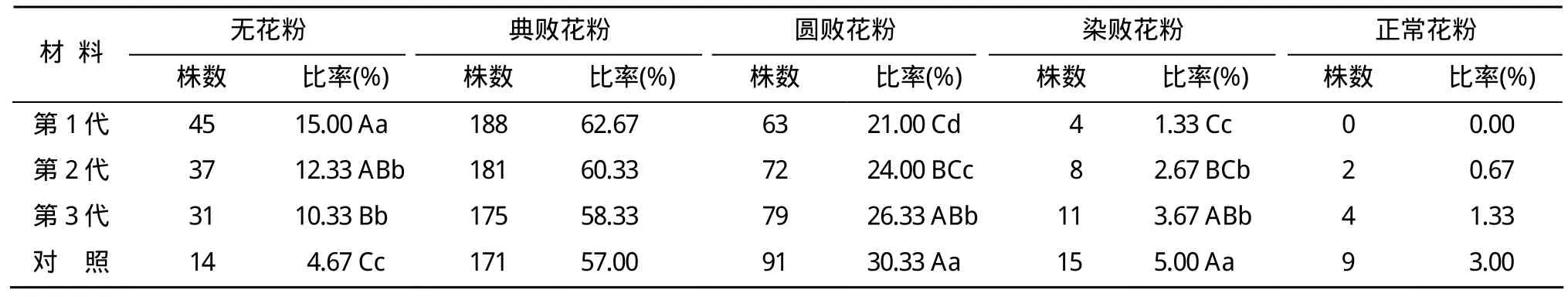
表3 Y58S不同世代群体在育性波动期的花粉镜检结果
2.3 各世代群体繁殖期花粉镜检结果及结实率
对用23.0 ℃冷水处理6 d的植株,在再生苗育性敏感期以21.5 ℃恒温冷水连续处理12 d,使其可育。在抽穗开花期对各世代种子种植群体的再生苗穗进行花粉镜检,并考查自交结实率,花粉镜检结果列于表4。育性敏感期在经过连续12 d恒温21.5℃冷水处理后,Y58S各世代种子的群体均转向了可育。第1代种子的群体内正常花粉率为50%~60%的株率为31.00%,第2、3代及对照种子群体内正常花粉率为 60%~70%的株率分别为 30.67%,31.00%,34.00%。第1、2、3代及对照种子的群体内正常花粉率为 80%以上的株率分别 3.00%,5.33%,8.33%,11.33%,表现为随核心种子繁殖世代增加而极显著提高。第1、2、3代及对照种子群体内正常花粉率在 30%以下的株率分别为 6.0%,5.0%,4.0%,3.0%,表现为随核心种子繁殖世代增加而极显著降低。由此看出,Y58S各世代种子种植的群体,经繁殖温度(21.5℃)处理12 d后,染色花粉率80%以上和30%以下的株率均较低。不同世代种子种植的群体,镜检表现正常花粉率从低至高的株率分布均类似正态分布,且正态分布曲线的形状基本一致,只是各曲线的峰值稍有不同,似是1条正态分布曲线沿横轴平移的结果。说明Y58S不育的本质在于主效基因,而其育性转换起点温度的漂变则是微效基因作用的结果。在Y58S的连续多代自交过程中,主效基因没有变化,而微效基因得以不断累积与重组,导致Y58S的育性转换起点温度逐代漂高,由核心种子繁殖的不同世代种子种植的群体,株间表现明显差异。因此,在温敏核不育系繁殖时去除群体中染色花粉率高和低的极端单株,保留染色花粉率相对一致的单株,有利于保持温敏核不育系育性转换起点温度的相对一致性。
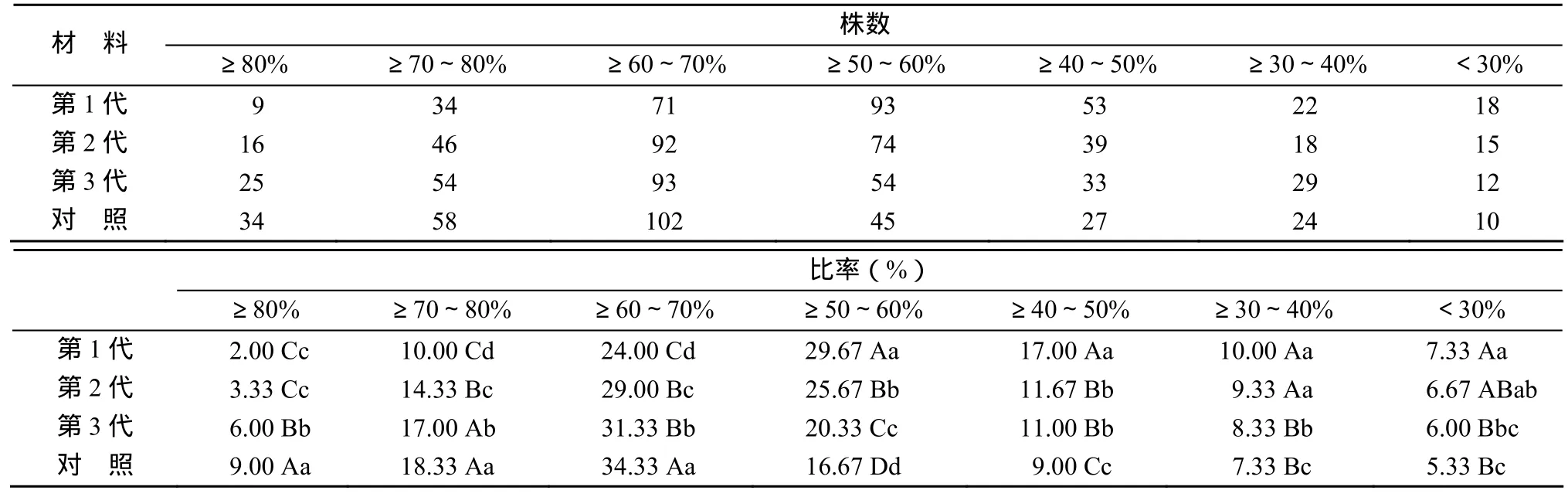
表4 Y58S不同世代群体在可育期不同染色花粉率下的株数及比率
对Y58S各世代种子的群体以繁殖温度处理12 d后的自交结实率表明,从第1代至第3代和对照种子种植的群体,自交结实率在80%以上的株率分别2.00%,3.33%,6.00%,9.00%,第1、2代之间差异不显著,与第3代及对照之间的差异极显著,自交结实率 60%~80%的株率分别为 34.00%,43.33%,48.33%,52.67%,差异显著,表现为随种子繁殖世代增加而提高;自交结实率在30%以下的株率分别7.33%,6.67%,6.00%,5.33%,第1、2代均与对照差异极显著,自交结实率50%~60%的株率分别为 29.67%,25.67%,20.33%,16.67%,其差异极显著,表现为随种子繁殖世代增加而降低(表5)。第1代至第3代和对照种子种植的群体可育期的平均结实率分别为55.43%,59.01%,62.07%,64.01%,群体平均结实率也随着种子繁殖世代的增加逐步提高(表6)。

表5 Y58S不同世代群体在可育期的结实率
从本试验结果可以看出,由核心种子繁殖的第1、2代种子种植的群体,育性敏感期用繁殖温度(21.5℃)的冷水处理后,自交结实率接近的单株数量较大,第3代和未经核心种子生产程序繁殖的种子种植的群体,用繁殖温度冷水处理后,群体内单株间自交结实率的差异较大,自交结实率高的单株数量增多,显示群体育性转换起点温度有所提高。因此,在温敏核不育系繁殖时去除群体中自交结实率高和低的极端类型单株,保留自交结实率相对接近的单株,有利于保持温敏核不育系育性转换起点温度的相对一致性。
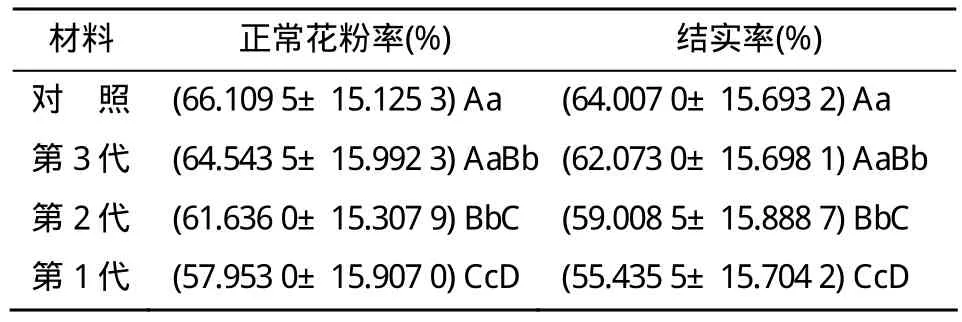
表6 Y58S不同世代群体的正常花粉率和结实率
3 讨 论
a.关于光温敏核不育系不育性的遗传机制,廖伏明于1996年提出了光温敏不育系育性遗传由两种不同类型基因控制的假说,即育性转换特性是受 1对或2对隐性主基因控制的质量性状,而导致不育的起点温度则是受微效多基因控制的数量性状,从而提出导致光温敏不育系不育的起点温度是受微效多基因控制的数量性状的观点。认为不育起点温度受微效多基因控制是光温敏不育系不育性表达不稳定的遗传机制,而导致不育性表达不稳定的内在原因,是不育系在起点温度上的遗传基础不纯,即控制起点温度的多基因仍有少数基因处于杂合状态[13]。微效基因的突变和重组可能是造成临界温度的改变和“遗传漂变”的主要原因。本研究结果表明,未经核心种子生产程序连续多代繁殖的Y58S种子,育性敏感期无论是处于育性转换起点温度之上制种需要的高温条件,还是处于育性波动温度条件,或是处于低于育性转换起点温度以下繁殖需要低温条件,群体内单株间花粉类型或自交结实率均表现出较明显差异,群体内出现从无花粉型至正常染色花粉率较高的单株,甚至出现株高、株叶形态、穗粒形状、颜色等性状均与其它完全不育单株一致,而正常染色花粉率96%以上,抽穗不卡颈的“同形可育株”。经核心种子生产程序生产的核心种子,随着繁殖世代的增加,其群体内单株间育性表现逐代发生变化。Y58S未经核心种子生产提纯程序而多代繁殖的群体中出现的同形可育株,可能是控制育性性状的主效基因发生了改变,或者主效基因的功能因某些原因受到了抑制,导致其高温不育性状的消失。
b.笔者认为,利用Y58S制种,除了考虑温度因素外,还应考虑Y58S对光长的要求,综合选择合适的光周期地区作为制种基地,才能保证制种的安全。本研究结果表明,在育性敏感期日均温为25.7~32.0℃条件下,Y58S由核心种子繁殖的第1、2代种子种植的群体中正常花粉株率均为0,第3代种子种植的群体中正常花粉株率1.00%,未经核心种子生产程序多代繁殖的种子种植的群体中正常花粉株率2.67%,且出现同形可育株。育性敏感期以23.0℃恒温冷水处理6 d,由第1、2代种子种植的群体中产生正常花粉的株率分别为0,0.67%,第3代及未经核心种子生产程序的种子种植的群体中产生正常染色花粉的株率分别为1.33%,3.0%。由此可见,Y58S由核心种子繁殖的第1、2代种子用于制种,其不育的安全性高,第3代种子用于制种有风险。对Y58S必须经核心种子生产和繁殖程序进行提纯繁殖[9~11],未经核心种子生产程序多代繁殖的种子不能用于制种。使用Y58S核心种子繁殖的第2代制种,必须保证第2代种子数量。采用人工气候室处理方法生产核心种子,往往因气候室条件限制,获得核心单株数量偏少,核心种子数量少,繁殖2代难以满足制种对Y58S种子的需求。刘爱民、肖层林等近年来发明了利用冷水处理生产核心种子的程序与方法,获得核心单株数量多,生产的核心种子数量大,再经2代繁殖,能够满足制种对Y58S种子量的需求[14]。
[1]廖伏明,杨益善,袁隆平.水稻高世代光温敏不育系低温下育性选择效果研究[J].杂交水稻,2003,18(4):51-54.
[2]石明松.晚粳自然两用系的选育及应用初报[J].湖北农业科学,1981,(7):1-3.
[3]卢兴桂.我国水稻光温敏雄性不育系选育的回顾[J].杂交水稻,1994,(3-4):27-30.
[4]罗孝和,邱趾忠,李任华.导致不育临界温度低的两用不育系培矮64S[J].杂交水稻,1992,(1):27-29.
[5]卢兴桂,袁潜华,姚克敏,等.我国主要水稻光温敏核不育系类型的气候适应性[J].中国水稻科学,2001,15(2):81-87.
[6]廖伏明,袁隆平.光温敏核不育水稻不育性表达不稳定的遗传机制与原因综述[J].杂交水稻,2003,18(2):1-6.
[7]何 强,蔡义东,徐耀武,等.水稻光温敏核不育系利用中存在的问题与对策[J].杂交水稻,2004,19(1):1-5.
[8]肖层林,涂娥英,刘 逊.我国水稻两用核不育系研究进展[J].种子,1995,(2):37-39.
[9]袁隆平.水稻光、温敏不育系的提纯和核心种子繁殖生产[J].杂交水稻,1994,(6):1-3.
[10]邓启云,符习勤.光温敏核不育水稻育性稳定性研究Ⅲ.不育起点温度漂移及其控制技术[J].湖南农业大学学报:自然科学版,1998,(1):8-13.
[11]邓启云,袁隆平.光温敏核不育水稻育性稳定性及其鉴定技术(英文)[J].中国水稻科学,1998,12(4):200-206.
[12]邓启云.广适性水稻光温敏核不育系 Y58S的选育[J].杂交水稻,2005,20(2):15-18.
[13]廖伏明,袁隆平.水稻光温敏核不育系起点温度遗传纯化的策略探讨[J].杂交水稻,1996,(6):1-4.
[14]刘爱民,肖层林.“三层穗法”生产水稻温敏不育系核心种子的方法[P].中国:CN101524047,2010.
