树突形态在慢性脑缺血大鼠内侧前额叶的变化
2011-08-25张小敏张博爱刘荣丽姬亚杰
张小敏, 张博爱, 贾 贺, 刘 宇, 刘荣丽, 姬亚杰, 李 星
慢性脑缺血是一种常见的病理状态。慢性脑缺血或脑灌注不足伴发于脑动脉硬化、血管性痴呆、Alzheimer病、Binswanger病和动静脉畸形等多种脑血管疾病的病理过程中,发病早期以认知功能损害为主要表现,最终可能导致持久或进展性认知与神经功能障碍[1]。双侧颈总动脉永久结扎(2VO)大鼠慢性期的神经病理改变与人类老龄化和AD时慢性脑低灌注很相似,被广泛用来研究慢性脑缺血注对认知功能损害和神经变性疾病的影响[2]。海马和前额皮质区(PFC)均与学习记忆密切相关,在慢性脑缺血所致认知障碍中,有关海马的病理改变研究很多,但关于PFC的相关报道却少见。本实验利用高尔基染色对2VO大鼠模型前额皮质区(mPFC)锥体细胞树突长度、分枝及树突棘密度等形态分析,从而探讨慢性脑缺血与锥体细胞形态变化的相关性。
1 材料与方法
1.1 动物分组及模型建立
采用7月龄SD大鼠(不分雌雄)40只为实验对象,所有实验动物均由郑州大学动物实验提供。将40只大鼠采用随机数字法分为手术组和假手术组,每组20只。手术组采用永久性双侧颈总动脉结扎(2VO)法[3]制备脑供血不足模型,假手术组除不结扎双侧颈总动脉外,余处理同模型组大鼠。标准啮齿动物饲料喂养,大鼠生活环境为20℃ ±2℃,湿度为60±10℃,通风良好,照明随同自然变化。(手术组存活15只,假手术组存活18只)。
1.2 取材与制片
分别于大鼠饲养2w、4w及8w,各组抽取5只SD大鼠。将其麻醉后,采用灌注的快速Golgi法[4]处理,方法如下:10%水合氯醛(0.35ml/100g)腹腔注射麻醉,待翻正反射消失后,仰卧位,固定四肢,剖开腹腔,暴露肝脏。之后,迅速剪开横膈膜、打开胸腔,暴露心脏。用37℃ 0.5%亚硝酸钠的生理盐水进行灌注,待流出的液体无血色,遂将灌注液换成10%福尔马林生理盐水溶液继续灌注。灌注固定液充分后,略候1~2h。又用媒染液(由水合氯醛、重铬酸钾、浓甲醛及蒸馏水配制成)灌注,至流出液显浓厚桔红色,再略等1~2h。开颅取脑组织。组织块厚约5~10mm,仍用媒染液浸泡,置暗处避光于室温3d。用1%硝酸银水溶液浸泡镀银,置暗处3d。每日换新银液1次,瓶底加棉纱垫并及时摇动,使镀银充分。OCT包埋,用振动切片机做150μm切片。切片又浸于2%重铬酸钾水溶液漂洗。梯度酒精脱水,二甲苯透明,中性树胶封片。
1.3 树突长度及树突棘计数分析
每只大鼠取20个mPFC第Ⅲ层锥体细胞,采用显微镜进行采集图片(见图1)。因为mPFC锥体细胞基树突与冠状位相平行,因此可对基树突进行分析[5]。用 ImageJ 6.0 软件中 Sholl analyze(Sholl 1953)进行树突总长度及分枝分析,同心圆与树突交点的总数反映树突总长度及整体分枝情况[5](见图2)。在油镜(1000×)下观察基树突上树突棘的密度(见图1右上角所示)。由于在树突上树突棘的分布并不是均一的,因此树突棘的计数要取同一位置为起点:从距离胞体30~60μm开始直至树突终末端[6]。
可用于图像分析的锥体细胞入选标准:(1)锥体细胞位于mPFC内;(2)锥体细胞需被充分染色以便于准确观察分析;(3)锥体细胞没有被其他物体所掩盖,如胶质细胞、脉管系统及其他锥体细胞等;(4)锥体细胞基本完整,少有中断或离断现象。
1.4 统计处理
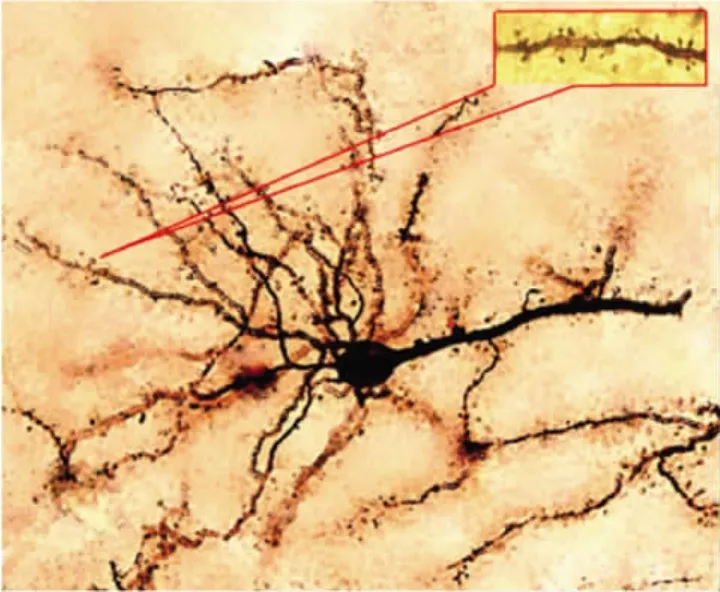
图1 大鼠mPFC第3层锥体细胞
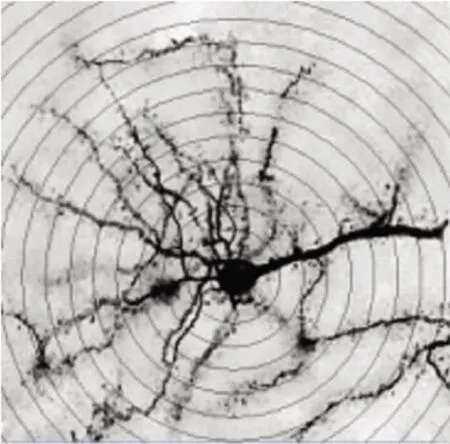
图2 Sholl Analyze同心圆
2 结果
本次实验基于对600个mPFC锥体细胞进行分析,经镜下观察及数据分析,所得结果如下。
2.1 锥体细胞树突长度
同一时间段假手术组及手术组大鼠mPFC锥体细胞树突与同心圆交点数无明显差异,各时间段假手术组与手术组间锥体细胞与同心圆交点数亦无明显差异(P >0.1)(见表1)。
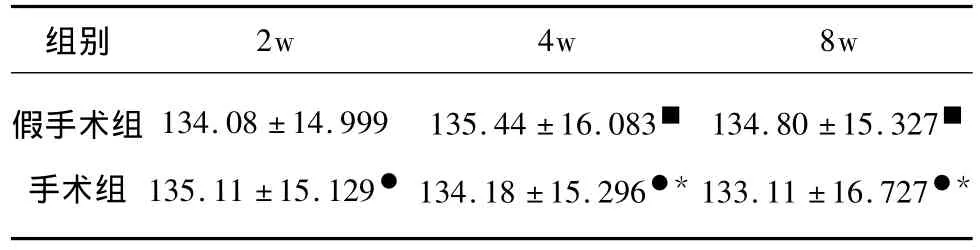
表1 各组mPFC锥体细胞树突与同心圆交点
2.2 锥体细胞树突棘密度
术后2w模型组及假手术组mPFC树突棘密度无明显差异。术后8w两组间树突棘有明显差异(P<0.05)。随着周龄增大手术组及假手术组树突棘均有逐渐降低的趋势,其中手术组树突棘密度降低(术后2w及8w)有明显差异(P<0.05)(见表2、图3)。

表2 各组mPFC锥体细胞树突棘密度/20μm

图3 手术组及假手术组各周树突棘密度
3 讨论
树突棘是锥体细胞树突上内含肌动蛋白的小突起,构成大部分兴奋性突触的突触后膜,是主要的信息加工及储存的场所。突触的可塑性在学习、记忆等过程中起到很重要的作用,树突棘作为兴奋性突触的后膜,其密度及形态的变化与学习记忆密切相关。一个成熟的皮质锥体细胞可以接收约15000个突触所传递的信息,树突棘的数目可以反映出锥体细胞间的信息联系及传递程度。因此,可以通过对锥体细胞的树突长度、分枝及树突棘的密度的测量来推断细胞间的联系[5,7]。
关于急性脑缺血后树突棘变化的研究很多,但慢性脑缺血所致锥体细胞树突形态变化少有报道。Zhang等人发现较为温和的血流下降(~50%血流),5h内不会引起树突棘的变化,但若血流严重下降(<10%血流),在10min内树突棘数量会急剧下降,且形态结构会随之发生改变,Li等也发现在急性脑缺血时树突形态发生改变,两者均观察到若60min内血流恢复,树突及树突棘形态均有所恢复[8,9]。说明树突棘形态结构会随短时间急剧下降的血流而随之改变。
在慢性脑缺血的研究中,海马区病变与认知障碍密切相关。Wang等人在电镜下观察发现认知功能障碍伴随着海马CA1区突触密度的降低及突触形态的改变[10],参与细胞骨架形成的磷蛋白-微管相关蛋白2(MAP-2)及标记突触小泡的蛋白-突触素蛋白均进行性减少[11]。这些研究均表明慢性脑低灌注影响海马区树突形成和突触连接。
海马和PFC与学习和记忆等脑高级认知功能密切相关[12]。解剖学研究已经证明,海马和PFC之间存在单突触联系,即海马前额叶回路。人们推测该回路可能对海马和PFC这两个重要的脑区的信息起协调和沟通作用,并极可能参与记忆等认知功能。精神分裂症(schizophrenia)、帕金森病(Parkinson’s disease,PD)、阿尔茨海默病(Alzheimer’s disease,AD)等神经、精神疾病患者都表现出工作记忆障碍和前额叶功能异常,并发现其与神经递质系统失调密切相关[13]。
本实验利用高尔基染色法研究慢性脑缺血状态下大鼠mPFC树突形态的变化,是对锥体细胞形态进行直观的观察和分析。从而通过观察慢性脑缺血情况下大鼠mPFC锥体细胞的形态变化,研究mPFC树突及突触的连接情况。
实验中对600个mPFC锥体细胞的树突长度、分枝及树突棘的密度进行测量。实验数据表明,模型组大鼠mPFC树突长度及分枝与假手术组在各时间段均无明显区别,但自术后4w及8w树突棘密度较假手术组明显降低。由此看来,树突棘密度这一指标对慢性脑缺血更为敏感。在实验中,术后2w假手术组及模型组间树突棘密度并无明显差异,术后4、8w树突棘密度逐渐减少,且均有显著性差异,说明短时间的慢性脑缺血状态对树突棘数目并无明显影响,随着时间延长,慢性脑缺血所造成的影响逐渐显现,且逐渐加重。慢性脑缺血可能导致mPFC的突触随之减少,影响海马-前额叶回路中信息的传递,进而影响工作记忆等功能。这一结果与大量实验所示:2VO术后大鼠学习能力下降且进行性加重相一致。
关于树突棘缺失的原因尚不清楚。可能与慢性脑缺血状态下兴奋性氨基酸升高、脑细胞损伤、自由基代谢障碍等病理过程相关。多项研究表明Ephephrin系统在脑内多数区域,如海马、皮质、嗅球、小脑等均有表达,其主要功能是参与神经细胞突触发育及神经可塑性调节。本实验室前期研究中可见,在慢性脑缺血模型中,体内及体外试验均检测到E-phA4持续升高[14]。EphA4可能与树突棘的减少相关,EphB2可能与树突棘增多相关。可以通过对E-phA4或EphB2调控,改善树突棘的表达,增加锥体细胞间突触形成,从而改善认知障碍。
总之,慢性脑缺血可以引起认知功能损害,而这可能与PFC锥体细胞树突棘密度降低从而导致有效突触连接减少、影响信息传递有关。调节树突棘形态及数目变化的机制尚不清楚,在今后的研究工作中,我们可以对树突棘调控进行更深一步的研究,通过调节树突棘对认知功能障碍患者进行治疗,可能提高患者认知水平,改善生活质量。
[1] 刘汉兴,章军建.慢性脑缺血与认知功能障碍[J].国外医学脑血管疾病分册,2004,4(12):278 -281.
[2] Farkas E,Luiten PG,Bari F.Permanent,bilateral common carotid artery occlusion in the rat:A model for chronic cerebral hypoperfusionrelated neurodegenerative diseases[J].Brain Res Rev,2007,54:162-180.
[3] Ni JW,Ohta H,Matsumoto K,et al.Progressive cognitive impairment following chronic cerebral hypoperfusion induced by permanent occlusion of bilateral carotid arteries in rats[J].Brain Res,1994,653:231-236.
[4] 杜卓民.实用组织学技术[M].北京,人民卫生出版社,1982.143-144.
[5] Sanchez F,Gomez-Villalobos Mde J,Juarez I,et al.Dendritic morphology of neurons in medial prefrontal cortex,hippocampus,and nucleus accumbens in adult SH rats[J].Synapse,2011,65:198 -206.
[6] Johansson BB,Belichenko PV.Neuronal plasticity and dendritic spines:Effect of environmental enrichment on intact and postischemic rat brain[J].Jcereb blood flow Metab,2002,22:89 -96.
[7] Alcantara-Gonzalez F,Juarez I,Solis O,et al.Enhanced dendritic spine number of neurons of the prefrontal cortex,hippocampus,and nucleus accumbens in old rats after chronic donepezil administration[J].Synapse,2010,64:786 -793.
[8] Zhang SX,Boyd J,Delaney K,et al.Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia[J].J Neurosci,2005,25(22):5333 -5338.
[9] Li P,Murphy TH.Two-photon imaging during prolonged middle cerebral artery occlusion in mice reveals recovery of dendritic structure after reperfusion[J].JNeurosci,2008,28(46):11970 -11979.
[10] Wang XJ,Xing AF,Xu CL,et al.Cerebrovascular hypoperfusion induces spatial memory impairment,synaptic changes,and amyloid-β oligomerization in rats[J].J Alzheimer’s Dis,2010,21:813 -822.
[11] 舒怡摇,张洪摇,章军建.慢性脑低灌注的实验研究进展[J].中华脑血管病杂志(电子版),2010,4(3):99 -206.
[12] 王功伍,蔡景霞.海马-前额叶神经回路与工作记忆[J].动物学研究,2010,31(1):50 -56.
[13] Oscar-Berman M.Clinical and experimental approaches to varieties of memory[J].Int J Neurosci,1991,58(3 -4):135 -150.
[14] 李俊敏,张博爱,贾延劼,等.慢性脑缺血大鼠EphA4表达变化的研究[J].中国现代医学杂志,2008,18(1):2113-2121
