浙江温岭帕金森病线粒体DNA基因突变与多态性研究
2011-08-25周辰珩蔡海波臧秋玲
周辰珩, 金 莹, 洪 庆, 蔡海波, 臧秋玲
帕金森病(PD)是以震颤、强直、运动减少三大症状为临床表现的严重危害中老年人的神经系统变性疾病,其病因及发病机制至今尚未清楚。据报道线粒体功能紊乱与PD发病有关,环境中的有害化学物质可能通过抑制线粒体中电子转移系统中的复合物Ⅰ而影响PD的发病[1]。目前围绕其病因的争论很多,其中线粒体功能与PD的相关性研究是近年来研究的热点,本文针对编码线粒体呼吸链酶复合体Ⅰ基因的3个位点突变进行研究。
1 对象与方法
1.1 研究对象
选取我院神经内科门诊散发性帕金森病患者88例,男性48例,女性40例,年龄44~78岁,平均(60.3±11.2)岁,符合英国帕金森病学会脑库的帕金森病临床诊断标准[2]。选取60例中老年健康体检者,男32例,女28例,无高血压,糖尿病病史,年龄46~76岁,平均(62.0±9.5)岁。两组的年龄、性别差异无显著性。
1.2 仪器和试剂
Bio-RAD My cyclerTM PCR仪(伯乐公司,美国);Bio-Rad Gel Doc 2000D凝胶成像仪(伯乐公司,美国);2720 Thermal Cycler PCR仪(ABI公司,美国);YY-6C型电泳仪(六一仪器厂,北京);5418型离心机(Eppendorf公司,德国);2×PCR mixture(Tiangen公司,瑞士);Maker(Ferments公司,德国);胶回收纯化试剂盒(AXYGEN公司,美国)。
1.3 方法
1.3.1 DNA样品制备 用酚/氯仿抽提法从研究对象外周静脉血白细胞中提取基因组DNA。
1.3.2 PCR引物设计与合成 引物由上海生工合成,引物设计参考文献[3],见表1。
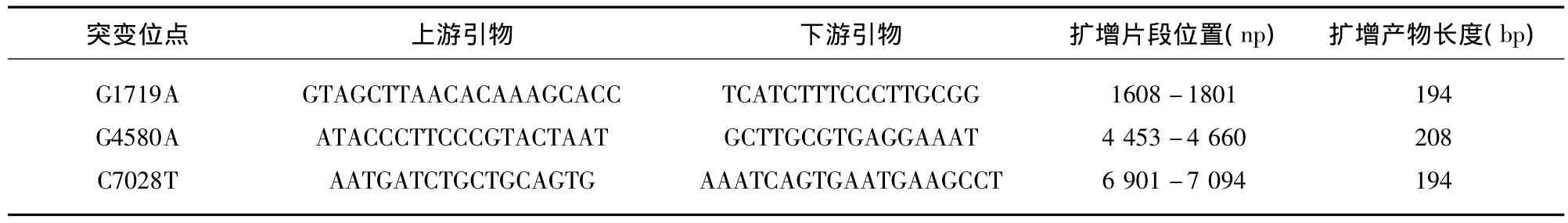
表1 三对线粒体NDA突变位点的PCR引物信息
1.3.3 PCR扩增 以提取的基因组DNA为模板进行PCR扩增。PCR反应体系总量25ml:上下游引物各 1.5ml,基因组 DNA 8ml,PCR mixture4μl,ddH2O10μl。PCR 条件:95℃预变性 5min,94℃变性30s,55℃退火 30s,72℃ 延伸 40s,循环数为 35 个,72℃延伸10min,10℃保存。PCR产物经2%琼脂糖凝胶电泳鉴定,并在自动凝胶成像系统上观察扩增结果。
1.3.4 DNA测序 PCR产物的纯化和测序由上海桑尼生物科技有限公司完成。其步骤如下:AXYGEN回收试剂盒纯化PCR扩增产物并进行定量;以BigDye Terminator V3.1测序试剂盒对纯化PCR产物进行处理,然后在ABI3730XL测序仪上进行正反向测序;拼接序列绘制出测序结果,并定位分析线粒体DNA 3个位点附近的碱基改变。
1.4 统计学方法
采用SPSS11.0软件进行统计处理,统计分析应用χ2检验,P<0.05差异有显著意义。
2 结果
2.1 PCR 扩增
对G1719A、G4580A、C7028T 3个线粒体基因进行PCR扩增,在2%琼脂糖凝胶中可见产物条带都位于200bp。见图1。
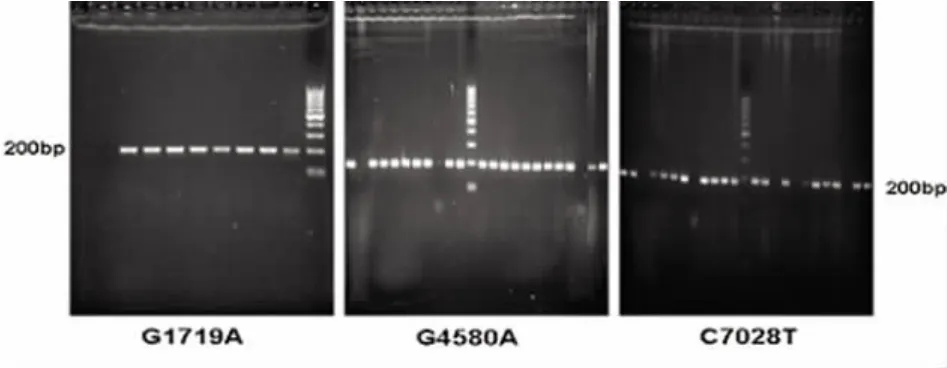
图1 PCR产物琼脂糖凝胶电泳图
2.2 PD基因突变分析
对21例异常基因位点进行DNA测序,未发现这3个基因位点突变,反而在其附近发现多个位点突变,在G1719A附近有4例1711(G→A)1738(A→G),3例 1738(A→G),1例 1664(G→A)突变;在G4580A附近有1例4476(A→G),1例4638(A→G),1例4651(-→T)突变;在 C7028T附近有1例6984(C→T),1例 6979(G→C)6984(C→T),3例7083(C→ -),4例6963(G→A),1例6910(C→A)突变。对照组无发现突变位点。
2.3 突变类型测序
11种突变类型测序结果见图2~图4。G1719A附近基因位点突变测序图谱(见图2):1711(G→A)1738(A→G),1738(A→G),1664(G→A);G4580A附近基因位点突变测序图谱(见图3):4476(A→G),4638(A→G),4651(-→T);C7028T处基因位点突变测序图谱(见图4):6984(C→T),6910(C→A),6963(G→A),7083(C→ -),6979(G→C)6984(C→T)。
3 讨论
帕金森病是一种常见的晚发性神经退行性病变,病理变化以中脑黑质部位多巴胺神经元的死亡和路易体的形成为特征。PD神经元死亡的主要形式是细胞凋亡,在细胞凋亡过程中线粒体起着中心调控作用。
最近几年,遗传和流行病学方面的证据表明,大多数PD患者为散发性,PD来自母系遗传,提出线粒体基因组的改变可能是PD发病的根源[4]。mtDNA是独立与核染色体NDA以外的基因组,其基因产物均直接或间接与细胞的氧化和磷酸化有关,氧化磷酸化是脑细胞能量的主要来源,在调节细胞内钙稳态和细胞生存/死亡中起关键作用,有关线粒体DNA增殖的机制:一是可能存在代谢反馈系统,细胞通过刺激线粒体增殖代偿减少氧化磷酸化能力;另外一个可能是野生型线粒体DNA顺式控制作用,由于基因突变被抑制或失活,突变型线粒体DNA的量超过野生型,导致与细胞能量及代谢需要无关的突变型过度增加[5]。mtDNA的突变能影响与呼吸链有关的酶和氧化磷酸化过程,造成线粒体氧化磷酸化功能障碍,而且mtDNA突变引起电子传递链的功能缺陷增加线粒体中反应性氧自由基的生成,形成反应性氧自由基的恶性循环,同时,线粒体功能失调,能量不足,引起多巴胺神经元细胞死亡,组织细胞退行性病变,最终导致PD的发病[4~6]。本研究发现的多个mtNDA位点的突变也可能经过上述的机制造成PD的发病。
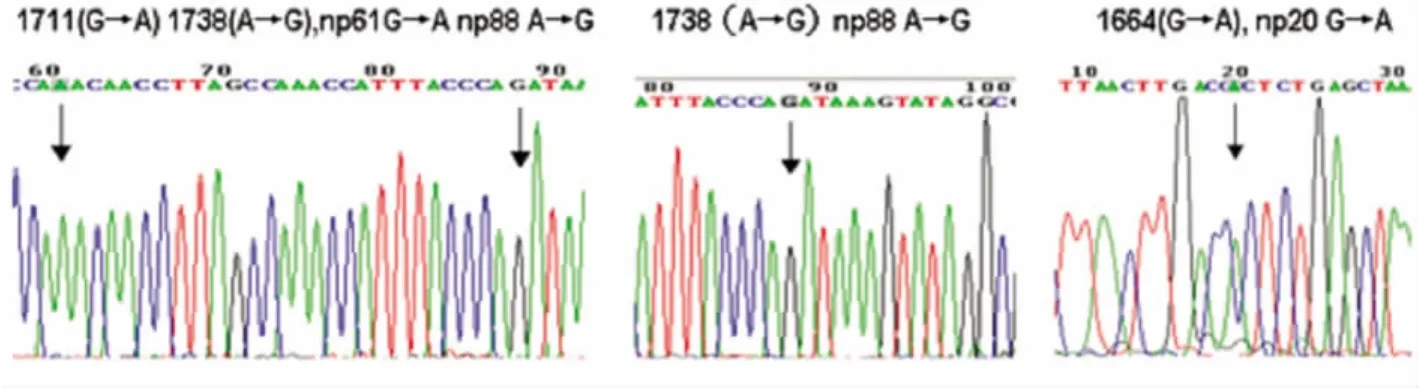
图2 G1719A处基因位点突变测序图谱

图3 G4580A处基因位点突变测序图谱

图4 C7028T处基因位点突变测序图谱
本研究针对文献报道与PD有关的编码呼吸链酶复合体Ⅰ基因位点G1719A、G4580A、C7028T进行基因PCR扩增,同时对21例异常基因位点进行DNA测序,并没有发现这3个基因位点的突变,反而在其附近发现了多个位点的突变,共发现11种突变类型,对照组无发现突变位点,预示患者的线粒体功能受损,这可能与这些位点的突变率低、个体异质性以及地域差异等有关,这与蒋义国等[6]的研究结果类似。本研究尽管发现了PD患者mtNDA的多个位点突变,但不能肯定这些位点的突变对于PD具有临床或病理意义,因为我们不知道其究竟是同义突变还是错义突变,有待继续深入研究。
[1] van der Walt JM,Nicodemus KK,Martin ER,et al.Mitochondrial polymorphisms significantly reduce the risk of Parkinson disease[J].Am JHum Genet,2003,72:804 -811.
[2] Litvan I,Bhatia KP,Burn D J,et al.SIC task force appraisal of clinical diagnostic criteria for Parkinsonian disorders[J].Mov Disord,2003,18(5):467 -472.
[3] 王学波,李建远.人线粒体DNA荧光定量PCR检测方法的建立[J]. 生物医学工程研究,2008,27(4):298 -301.
[4] Shih CM,Ko WC,Wu JS,et al.Mediating of caspase-independent apoptosis by cadmium through the mitochondria-ROSpathway in MRC-5 fibroblasts[J].JCell Biochem,2004,91(2):384 -397.
[5] 季米娜,窦宵云,谭建强,等.帕金森病与线粒体的相关性研究进展[J]. 广西医学,2007,29(5):729 -731.
[6] 蒋义国,Tammy Ellis,周兰兰,等.帕金森病相关的线粒体多态性基因型分析[J].环境与健康杂志,2007,24(6):409-411.
