促红细胞生成素多克隆抗体及酶标抗体的制备及纯化研究
2011-08-20曾昭伟王学谦
曾昭伟,王学谦
(1.天津医科大学研究生院,天津 300070;2.天津市天津医院 检验科,天津 300211)
促红细胞生成素(erythropoietin,EPO)是一种促进红系造血前体细胞分化、繁殖的细胞因子,相对分子量为32-39KD,在调节人体循环红细胞,维持一定浓度中有重要作用。EPO释放增加导致红细胞增多,释放减少则导致红细胞减少,它和多种疾病相关[1,2]。EPO缺乏最常见的原因是慢性肾衰。而生成过度常见于组织缺氧、血红蛋白血症。
EPO含量的高低在某些疾病的诊断中,是重要的检测项目。现在,ELISA方法由于简便快捷、成本低,灵敏度、特异度均较高等优点,成为研究的重要方向。
由于抗EPO抗体可测定有免疫活性的EPO,制备抗体及酶标抗体在ELISA检测体系中具有重要应用价值。本研究从来源充足、纯度较高的rhEPO入手,免疫动物制备多克隆抗体,并标记酶标抗体,为进一步建立EPO相关试剂盒做好准备。
1 材料与方法
1.1 材料(1)主要试剂:rhEPO购自华北金坦生物技术股份有限公司;pH7.4的磷酸盐缓冲液(PBS);胎牛血清来自天津沃克生物科技公司;BSA购自天津北方天医化学试剂厂;醋酸钠、高碘酸钠、硼氢化钠均购自天津北方天医化学试剂厂;弗氏佐剂购自sigma公司。(2)主要仪器:电泳仪购自北京六一仪器厂;PH计、AL104电子天平均购自天津市天马仪器厂;磁力搅拌器购自天津市华北实验仪器有限公司;HD-A电脑采集器及HD-3紫外检测仪均购自上海沪西分析仪器有限公司;微孔滤膜购自Whatman;透析袋购自 specteum;辣根过氧化物酶(HRP)购自GE公司。
1.2 方法
1.2.1 抗原的纯化 纯化rhEPO,凝胶在平衡液中充分溶胀处理。把处理好的凝胶预先装柱,装好凝胶柱后,用平衡液过洗柱子后上样,样品与柱床体积比例为5%,按照体积比是凝胶的5倍,用平衡液0.1M的PBS充分洗涤凝胶,连接收集器和分光光度计,波形会在电脑上反映出来,直到将波形冲至基线,并维持一段时间。换高浓度磷酸盐充分冲洗直至新的平衡。洗脱液冲洗时体积约为凝胶柱体积的5倍。收集洗脱液洗下的峰,各部分组分应该加入中和液。
1.2.2 兔抗人EPO多克隆抗体的制备及鉴定 用纯化的rhEPO抗原纯品免疫新西兰家兔2只,6-8周龄,雄性。(1)每只兔后足脚垫各注射或完全福氏佐剂0.2 ml(相当于卡介苗每兔5 mg);10-14天后两侧窝淋巴结可肿大,如蚕豆大小,即可作淋巴结注射。(2)第一针于两侧窝淋巴结内注射佐剂抗原乳剂0.5 ml(1 mg/ml),一侧一个淋巴结。每个淋巴结内注射0.25 ml。(3)注射加强针,途径、剂量同第一针,间隔约2周。(4)试血测效价,合格则放血。从家兔颈动脉处放血,分离血清后,-20℃保存。(5)鉴定:制备琼脂板,抗原在板的中央,将多克隆抗体倍比稀释剂3个浓度环形等距分列于外周,37℃保温24 h。将制备的多克隆抗体,与CEA、PSA抗原采用间接ELISA法进行反应,鉴定特异性。
1.2.3 抗体的亲和层析纯化 (1)盐析法粗提纯:取2 ml抗体加2 ml生理盐水,于搅拌下逐滴加入4 ml饱和硫酸铵,硫酸铵的终饱和度为50%,4℃,3 h以上,充分沉淀。离心3 000 rpm,30 min,弃上清,生理盐水溶解沉淀,逐滴加饱和硫酸铵1 ml,置4℃3 h以上,(NH4)2SO4的饱和度为40%,以0.02M pH 7.4PB溶解至2 ml装入透析袋。(2)亲和层析:用平衡液浸泡SPA-Sepharose 4B凝胶15-30 min,用平衡液充分洗涤直至波形到基线。盐析过的抗体纯化产物加样,室温吸附30 min。再用平衡液冲洗至基线,以洗脱杂蛋白。用pH6的洗脱液洗脱,收集峰值出的洗出液。重新洗至平衡后,用pH3的洗脱液洗脱,收集峰值出的洗出液。洗出液各个组分均加入中和液,将含蛋白的洗脱液装入透析袋,对pH7.4PB(含0.02%叠氮钠)4℃透析过夜浓缩。洗脱得到的抗体过0.45 μ m 滤膜 。
1.2.4 酶标记EPO抗体 (1)取HRP10 mg,溶入10 mM乙酸钠溶液中电磁搅拌,直至溶解。加入0.2M的高碘酸钠,室温避光搅拌,反应15 min。然后,加入1ml的0.2M乙二醇,室温下避光轻轻搅拌1 h。用0.2 M的pH9.5碳酸盐缓冲液G-25凝胶柱洗脱,流速2 ml/min。(2)抗体在透析袋内于0.2 M的pH9.5碳酸盐缓冲液中4℃电磁搅拌透析过夜。(3)酶与抗体反应:按照酶与抗体体积之比为1∶9的比例混合,避光搅拌反应1 h。加0.1 ml新配的4 mg/ml NaBH4液,混匀,再置4℃1小时终止反应。(4)准备G200层析柱[3]:用平衡液冲至平衡。将所得样品过柱子,用平衡液冲洗,收集洗脱峰。
2 结果
用SDS-PAGE测定,步骤见文献[4]。
2.1 EPO抗原纯化结果
2.1.1 EPO抗原纯化示意图 见图1。
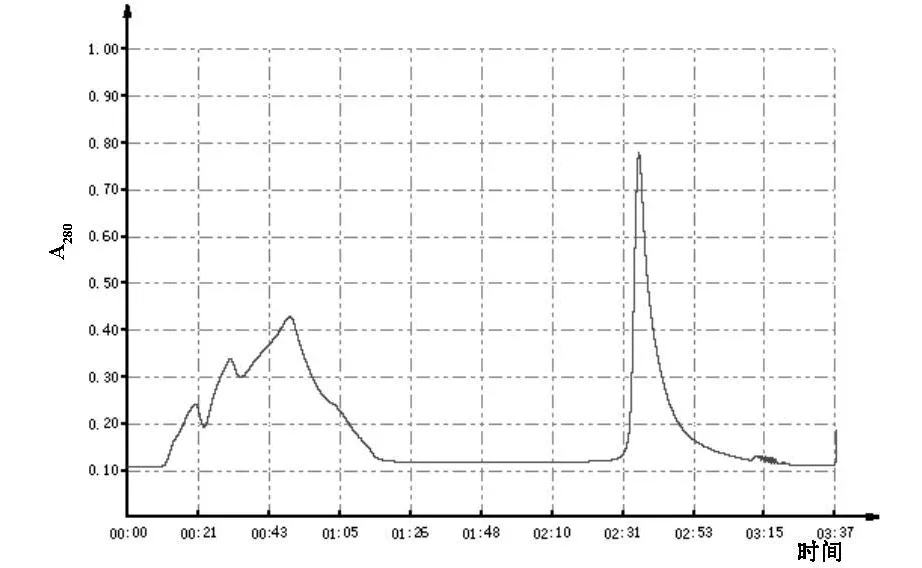
图1 EPO抗原纯化
2.1.2 蛋白质含量测定 将待测的纯化EPO抗原样品用PBS做适当 5倍稀释,分别测定OD280、OD260的值分别为0.87、0.95,设定稀释液作为阴性对照。按照经验公式:蛋白质浓度=(1.45 OD280-0.74 OD260)×稀释倍数,即,浓度=1.45×0.87-0.74×0.95=0.56(mg/ml)。
2.1.3 蛋白质纯度测定 SDS-PAGE测定纯度。蛋白标准分子量为 14.4 KD、20.0 KD、24.0 KD、35.0 KD、45.0 KD、66.2KD、94.0 KD。在浓缩胶中时,100 V恒压电泳,待溴酚兰染料进入分离胶后,调整电压120V恒压电泳,直至溴酚兰迁移至距凝胶下缘1 cm处,停止电泳。用考马斯亮蓝染料R250染色,上样的EPO抗原蛋白在胶上,相对应地在35 KD附近有明显的不杂乱的条带。
2.2 EPO抗体的纯化结果
2.2.1 EPO抗体的纯化示意图 见图2。
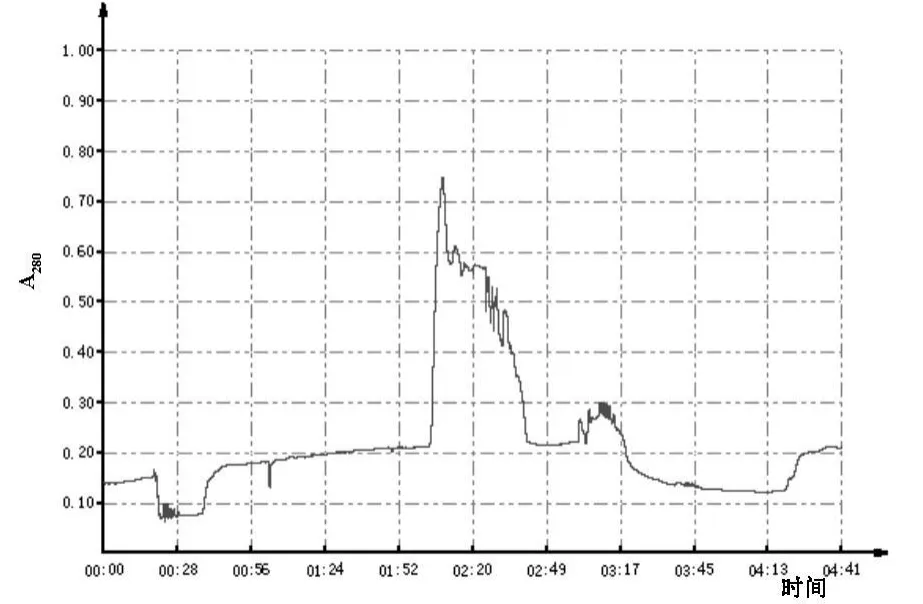
图2 EPO抗体纯化示意图
上图中,第一个峰为pH=6洗脱出的,第二个则为pH=3洗脱出的。我们对两者均进行收集。分别加入中和液之后,透析浓缩。
2.2.2 抗体蛋白的含量测定 测定OD280、OD260的值分别为0.97、1.35,根据公式:蛋白质浓度=(1.45 OD280-0.74 OD260)×稀释倍数,浓度=1.45×0.97-0.74×1.35=0.41(mg/ml)。
2.2.3 抗体效价测定 免疫的两只家兔血清中EPO抗体效价为 :1∶15 000,1∶20 000。
2.2.4 特异性鉴定 见表1。

表1 EPO多克隆抗体与 rhEPO、PSA、CEA的反应测定
2.3 酶标EPO纯化结果
2.3.1 纯化结果 见图3。
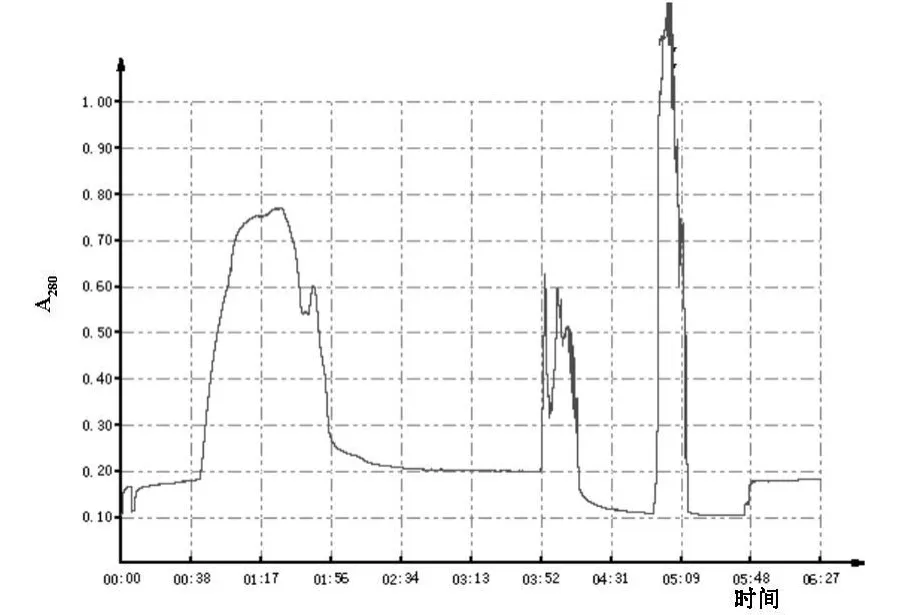
图3 HRP标记抗体洗脱示意图
本方法为分子筛凝胶过滤,洗脱出的第一个峰是分子量最大的HRP-Ab复合物,后面的两个峰分别是游离的酶和抗体。
2.3.2 酶标抗体浓度鉴定
酶量(mg/ml)=OD403×0.4=1.04(mg/ml)。IgG量(mg/ml)=(OD280-OD403×0.3)×0.62=2.306(mg/ml)。摩尔比值(E/P)=mg(酶)4/mg(IgG)=1.80。酶结合率=OD403/OD280,值为0.578,一般以标记率0.30-0.60为合格。
一般认为酶量为1 mg/ml摩尔比值在1.5-2.0之间并且酶标记率大于0.3时,ELISA结果最好[5]。
3 讨论
现代,基因重组技术的飞速发展,将EPO目的蛋白基因插入表达载体,转染真核细胞,在诱导剂条件下,可大量地表达rhEPO,成本低,表达量大,已成为制备抗体所用抗原的重要来源[6]。
本研究采用蛋白A凝胶的亲和层析法,效果更佳,免疫亲和层析可以达到很高的纯度[7,8],有时仅一步纯化即可达到纯化的目的,将抗体结合后洗脱,回收率可达50%以上,和相关报道一致[9],不必三步纯化,以免导致回收率下降。本研究结果显示,蛋白纯度较高。
ELISA方法中,检测待测血清中的抗原量时,需要将酶连接在与抗原结合的二抗上,再通过酶与底物的显色反应来表示抗原的浓度。HRP与抗体的结合需要交联剂,常用的交联方法是改良过碘酸钠法[10]。HRP分子中与酶活性无关的糖基被过碘酸钠(NaIO4)氧化为醛基,可以与抗体的氨基反应形成Shiff键。获得的酶标记抗体产率较高,将近70%的HRP与Ig结合,99%的Ig与HRP结合,酶与抗体的活性均无重大损失。
免疫学检测方法主要有酶联免疫检测、放射免疫检测以及化学发光免疫检测,但是,放射免疫检测不可避免的有放射性危害,化学发光法仪器价格昂贵,这些都限制了它们的应用,ELISA方法成为较合适的选择。本研究从rhEPO的纯化入手,免疫动物制得多克隆抗体,抗体特异性强。本研究制备了酶标记抗体,实验结果证实,在纯化过程中,抗原、抗体损失量小,纯度较高。完全符合进一步构建ELISA试剂盒的要求。
[1]Oslawska-Dzierzega A,Dabrowska M,Hrycek E,et al.Selected problems concerning anaemia in systemic lupus erythematosus patients[J].Pol Merkur Lekarski,2009,27(162):503.
[2]Kato F,Takeuchi N,Takenoshita E,et al.Retardation of hemodialysis by recombinant human erythropoietin in patients with chronic kidney disease[J].Nippon Jinzo Gakkai Shi,2010,52(1):58.
[3]Karpatkin S,Nardi MA,Hymes KB.Sequestration of anti-platelet GPIIIa antibody in rheumatoid factor immune complexes of human immunodeficiency virus 1 thrombocytopenic patients[J].Proc Natl Acad Sci U S A,1995,92(6):2263.
[4]沈关心,周汝麟,主编.现代免疫学实验技术[M].武汉:湖北科学技术出版社,2002:535-538.
[5]徐顺清,刘衡川,主编.免疫学检验[M].北京:人民卫生出版社,2006:126-127.
[6]Liu X,Wu Y,Li M,et al.Production of polyclonal antibody against interleukin-33 and assessment of its distribution in murine liver and lung[J].J Biomed Biotechnol,2009,2009:729197.
[7]Aizawa P,Winge S,Karlsson G.Large-scale preparation of thrombin from human plasma[J].Thromb Res,2008,122(4):256.
[8]赵丹慧,王 娜,张 艳,等.人甲状旁腺激素多肽抗体制备及纯化方法研究[J].中华检验医学杂志,2006,29(2):168.
[9]Gokana A,Winchenne JJ,Ben-Ghanem A,et al.Chromatographic separation of recombinant human erythropoietin isoforms[J].J Chromatogr A,1997,791(1-2):109.
[10]Sakuma S,Sagawa T,Masaoka Y et al.Stabilization of enzyme-susceptible glucoside bonds of phloridzin through conjugation with poly(gammaglutamic acid)[J].J Control Release,2009,133(2):125.
