联合检测血清脑钠肽及游离三碘甲腺原氨酸对于慢性心力衰竭患者的预后评价
2011-08-20郭子源刁鸿英
郭子源,刁鸿英,刘 斌
(吉林大学第二临床学院心内科,吉林长春 130041)
心力衰竭是任何心脏病的终末期改变,交感神经兴奋及多种内分泌功能异常参与且影响了心衰的进程。目前的研究表明血清FT3水平的下降、BNP水平的增高均可作为慢性心力衰竭病人危重程度的独立预测因子。本文通过对慢性心力衰竭患者及健康对照组血清BNP及FT3水平同时检测,同时对比左室射血分数(EF)及左室内径(LV),比较CHF患者上述指标的改变,进一步说明对于CHF患者同时检测血清BNP及FT3的临床意义。
1 材料与方法
1.1 研究对象收集我院2009年10月至2010年10月124例CHF患者,其中男性 66例,女性 58例,年龄45-80岁,心力衰竭的诊断根据患者的病史、症状、体征及心脏彩超等相关检查为依据。其中冠心病74例,高心病20例,扩张型心肌病17例,心脏瓣膜病13例,所有患者均排除入院前6个月内发生急性心肌梗死、甲状腺疾病、糖尿病、重症肝肾疾病,且近2周内未服用影响甲状腺功能的药物。心功能按照NYHA分级,其中心功能Ⅱ级 20例(男 10/女10),心功能Ⅲ级68例(男36/女32),心功能Ⅳ级36例(男20/女16)。同时选择30例健康对照组,年龄55-75 岁 ,男 18例 ,女 12例 。
1.2 方法受试者在入院时治疗前清晨空腹采肘正中静脉血6 ml分置于2个塑料试管中。分别离心,收集血清,加入反应杯中,用美国BECKMan公司生产的DX1800以化学发光法测定BNP,试剂盒为美国BECKMan公司提供;用科大创新股份有限公司中佳分公司生产的γ-放免计数仪GC-2016以放射免疫法测FT3,试剂盒为淮坊三维生物工作集团有限公司提供。严格按说明书操作完成。并于正规治疗半年内进行随访,统计因心衰加重再住院率,并分组比较。
1.3 统计学分析采用SPSS 13.0软件对数据进行分析,计量资料以均数和标准差(±s)表示;多组间均数的比较采用方差分析,两两比较采用SNK-q检验;计数资料采用χ2检验;因心衰加重再度入院事件的发生影响因素采用Logistic回归进行分析。
2 结果
CHF患者根据不同心功能级别检测FT3、BNP水平结果见表1。全部124例患者中有45例病人出现FT3低于正常值,与正常FT3患者比较,均表现为高龄、高心功能分级及BNP水平显著高于正常,P<0.01;而与EF及LV大小无相关性(表2)。平均随访期为半年,其中61人因心衰加重再度入院(次数1次以上),其中5人死亡(均为心源性终点事件)。再入院组BNP、FT3与未再入院组有显著差别,P<0.01,见表3。以是否发生因心衰加重再入院事件为自变量,NYHA分级、EF、LV、BNP和FT3为因变量拟合Logistic回归模型,所有变量一次全部纳入模型。结果显示NYHA分级越高,BNP值越高,FT3越低的越容易发生再入院事件,而EF、LV与再入院的关联则无统计学意义,见表4。
表1 不同心功能级别患者FT3、BNP、EF、LV比较 (±s)

表1 不同心功能级别患者FT3、BNP、EF、LV比较 (±s)
注:a表示与对照组比较 P<0.01;b表示与心功能Ⅱ级组比较P<0.01;A表示与对照组比较P<0.05;B表示与心功能Ⅱ级组比较 P<0.05;C表示与心功能Ⅲ级组比较P<0.05。
组别 年龄 EF(%) LV(mm) BNP(pg/mL) FT3(pmol/L)对照组 30(30例) 66.50±8.16 59.33±7.42 42.57±6.75 50.90±16.10 5.46±1.45心功能Ⅱ级(20例) 65.60±4.77 57.20±9.37 41.25±9.77 702.30±422.71A 4.50±1.53a心功能Ⅲ级(68例) 66.62±10.87 50.68±11.45aB 53.44±6.81ab 1869.84±1368.75ab 3.75±1.39aB心功能Ⅳ级(36例) 63.78±6.51 44.39±9.95abC 56.31±9.74ab 2170.33±1273.65ab 3.07±1.36ab
表2 根据不同 FT3水平检测各项指标变化 (±s)

表2 根据不同 FT3水平检测各项指标变化 (±s)
注:a表示与低T3组比较P<0.01。
观察指标 合计(124例) 低FT3(45例) 正常FT3(79例)年龄(岁) 65.63±9.03 69.02±9.56 63.70±8.16a EF(%) 49.9±11.44 47.8±12.04 51.1±10.99 LV(mm) 52.31±9.61 54.24±8.02 51.20±10.29 NYHA分级 3.13±0.66 3.36±0.57 3.00±0.68a BNP(pg/mL) 1768.77±1321.92 2556.67±1610.75 1319.96±854.36a
表3 半年随访期内未再入院患者、再入院患者首次入院时BNP及FT3水平 (±s)

表3 半年随访期内未再入院患者、再入院患者首次入院时BNP及FT3水平 (±s)
注:a表示与未入院组比较 P<0.01。
观察指标 合计(124例) 未再入院(63例) 再入院(61例)BNP(pg/mL) 1768.77±1321.92 1018.63±624.67 2543.49±1406.44a FT3(pmol/L) 3.67±1.47 4.27±1.42 3.06±1.27a
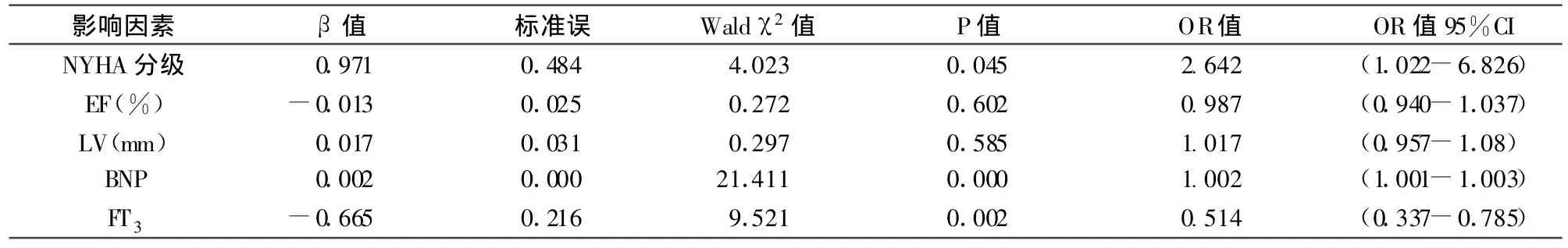
表4 因心衰加重再入院事件发生影响因素采用Logistic回归分析结果
3 讨论
心力衰竭的预后评估与BNP、FT3水平、年龄及心功能分级密切相关,而与射血分数及左室内径无确切关系[1],部分心衰病人经过合理的治疗后心功能明显改善及左室内径明显回缩也证明了心脏的结构变化无法确切反映病人的预后,而NYHA心功能分级是症状性诊断方法,受患者主观性影响较大,准确性不高。故很多学者致力于寻求客观的临床化学诊断指标。近年来,CHF患者甲状腺激素水平的变化受到了人们的重视。CHF患者甲状腺激素水平变化主要表现在外周代谢的异常,呈T3降低,T4下降或正常,rT3增高,促甲状腺素正常,临床上称这种改变为低T3综合征。研究表明T3水平的下降可作为心衰危重程度及预后判定的独立因子[2]。心力衰竭时发生低T3可能的机制是:(1)甲状腺分泌的T4于外周组织中尤其肝脏中的5'脱碘酶(D1、D2)作用下外环脱去单碘成为T3,D3酶作用下内环脱去单碘成为rT3。心衰时儿茶酚胺、皮质醇、糖皮质激素分泌增多及机体明显的乏氧状态使5'脱碘酶(D1、D2)活性受抑制,T3生成减少,而rT3生成增多,造成血中T3下降,rT3升高。(2)心力衰竭患者组织缺氧、胃肠粘膜淤血、食欲不振、营养物质缺乏,蛋白质合成减少,外周组织对T3利用增加,导致甲状腺激素代谢障碍[3]。(3)心力衰竭时外周组织细胞膜及核T3受体上调,需结合大量T3才能维持机体代谢水平[4]。T3的下降程度与慢性心衰的严重程度密切相关,同时T3下降也加重心衰的进展。甲状腺激素对心脏的影响主要表现在:(1)甲状腺激素能调节心脏多种蛋白的转录过程,包括心肌结构蛋白、调节蛋白、心肌膜离子通道及心肌细胞表面受体等[5]。并因此直接及间接的影响心肌收缩及舒张功能。(2)甲状腺激素可调节外周血管的舒缩而改变血流动力学,继而影响心室前后负荷[6]。(3)甲状腺激素可调节心肌收缩、舒张与心率的配比,而使心脏维持最佳的工作效率。(4)甲状腺机能减退时可直接损伤心肌细胞,最终导致心衰。有人已经通过小鼠实验证明单纯甲减即可导致心衰的发生[7]。现已有不少小剂量甲状腺激素用于治疗难治性心衰的报道,并取得较好的疗效[4],但目前对发生低T3综合征的CHF患者是否给予补充小剂量的甲状腺素的观点仍不统一。
BNP对心衰的诊断价值已取得一致认可,BNP大于400 pg/ml基本可确定心衰的诊断。BNP广泛分布于脑、脊髓、心、肺等组织,其中以心脏内BNP含量最高。它是一种肽类,在体内或体外能被蛋白酶所降解。它的含量与心室的压力、呼吸困难的程度、神经激素调节系统的状况相关。心室的体积和压力增高可导致血浆内BNP的升高,升高的程度与心室扩张和压力超负荷成正比。心衰时心室壁张力升高和压力超负荷迅速刺激BNP基因高度表达,大量合成BNP分泌入血。故血中BNP浓度测定为CHF诊断提供了一个客观的有效的临床化学诊断指标[8]。已有较多证据表明BNP与心衰分级呈正相关。但也有学者认为当大面积心肌变性、坏死、纤维化后,BNP的合成单位减少,以至于BNP在终末期心力衰竭患者中反而升高并不显著,因此影响对心衰病人危重程度及预后的判断。同时BNP的水平明显受肾功能代谢的影响,已经有较多学者报导肾衰竭时BNP显著增高,甚至有学者认为BNP可作为肾功能不全早期评估及预后判断的指标[9]。而CHF患者可因长期的肾有效血流灌注不足而进展为慢性肾功能不全,故势必影响BNP与心衰程度的相关性,对患者预后判定上有所干扰。而T4向T3的转换主要在肝脏进行,少部分在肾脏及其它外周组织完成,FT3的水平受患者机体综合状态的影响,反之,低FT3也是反应患者机体综合状态不佳的指标,与慢性疾病的衰竭状态密切相关,且较少受肾功能不全的干扰[10]。
在本研究中,CHF患者血FT3水平明显低于正常对照组,而BNP显著高于正常对照组,与目前相关报道结论一致。NYHA分级越高,BNP值越高,FT3越低的患者越容易因心衰加重而再入院,而EF、LV与再入院的关联则无统计学意义。同时本研究中也发现5例死亡患者FT3水平显著降低,而BNP水平与其他再住院患者差异不大,因死亡病例个数较少,未做统计学对比。但可初步提示低FT3对慢性心衰患者尤其是重症心衰患者的死亡率的预测价值可能更高。综上,同时检测血清FT3与BNP水平,为医生对CHF患者危重程度及预后判断方面提供了客观准确的临床检验指标,将二者联合分析能更精准的判断心衰患者的危重程度及预后。
[1]Williams SG,Ng LL,O'Brien RJ,et al.Comparison of plasma N-brainnatriuretic peptide,peak oxygen consumption,and left ventricular ejection fraction for severity of chronic heart failure[J].Am J Cardiol,2004,93(12):1560.
[2]Pingitore A,Landi P,Taddei MC,et al.Triiodothyronine levels for risk stratification of patients with chronic heart failure[J].Am J Med,2005,118:132.
[3]Constantinos Pantos,Athanasios Dritsas,et al.Thyroid hormone is a critical determinant of myocardial performance in patients with heart failure:potential therapeutic implications[J].European Journal of Endocrinology,2007,157:515.
[4]Anthony Martin Gerdes,PhD,Giorgio Iervasi,MD.Thyroid Replacement Therapy and Heart Failure[J].Circulation,2010,385.
[5]Rohrer DK,Hartong R,DillmannWH.Influence of thyroid hor mone and retinoic acid on slow sarcoplasmic reticulum Ca2+ATPase and myosin heavy chain alpha gene expression in cardiac myocytes.Delineation of cisactive DNA elements that confer responsiveness to thyroid hor mone but not to retinoic acid[J].J Biol Chem,1991,266:8638.
[6]Tracy A.Thomas,James A.Kuzman,et al.Thyroid hormones induce unique and potentially beneficial changes in cardiac myocyte shape in hypertensive rats near heart failure[J].Am J Physiol Heart Circ Physiol,2005,288:H2118.
[7]Tang YD,Kuzman JA,et al.Low thyroid function leads to cardiac atrophy with chamber dilatation,impaired myocardial blood flow,loss of arterioles,and severe systolic dysfunction[J].Circulation,2005,112:3122.
[8]Blonde′-CynoberF,Morineau G,et al.Diagnostic and prognostic value of brain natriuretic peptide(BNP)concentrations in very elderly heart disease patients:Specific geriatric cut-off and impacts of age,gender,renal dysfunction,and nutritional status[J].Archives of Gerontology and Geriatrics,2011,52:106.
[9]Camille Chenevier-Gobeaux,Yann-Erick Claessens,et al.Influence of renal function on N-terminal pro-brain natriuretic peptide(NT-proBNP)in patients admitted for dyspnoea in the Emergency Department:Comparison with brain natriuretic peptide(BNP)[J].Clinica Chimica Acta,2005,361:167.
[10]Pachucki J,Hopkins J,Peeters R,et al.Type 2 iodothyronine deiodinase transgene expression in the Mouse Heart Causes cardiac-specific thyrotoxicosis[J].Endocrinology,2001,142:13.
