羟基磷灰石纳米颗粒对骨肉瘤MG63抑制作用的体外实验研究
2011-08-20李冬松刘建国
冯 卫,付 莉,李冬松,刘建国*
(1.吉林大学白求恩第一医院,吉林长春 130021;2.吉林大学白求恩第二医院)
纳米羟基磷灰石(Hydroxyapatite,HAP)作为一种新型生物医用材料,正在成为骨组织工程研究的热点,用于骨缺损的治疗研究。研究表明纳米羟基磷灰石可以作为药物载体,先前研究表明纳米羟基磷灰石对正常细胞没有抑制作用[1],而体外实验可以抑制胃癌、喉癌肿瘤细胞[2,3]。但是对骨肉瘤的作用还不十分清楚,本研究的目的是观察纳米羟基磷灰石粒子对骨肉瘤细胞MG63的作用,探讨其抑制肿瘤细胞的作用机理。
1 材料与方法
1.1 材料羟基磷灰石纳米粒子由四川大学分析测试中心提供,长径为60-80 nm,直径为10-20 nm。骨肉瘤细胞MG63细胞株由四川大学华西移植免疫实验室提供。RPMI1640培养基(Gibco公司),小牛血清(HyClone公司),丫啶橙(AO)、溴化已啶(EB)及胰蛋白酶均购自Sigma公司。
1.2 MG63细胞培养MG 63细胞培养于含10%小牛血清的 RPMI1640培养液中,37℃、5%CO2、饱和湿度下培养,隔日换液,每4天按1∶3比例传代。
1.3 MTT法检测不同浓度HAP纳米粒子对MG63生长的抑制率分别将HAP纳米粒子用培养液配制成10、20、50、100、150、200、250、300、350、400mg/L 10种浓度。将MG63细胞按1×103/孔接种于96孔板中,每孔加入培养基180μ l,于 37℃、5%CO2 下培养24 h后仔细吸出孔内培养液,分别加入上述不同浓度的HAP纳米粒子,对照组加入等量培养液,每浓度重复4孔。48 h后进行MTT法检测,酶标仪检测各孔OD值(λ=492 nm),记录结果,计算每种HAP浓度对细胞的抑制率。并计算30%抑制浓度(30%Inhibiting concentration,IC30),50%抑制浓度(IC50)和70%抑制浓度(IC70)。抑制率=100%×(试验组OD值-对照组OD值)/对照组OD值
1.4 IC30、IC50、IC70浓度HAP对MG63生长抑制作用的时效曲线 将MG 63细胞接种于96孔板中,每孔接种1×103个细胞,24 h后随机分为IC30组、IC50组、IC70组和空白对照组,每组24孔。分别加入IC30、IC50、IC70 3种浓度HAP,空白对照组加入培养液。随后每天每组4孔MG63细胞进行MTT检测,重复6天。按照上述公式计算抑制率,绘制这3种浓度HAP对MG63抑制作用时效曲线。
1.5 AO/EB染色观察HAP作用后MG63细胞形态学改变 接种MG63细胞于6孔板中,24 h后加入IC50浓度的HAP,对照组加培养液。48 h后弃培养液,加入含AO/EB(浓度为100 mg/L)的培养液,荧光显微镜观察HAP作用后MG63细胞的形态。
1.6 流式细胞术分析收集经IC 50浓度的HAP作用48 h的细胞和对照组细胞,每组10个标本,用预冷的70%乙醇固定48 h,离心后弃上清,PBS调整细胞密度至1×109/ml,RNA酶消化,50 mg/L PI染色,流式细胞仪检测,Multicycle软件分析各细胞周期比例,亚二倍体峰G1法分析细胞凋亡率。
1.7 统计学分析采用SPSS 10.0统计软件对实验数据进行统计学处理,进行t检验、方差分析。计量资料采用(±s)表示。
2 结果
2.1 MTT法检测不同浓度HAP纳米粒子对MG63生长的抑制率 浓度在0-400 mg/L范围内变化时,HAP对MG63均有不同程度抑制作用,见表1。当HAP浓度低于150 mg/L时,随着药物浓度增大,对细胞抑制率明显增加,10、20、50、100 mg/L这4种浓度的抑制率之间有统计学差异,P<0.05。当HAP浓度大于150 mg/L后,抑制率不再明显增加,进入平台期,各浓度的抑制率之间无统计学差异,P>0.05。根据内插法计算 IC30、IC50、IC70分别为12.50 mg/L、39.10 mg/L和 86.31 mg/L。
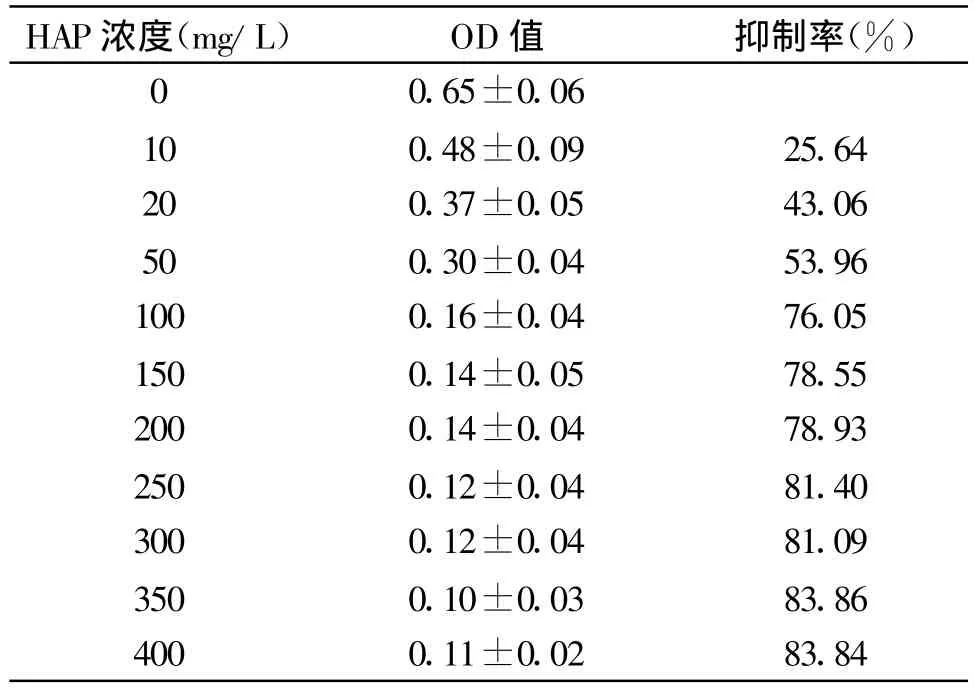
表1 不同浓度HAP纳米粒子对MG63的抑制作用(λ=492nm)
2.2 IC30、IC50、IC70浓度HAP对MG63生长抑制作用的时效曲线 见图1,这3种浓度HAP对MG63的抑制作用均随时间的延长而增加,在3天内抑制率的增长快,而在3天之后,增加速度明显减慢,表明HAP纳米粒子对MG63生长抑制作用主要发生在3天内。
2.3 AO/EB染色观察HAP作用后MG63细胞形态学改变 正常对照组的细胞数量较多,生长良好,而HAP作用后的细胞数量减少,凋亡细胞较多,凋亡细胞早期表现为细胞核呈浓染的黄绿色荧光或黄绿色碎片,晚期表现为核碎裂呈浓染的红色碎片。

图1 HAP纳米粒子作用于MG63的时效曲线
2.4 流式细胞术分析HAP组的细胞凋亡率为19.03±5.80,正常对照组为12.32±3.84,两组间差异显著(P<0.05)。HAP组G0/G1期细胞显著增多,S期细胞显著减少,同正常对照组相比两组间差异显著(P<0.05)。
3 讨论
纳米羟基磷灰石(HAP)由于颗粒尺寸的细微化使比表面积急剧增加的特点,具备和普通羟基磷灰石粒子不同的理化性能,如溶解度高、表面积大、生物活性更好等,且近年来的研究发现纳米HA有抗肝癌和舌癌等作用[4,5],其抗癌普广、作用温和,还可以作为药物载体用于疾病治疗,是一种生物相容性更好的治疗材料。
将HAP纳米粒子与MG63共培养进行MTT细胞毒性试验,发现HAP纳米粒子在不同浓度范围变化时,对MG63有不同程度的抑制作用生长,当浓度低于150 mg/L时,随着药物浓度的增大,对细胞的抑制率明显增大,呈量效依赖关系。在实验最初的3天内HAP对MG63的生长抑制率明显增加,3天后生长抑制率减慢并进入平台期,结果表明HAP对MG63的生长抑制敏感期在3天内。实验结果提示选定IC50浓度为39.10 mg/L的HAP纳米粒子进一步进行实验研究。
目前对HAP纳米粒子对肿瘤细胞的抑制作用机理还不十分清楚,诱导肿瘤细胞凋亡是治疗恶性肿瘤的一条有效途径。Bauer[6]研究发现小于100 nm的针状HAP纳米粒子具有较低的结晶度和较高的表面活化能,当HAP纳米粒子与癌细胞表面接触,HAP纳米粒子是以能量依靠型网格蛋白介导的细胞内吞噬作用方式进入细胞体内。Chen等[7]认为由于肿瘤细胞的吞噬能力较强,纳米粒子以非受体介导的直接吞噬方式进入肿瘤细胞内部,与线粒体、溶酶体或高尔基体等结合发生化学反应,导致溶酶体破裂或释放各种酶,启动细胞凋亡。其研究发现纳米HAP可以显著降低肿瘤细胞活性,诱导胃癌SGC-7901细胞凋亡,活化Caspase-3和Caspase-9。同时研究发现HAP纳米粒子的抗癌活性和诱导肿瘤细胞凋亡能力与粒子的大小密切相关,粒子在20-80 nm范围内可以有效激活caspase-3和Caspase-9,降低Bcl-2蛋白水平,同时增加Bax蛋白表达和细胞色素C的释放[8]。本研究所制备的HAP纳米粒子长径约为60-80 nm,直径约为10-20 nm,我们推测HAP纳米粒子可能通过肿瘤细胞的直接吞噬作用后进入细胞内部,与DNA结合并诱导肿瘤细胞凋亡。
通过荧光显微镜观察发现,经HAP作用过的MG63细胞形态学方面出现凋亡特征,细胞核浓缩,细胞核发生碎裂和浓染,结果提示HAP可能损伤DNA,诱导MG63细胞的凋亡。本研究通过流式细胞术定量分析了HAP组细胞的凋亡率(19.03±5.80)%,明显高于对照组。同时本研究发现HAP组的S期细胞明显少于对照组,而G0/G1期细胞明显多于对照组,因此认为HAP纳米粒子对肿瘤细胞的作用可能具有细胞周期特异性,作用于细胞的S期,损伤DNA链、阻止DNA的合成、复制,导致S期细胞凋亡,使细胞不能继续进入G2期,最终不能完成细胞分裂和增殖。
综上所述,HAP纳米颗粒对MG63有明显的抑制作用,并诱导肿瘤细胞凋亡。
[1]Hideki A,MasatakaO,Seisuke K.Effects of HAP-sol on cell growth[J].Report of the Institute forMedical and Dental Engineering,1992,26:15.[2]Zhang S,Li S,Chen F.Studies on effects of apatite ultrafine powder on cancer cells[J].J Wuhan University of Technology,1996;18(1):5.
[3]Aoki H,Ogaki M,Kano S.Effects of Adriacin-absorbing hydroxyapatitesol on Ca-9 cell growth[J].Rep Inst Med Dent Eng,1993,27(1):39.
[4]刘志苏,唐胜利,艾中立,等.羟基磷灰石纳米粒子对人肝癌和结肠癌细胞生长的抑制作用[J].中华实验外科杂志,2006,23(3):266.
[5]陈超,王慧明.纳米羟基磷灰石溶胶对人舌癌细胞株的作用研究[J].实用肿瘤杂志,2003,18(6):459.
[6]Bauer IW,Li SP,Han YC,etal.Internalization of hydroxyapatite nanoparticles in liver cancer cells[J].J Mater Sci Mater Med,2008,19(3):1091.
[7]Chen X,Deng C,Tang S,et al.Mitochondria-dependent apoptosis induced by nanoscale hydroxyapatite in human gastric cancerSGC-7901 cells[J].Biol Pharm Bull,2007,30(1):128.
[8]Yuan Y,Liu C,Qian J,et al.Size-mediated cytotoxicity and apoptosis of hydroxyapatite nanoparticles in human hepatoma HepG2 cells[J].Biomaterials,2010,31(4):730.
