蛋白酶抑制剂MG132在联合NGF诱导PC12细胞分化过程中的作用及机制
2011-08-20王晓明
王晓明,卢 伟,丁 军
(台州学院医学院解剖与组织胚胎学教研室,浙江台州318000;吉林大学第三临床医院放射科,吉林长春 130033)
神经细胞突起的形成是神经系统发育的一个重要过程,这个过程主要受神经营养因子(neurotrophic cytokine),如神经生长因子(nerve growth factor,NGF)的调控。NGF可诱导神经细胞长出突起,其机制是通过活化其特异性受体,酪氨酸激酶受体A(tyrosine kinase receptor,TrkA),使其磷酸化,从而激活了胞内的受TrkA调控的一系列的胞内信号通路完成的[1-3],如胞外信号调节激酶/丝裂原活化蛋白激酶(extracellular signal-regulated kinase/mitogen activated protein kinase,ERK/MAPK)通路和磷脂酰肌醇-3-激酶/AKT(phosphatidylinositol-3-kinase,PI3K/AKT)途径[4,5],且诱导与TrkA的磷酸化时效有关[6,7]。
泛素(ubiquitin,UB)是一种存在于大多数真核细胞中的小蛋白。它的主要功能是标记需要分解掉的蛋白质,当附有泛素的蛋白质接触到蛋白酶时,蛋白酶就会将该蛋白质水解。泛素也可以标记跨膜蛋白,如受体,将其从细胞膜上除去。最新研究报道称,TrkA受体在与NGF结合的过程,可以被NGF泛素化(ubiquitinated),而且泛素化过程可以调节活化TrkA受体胞外域由细胞的表面转移至胞内(简称内化)以及TrkA介导的信号通路[8-10]。外有报道称NGF在诱导神经细胞突起产生的过程中伴有内源性泛素和泛素化蛋白(ubiquitinated proteins)水平的升高[11]。目前虽已证实蛋白酶抑制剂可以诱导神细胞产生突起以及增强少突胶质细胞分化的作用[12-14],具体机制仍未明晰的,而且作用效果较弱[15],且有报道称高浓蛋白酶抑制剂对神经细胞有细胞毒效应[16]。在本实验中我们选用了一种常见的蛋白酶抑制剂,MG132,探讨蛋白酶抑制MG132在联合NGF诱导PC12细胞分化中的作用,并分析其诱导机制。
1 材料与方法
1.1 试剂
蛋白酶抑制剂MG132,购自Sigma公司,美国;NGF(商品号ab105059)及抗体:抗TrkA胞外域抗体(商品号ab8871),抗泛素抗体(商品号ab8134),抗Phospho-TrkAY490抗体(商品号ab1445),抗TrkA抗体(商品号 ab76291),FITC荧光标记物(商品号ab8030),均购自 Abcam生物试剂公司,上海。DMEM、马血清(商品号S9050)、牛血清白蛋白(BSA,商号号A8010)、BCA蛋白浓度测定试剂盒购自索莱宝生物科技有限公司,上海。
1.2 PC12细胞的获得、培养及分组
PC12细胞(购于中国科学院上海细胞所),接种在培养瓶内,培养基为高糖Dulbecco的改良Eagle的培养基(DMEM,Gibco,上海索莱宝生物科技有限公司),添加10%马血清,5%BSA,37℃,5%CO2细胞培养箱内培养。生长状态良好的PC12细胞,胰酶消化、离心,调细胞浓度1×105个/ml,并接种到多聚赖氨酸包被6孔培养板中。
实验分2组:Group I:NGF单独诱导组,培养体系内加终浓度为50 ng/ml的NGF;Group II:NGF与MG132联合诱导组,培养体系内加50 ng/ml的NGF、0.5-20 μ mol/L 的 MG132 。
1.3 不同条件诱导下PC12细胞分化的评判
各组PC12细胞均于诱导4 h后,显微摄影,计数镜下1 000个细胞,并计数其中阳性细胞(有突起生出的细胞)数量,评判不同诱导条件下的阳性细胞生成率。阳性细胞的评定标准为,细胞具有突起,且突起中至少有一根长度超过该细胞的一个胞体直径。
1.4 Western blot分析
各组细胞经胰酶消化,并经冷的0.01mol/LPBS缓冲液洗 3次,离心收集,加细胞裂解液(50 mM Tris-Cl,pH7.4,150 mM NaCl,5%NP-40,1mM sodium pyrophosphate,2 mM EDTA等)裂解细胞(1 ml细胞压积加入6-10 ml裂解液),轻轻吹打混匀,离心15 min,12 000转,取上清用BCA蛋白浓度测定试剂盒测定蛋白质总量,操作步骤按说明书进行。各组均取等量的蛋白质进行SDS-PAGE凝胶电泳,凝胶转膜,转移至硝酸纤维素膜。取该膜行免疫印迹染色,检测TrkA受体的磷酸化水平及泛素蛋白表达。抗体为:抗泛素抗体,抗Phospho-TrkAY490抗体,抗TrkA抗体。
1.5 流式细胞术分析
各组细胞在诱导0,15,30和60 min后,用细胞分类缓冲液洗两次(内含0.5%BSA,0.05%叠氮钠,1 mM MgCl2,1 mM CaCl2),抗TrkA胞外域抗体孵育45 min;细胞经细胞分类缓冲液再洗,FITC荧光标记物孵育30 min。细胞分类缓冲液再洗,流式细胞仪检测被荧光标记的细胞数,用于检测TrkA受体的退化及胞外域的内化程度。
2 结果
2.1 NGF及MG132诱导PC12细胞突起生成
由于MG132是蛋白酶抑制剂中的一种。文献报道蛋白酶抑制可诱导PC12细胞分化,尤其是对神经细胞生出突起具有一定的诱导作用。但具有一定的细胞毒性[16-18,26]。由于不确定在体外培养时,MG132的最佳诱导浓度,我比较了8个梯度(0.1 μ M,0.25 μ M,0.5 μ M,1 μ M,5 μ M,10 μ M,15 μ M 和 20 μ M)的MG132单独诱导下PC12细胞的分化情况。结果显示MG132诱导PC12细胞分化 24 h后,在8组中,以0.5 μ M组阳性细胞最多,阳性率为14.3%。MG132浓度大于10 μ M时,细胞大量死亡。因此在后续实验中MG132的浓度均选用为0.5 μ M,如图1。
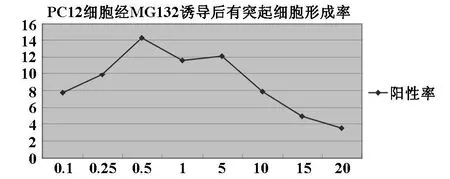
图1 不同浓度的MG132联合NGF对PC12细胞分化的诱导比较
NGF单独诱导时,结果显示具有相似的有突起细胞生成率,约12%。当联合0.5μ M的MG132作用后,约有18%的细胞长出了突起(如图2)。结果显著高于NGF单独诱导。这提示联合诱导时,MG132可强化NGF对PC12细胞突起生成的诱导。
2.2 蛋白酶抑制剂MG132对TrkA受体的磷酸化的影响
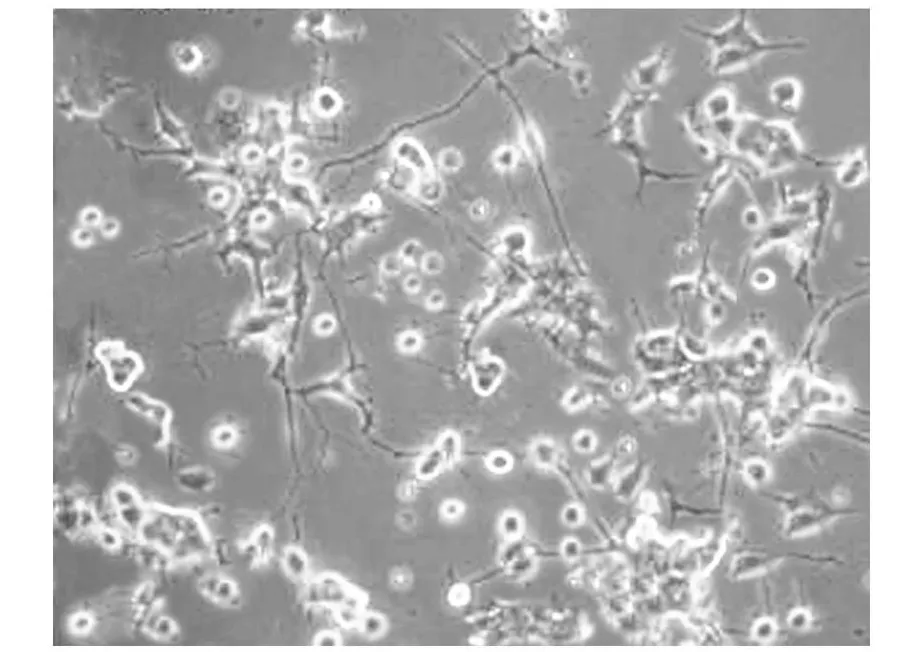
图2 MG132联合NGF诱导PC12细胞生出突起
流式细胞术(抗体为抗TrkA抗体)检测了活化TrkA受体退化的情况。结果,当NGF单独诱导时,TrkA受体在初始的15-20 min内表达呈持续高表达,随后下降,1 h后并逐渐降至未诱导前水平;当NGF联合MG132诱导时,TrkA呈在初始的1 h内均呈上高表达,随后下降,3 h后逐渐降至未诱导前水平(图3)。Western blot方法检测了TrkA受体的磷酸化水平(抗体为抗Phospho-TrkAY490抗体)。(图4)结果显示,在NGF或NGF联合MG132诱导条件下,TrkA受体都可发生磷酸化。但NGF单独诱导时,TrkA受体的磷酸化水平持续的时间明显短于NGF联合MG132诱导时,结果与流式细胞术检测的结果一致。这提示联合诱导时,MG132可延长TrkA受体的磷酸化水平,稳定活化的TrkA受体,使之延缓退化。

图3 不同诱导条件下,TrkA受体的退化与内化
2.3 蛋白酶抑制剂MG132可影响TrkA受体胞外域的内化
流式细胞术检测胞外域的内化情况(抗体为抗TrkA胞外域抗体)。结果显示NGF单独诱导时,15 min时,有21.16%的细胞发生了内化(TrkA胞外域抗体阳性表达率78.84%),30min时,为68.79%,1h时,已近乎100%完全内化(为94.95%)。当MG132联合NGF诱导时,在相同时间点上,内化率明显增加(图3)。这提示MG132可加速活化的TrkA受体胞外域的内化进程。
2.4 泛素在TrkA受体的稳定中的作用
Western blot方法检测了在不同诱导条件下的PC12细胞内的泛素水平(抗体为抗泛素抗体)。结果显示,NGF单独诱导时,PC12细胞内泛素蛋白的表达水平较高,当NGF联合MG132诱导后,PC12细胞内泛素蛋白的表达水平下降(图3)。
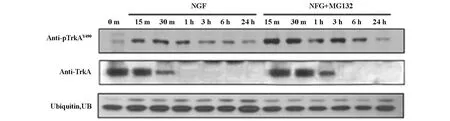
图4 Western blot检测不同条件诱导下,TrkA受体的退化与内化及泛素蛋白表达水平
3 讨论
TrkA是NGF的特异性受体,NGF通过与之结合可诱导神经细胞分化,特别是对神经细胞生出突起的诱导。诱导效果与TrkA的磷酸化时效呈正相关[4,5]。TrkA是一种跨膜受体,有三个域,分别为胞外域、跨膜域和胞内域[17]。当配体NGF与受体TrkA的胞外域结合后,TrkA活化:胞内域磷酸化;胞外域逐渐由细胞的表面转移至胞内。胞外域的内化将导TrkA受体退化[17]。
在本实验中我们尝试NGF与蛋白酶抑制剂MG132联合诱导PC12细胞分化,结果显示,MG132可强化NGF对PC12细胞分化的诱导。由于NGF诱导神经细胞分化的机制与TrkA受体活化有关,我们随后进一步探讨了MG132在强化NGF诱导PC12细胞分化的过程是否亦与TrkA受体活化有关。由于活化的TrkA受常呈现不稳定现象,短时间很快即退化[5]。我们流式细胞术检测了TrkA受体退化的情况,结果MG132可显著的延缓活化的TrkA的退化,而且亦可延长TrkA受体胞内域的磷酸化(Western blot方法检测TrkA受体的磷酸化水平)。这提示联合诱导时,MG132可延长TrkA受体的磷酸化水平,稳定活化的TrkA受体,使之延缓退化。
由于活化的TrkA受体的退化常与胞外域的内化有关[8-10]。为了进一步明晰蛋白酶抑制剂MG132延缓活化的TrkA受体退化的机制,我们采用流式细胞术检测了胞外域的内化情况。结果显示出人意料的是MG132并没如期望的那样延缓胞外域的内化,反而加速了内快的进程。这提示MG132阻抑活化TrkA的退化并不是通过阻抑胞外域的内化进程完成的。
有报道称NGF活化TrkA受体的同时,亦使之泛素化。泛素化是诱导活化TrkA受体退化另一条重要途径[8-10]。既然MG132强化NGF对PC12细胞分化的诱导并不是通过阻抑胞外域完成的,那么极有可能通过影响TrkA受体的泛素化进程来完成。我们用Western blot方法检测了诱导后的PC12细胞内泛素蛋白的表达量,结果显示NGF单独诱导时,PC12细胞内的泛素水平较高,当NGF联合MG132诱导后,PC12细胞内的泛素水平下降。
总之,蛋白酶抑制剂MG132可有效的强化NGF对PC12细胞的诱导作用;其机制与TrkA受体有关:MG132能加快TrkA受体胞外域的内化进程;延长TrkA受体磷酸化时间,使活化的TrkA受体保持稳定;这种稳定可能与抑制泛素蛋白过量表达有关。具体机制还有待于进一步探讨。
[1]Alfa R W,Tuszynski M H.and Blesch A.A novel inducible tyrosine kinase receptor to regulate signal transduction and neurite outgrowth[J].J Neurosci Res,2009,87:2624.
[2]Huang E.and Reichardt L.Neurotrophins:roles in neuronal development and function[J].Annu Rev Neurosci,2001,24:677.
[3]Huang E.and Reichardt L.Trk receptors:roles in neuronal signal transduction[J].Annu Rev Biochem,2003,72:609.
[4]Geetha T.and Wooten M.W.TrkA receptor endolysosomal degradation is both ubiquitin and proteasome dependent[J].Traffic,200,9:1146.
[5]Moises T.,Wüller S.,Saxena S.,Senderek J.,Weis J.and Kr üttgen A.Proteasomal inhibition alters the trafficking of the neurotrophin receptor TrkA.Biochem[J].Biophys Res Commun,2009,387:360.
[6]Chao M.V.andHempstead B.L.p75 and Trk:a two-receptor system[J].Trends Neurosci,1995,18:321.
[7]Vaudry D.,Stork P.J.,Lazarovici P.and Eiden L.E.Signaling pathways for PC12 cell differentiation:Making the right connections[J].Science,2002,296:1648.
[8]Geetha T.,Jiang J.and Wooten M.W.Lysine 63 polyubiquitination of the nerve growthfactor receptorTrkA directs internalization and signaling[J].Mol Cell,2005,20:301.
[9]Geetha T.,Seibenhener M.L.,Chen L.,Madura K.and Wooten M.W.p62 serves as a shuttling factor for TrkA interaction with the proteasome[J].Biochem Biophys Res Commun,2008,374:33.
[10]Jadhav T.,Geetha T.,Jiang J.and Wooten M.W.Identification of a consensus site for TRAF6/p62 polyubiquitination[J].Biochem.Biophys.Res.Commun,2008,371:521.
[11]Obin M.,Mesco E.,Gong X.,Haas A.L.,Joseph J.and Taylor A[J].Neurite outgrowth in PC12 cells.J.Biol.Chem,1999,274:11789.
[12]Inoue M.,Zhai H.,Sahazaki H.,Furuyama H.,Fukuyama Y.and Hirima M.TMC-95A,a reversible proteasome inhibitor,induces neurite outgrowth in PC12 cells[J].Bioorg Med Chem Lett,2004,14:663.
[13]Momose I.,Sekizawa R.,Iinuma H.and Takeuchi T.Inhibition of proteasome activity by tyropeptin A in PC12 cells[J].Biosci Biotechnol Biochem,2002,66:2256.
[14]Song E.J.,Hong H.M.and Yoo Y.S.Proteasome inhibition induces neurite outgrowth through posttranslational modification of TrkA receptor[J].Int J Biochem Cell Biol,2009,41:539.
[15]Pasquini L.A.,Paez P.M.,Besio Moreno M.A.,Pasquini J.M.and Soto E.F.Inhibition of the protein by lactacystin enhances oligodendroglial cell differentiation[J].J Neurosci,2003,23:4635.
[16]蔡同建,陈景元,李 妍,季爱玲,杜可军,骆文静.蛋白酶体抑制剂MG132对PC12细胞的增殖抑制作用[J].第四军医大学学报,2006,27(12):1137.
[17]Jay H.Chang,et al.Persistent TrkA Activity Is Necessary to Maintain Transcription in Neuronally Differentiated PC12 Cells[J].The journal of biological chemistry,2003,278(44):42877.
