牙周炎患者病变牙龈中白细胞介素6 mRNA及蛋白的表达
2011-08-20王晓峰张天夫
杨 欢,王晓峰,张天夫
(吉林大学中日联谊医院口腔科,吉林长春 130033)
牙周炎时,各类细胞因子形成网络调控着疾病的发生发展,在宿主反应过程中,一系列的炎症介质,特别是众多的细胞因子起到了至关重要的作用,包括白细胞介素1(IL-1)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子(TNF)和前列腺素E(PGE)等,它们不仅可以直接导致牙周组织的破坏,还可以进一步影响宿主的炎症和免疫反应进程,加重牙周组织的破坏[1,2]。
近十年来,IL-6与牙周病之间的关系引起了牙周病学者的广泛关注[3]。有研究表明,病变牙周组织和牙周炎患牙的龈沟液中IL-6的水平都较高,并且其浓度与病变的严重程度之间有一定的相关性,提示IL-6与牙周组织炎症和破坏过程有关[4]。在有害物质作用于牙周组织的初期,局部正常水平的IL-6具有一定的保护组织的作用,而增多的IL-6则对牙周组织产生破坏牙槽骨和抑制主体细胞生长等病理作用。IL-6的产生及作用受到众多因素的调控,对IL-6的检测以及抑制IL-6的分泌和破坏作用对牙周炎的诊断和治疗具有一定的临床价值[5]。但正常牙龈组织和牙周病患者病变牙龈组织中 IL-6mRNA及蛋白表达的研究较少。本实验采用RTPCR方法和Western blot半定量法检测正常牙龈组织和牙周病患者病变牙龈组织中IL-6mRNA及蛋白的表达,进一步加深对IL-6这一重要细胞因子的认识,以探讨IL-6与牙周炎致病机理的关系,掌握有效调控IL-6的方法,从而为牙周炎的诊断和治疗提供理论基础。
1 材料与方法
1.1 主要试剂及仪器
蛋白酶抑制剂、丙烯酰胺、甲叉双丙基酰胺蛋白酶抑制剂(SIGMA)
牛血清白蛋白(北京鼎华生物技术中心),蛋白质分子量标准品(上海东风生物技术公司),考马斯亮蓝G250(上海化学试剂厂),DNA Marker DL2000(TaKaRa),dNTPs(Promage),SDS(TaKaRa),低分子量标准蛋白质Moker(上海生物工程工司),IL-6抗体(福州迈新生物工程有限公司),硝酸纤维素滤膜(WHATMAN)。转移电泳仪(DYY-28A)(北京六一厂),GIS-2008凝胶图象分析系统(上海天能科技有限公司),超净工作台(LJT)(辽宁中山医疗器械厂),紫外分光光度仪(U-3410型)(日本日立公司),PE9700型PCR仪(美国),GIS-2008凝胶图像分析系统(上海天能科技有限公司)。
1.2 病例来源
研究对象为吉林大学中日联谊医院口腔科门诊就诊患者。因治疗需要而拔除的健康下颌第三磨牙的患者为正常组,共10例,其中男性6例,女性4例,平均年龄23.1岁;临床诊断为牙周炎需行牙周翻瓣术治疗的患者为牙周炎组,共20例,其中男性12例,女性8例,平均年龄40.8岁。牙周炎临床诊断标准:牙周袋深度>4 mm,患部牙龈红肿、疼痛,探诊易出血,牙齿松动度Ⅰ°-Ⅱ°,可伴有有牙周溢脓或有脓肿形成,X线片显示牙槽骨有不同程度吸收。
1.3 病例选择标准
①临床确诊为成人牙周炎患者;②下颌两侧具有牙龈出血指数相同、近中牙周袋均≥5 mm的同名后牙;③无系统性疾病;④就诊前3个月起未服用免疫制剂和抗生素;⑤半年内未做牙周治疗;⑥患者同意参加本研究。
1.4 标本制备
牙周炎患者均先进行龈上、龈下洁治术,1周后做牙周翻瓣术,术中取牙龈组织,立即放入液氮中保存,取拔除的健康下颌第三磨牙的正常龈组织,放入液氮中保存,以备RT-PCR法检测牙龈组织中IL-6mRNA。同时取新鲜标本,制备细胞悬液,采用Western blotting半定量法检测组IL-6蛋白表达。
1.5 RT-PCR检测IL-6 mRNA的表达
以Trizol法从液氮冻存50-100 mg牙龈组织中提取总RNA。紫外分光光度仪检测RNA含量及纯度,2%琼脂糖凝胶RNA电泳。按RT-PCR试剂盒操作说明将RNA逆转录为cDNA,进行PCR扩增。引物由上海生物工程技术服务有限公司合成。①人IL-6 引物 :上 游 5′-CCTTCGGTCCAGTTGCCTTCT-3′,下游 5′-CCAGTGCCTCTTTGCTGCTTTC-3′,PCR 产物长度为234bp;②β-actin 引物:上游 5′-GTGGGG CGC CCC GGG CAC CA-3′,下游5′-CTT CCT TAA TGT CAC GCA CGA TTT C-′,PCR产物长度为540 bp。PCR扩增产物经2%琼脂糖凝胶电泳,用计算机凝胶成像系统对扩增产物进行面积灰度扫描,以密度代替表达量,靶基因密度/β-acting密度,即为靶基因mRNA相对表达量。
1.6 Western blotting半定量法检测牙龈IL-6蛋白的表达
于0℃以PBS充分洗用组织制成的细胞悬液,4℃3000 r/min离心5 min,吸出上清,以5倍体积用冰预冷悬浮缓冲液裂解细胞。加入等体积2×SDS凝胶加样缓冲液。沸水浴中加热样品10 min;室温10 000 r/min离心10 min,取上清,紫外分光光度仪检测蛋白质含量,计算使用Western blotting所需样品量,每个泳道约可加100 μ g样品蛋白。取样品蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE),将分离的蛋白质转移到硝酸纤维素滤膜上进行抗原抗体反应;按膜面积0.1 ml/cm2量加入生色底物,拍摄滤膜照片 ,用凝胶成像分析系统检测IL-6蛋白显色的吸光度值。
2 结果
2.1 RT-PCR检测牙龈组织中IL-6 mRNA的表达结果
正常及牙周炎患者牙龈组织标本提取总RNA见图1。RT-PCR检测结果见图2。对条带进行光密度检测,测得IL-6 mRNA相对表达量见表1。牙周炎组IL-6 mRNA相对表达量明显高于正常对照组,两组比较差异有显著性(P<0.01)。
2.2 Western blot半定量法检测牙龈组织中IL-6的蛋白的表达结果
正常牙龈组织IL-6蛋白表达量少,牙周炎牙龈组织标本中IL-6蛋白表达量增高(见图3),两组比较差异有显著性(P<0.01)(见表2)。
图1 RNA电泳结果
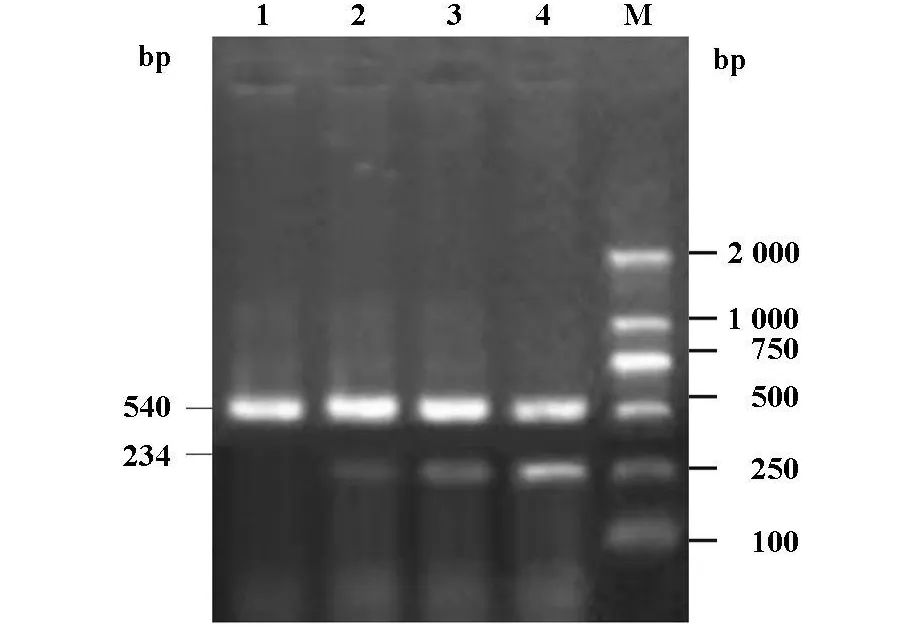
图2 RT-PCR电泳IL-6 mRNA表达结果

*P<0.01与正常组比较
表2 正常组和牙周炎组牙龈组织中IL-6蛋白表达(±s)

表2 正常组和牙周炎组牙龈组织中IL-6蛋白表达(±s)
*P<0.01与正常组比较
组织类型 例数 光密度值正常牙龈标本 10 0.46±0.02牙周炎的牙龈标本 20 0.98±0.03*
3 讨论
牙周炎所致牙周组织的破坏主要通过牙周致病菌及其产物的直接破坏和过度的宿主反应所造成的间接破坏两种途径,目前认为后一种途径是造成牙周组织破坏的主要方式[6,7]。牙周炎时,各类细胞因子形成网络调控着疾病的发生发展,在宿主反应过程中,一系列的炎症介质,特别是众多的细胞因子起到了至关重要的作用,它们不仅可以直接导致牙周组织的破坏,还可以进一步影响宿主的炎症和免疫反应进程,加重牙周组织的破坏。

图3 不同组织IL-6蛋白表达的检测
近年来,人们注意到IL-6与牙周炎有着密切的关系[8]。Johnson等运用ELISA等免疫学方法测知,健康人(龈沟深度<3mm)的正常牙周组织中含有微量的IL-6,而在牙周炎患者(牙周袋深度>3 mm)中,相应部位的IL-6分泌量明显增多,而且与袋深显著相关,特别是在袋深超过6 mm的较重的牙周炎,这种增长幅度更大。牙周炎时牙龈组织分泌的sIL-6R也明显增多。以上证据充分说明,IL-6与牙周炎有密切的联系。另外,不伴其他疾病的牙周炎患者外周血中IL-6的水平与正常人无明显差异,说明IL-6的增加局限于病变局部,而对牙周炎可能引起的全身反应无明显影响。在细菌成分及其他致病因子作用于牙周组织的初期,牙周组织中正常水平的IL-6具有一定的保护机体的作用。
研究表明,IL-6在牙周组织的表达与牙周炎病变程度之间存在正相关,不少学者提出以IL-6的表达量作为牙周破坏程度的指标,并以此为依据对其他细胞因子(如VEGF)与牙周炎的相关性进行研究[9]。McGee等发现随着牙周炎的加重,牙周组织中IL-6、IL-8及IL-1β这三种因子的变化活跃,就它们分别占三者之和的比例来看,IL-6逐渐升高而IL-8逐渐降低,因而推荐以IL-6或IL-8的比例作为牙周炎活动性及严重性的判定指标。本研究结果也支持上述观点,认为IL-6与牙周炎关系密切,可作为牙周炎的判定指标。
本研究通过RT-PCR和Western blot半定量法检测牙龈组织中IL-6 mRNA及蛋白的表达,结果显示:正常牙龈组织中IL-6 mRNA及蛋白微量表达,牙周炎患者牙龈组织中IL-6 mRNA及蛋白相对表达量明显高于正常对照组,两组比较差异有显著性(P<0.01)。表明:IL-6在牙周炎的发病过程中起着重要的作用,IL-6与牙周炎有密切的联系,检测牙龈组织中IL-6 mRNA及蛋白的表达,可以及时正确地诊断牙周炎,并且对其指导治疗、判断疗效及预后均有重要意义。有关IL-6在牙周组织的表达量与牙周炎病变程度的关系,及不同类型牙周炎病变牙龈中IL-6的表达量尚有待进一步研究。
[1]魏 东.牙周病患者治疗前后血清IL-2、IL-6和TNF-α水平及其临床意义[J].放射免疫学杂志,2005,18(06):51.
[2]匡 威.牙周病患者龈沟液IL-β的浓度水平[J].国外医学◦口腔医学分册,2003,30(4):332.
[3]王 磊,彭式韫,刘 青.白细胞介素6与牙周炎的关系[J].牙体牙髓牙周病学杂志,2003,13(1):53.
[4]赵川江,吴亚菲.白细胞介素6与牙周炎[J].国外医学◦口腔学分册,2001,28(6):344.
[5]章捍东,刘洪臣.白细胞介素-6与牙周组织的改建[J].牙体牙髓牙周病学杂志,2005,15(6):354.
[6]李永明,林 殊.白细胞介素6对人牙周膜细胞MMP-3 mRNA及蛋白表达的影响[J].现代口腔医学杂志,2003,17(3):203.
[7]黄亚莉,张 平,马慧群.牙周炎患者GCF及血清中IL-6测定及其与牙周炎的关系[J].现代口腔医学杂志,2002,16(6):510.
[8]吴亚菲,赵川江,张静仪,等.牙龈沟液中白细胞介素-6含量与牙周炎关 系的研究[J].华西医大学报,2000,31(4):494.
[9]Pobanz JM.Reinhardt RA,Koka S,et al.C5a modulation of interleukin-1 beta-induced interleukin-6 production by human osteoblast-like cells[J].J Periodontal Res,2000,35(3):137.
