DSC和XRD法研究丹皮酚和脂质体的相互作用
2011-08-11邬瑞光周洪伟张小华吴富根
邬瑞光,周洪伟,张小华,吴富根
(1.北京中医药大学中药学院,北京 100102;2.清华大学,生命有机磷化学与化学生物学教育部重点实验室,北京 100084)
丹皮酚(paeonol,结构式见图1)是中药牡丹皮和中药徐长卿的主要活性成分,具有抗炎、抗菌、抗变态反应、免疫调节和镇痛的药理作用,现已广泛用于治疗湿疹、荨麻疹、牛皮癣、银屑病等常见皮肤病[1]。丹皮酚在水中的溶解度很低,且性质不稳定、易挥发,将其制成脂质体可有效地解决难溶性问题,并能提高药物的稳定性、靶向性和增强疗效[2]。目前,对丹皮酚脂质体的研究大都集中在脂质体的制备方法、包封率以及微观形态等方面,丹皮酚与脂质体相互作用机制的的研究未见报道。脂质体膜是生物膜的模型膜,一般是由磷脂等脂质分子通过自组装形成的以双分子层为单位的多层膜(multibilayers),脂质体膜中常用的磷脂是DPPC(二棕榈酰磷脂酰胆碱,是卵磷脂的主要成分,结构式见图1)。随着温度的变化,脂质体膜可能呈现晶体相、凝胶相及液晶相等不同的相态[3]。在加热的情况下脂质体膜的相变称为热致相变。本实验通过研究丹皮酚与脂质体膜作用后脂质体膜的热致相变情况来揭示丹皮酚与脂质体的相互作用机制。

图1 丹皮酚(a)和DPPC(b)的结构式
1 仪器与试药
1.1 仪器 DSC 821e(瑞士梅特勒-托利多公司):采用高灵敏度传感器HSS7,温度误差为±0.1℃,热功率误差为±0.01mW。实时同步辐射X光衍射实验在中科院高能物理研究所北京同步辐射实验站(BSRF)进行。
1.2 试药 DPPC(美国Sigma公司,纯度>99%);丹皮酚(中国食品药品检定研究院,批号 110708-200506);氯仿、甲醇(分析纯)。
2 方法与结果
2.1 丹皮酚脂质体的制备 参照文献[4]的方法制备丹皮酚脂质体:按计量比称取丹皮酚和DPPC,溶解于氯仿和甲醇混合溶剂中(氯仿和甲醇的体积比为9∶1),30℃旋转蒸发除去有机溶剂,至烧瓶内壁形成一薄层脂膜,通N210min继续除去残留溶剂;加入超过量的Tris-HCl缓冲液;N2保护下置于60℃水浴10min,旋涡混合1min,低温 N2保护下间断性超声15min,水浴-涡旋-超声循环三次,至体系均匀分散。
2.2 DSC实验 实验气氛为N2,以空白坩埚做参比。升温速率一般为0.5℃/min,以保证样品在升温过程中处于相平衡的状态,个别样品还采用5℃/min的快速升温速率以确定该样品是否发生前相变,结果见图2。
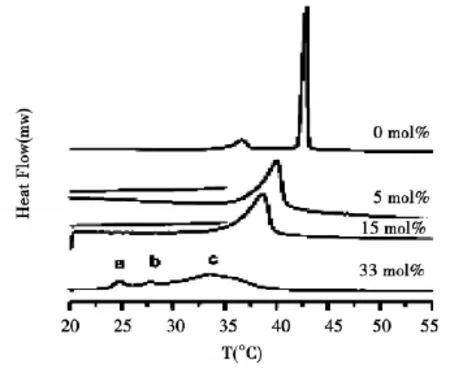
图2 不同浓度的丹皮酚/DPPC脂质体的DSC谱
2.3 同步辐射XRD实验 实验使用可以程序控温的Linkam变温附件。衍射波长为1.54Å,样品与检测器的距离为720mm,曝光时间为120s,以山嵛酸银为标准样品进行数据校正。衍射图像用Fit2D软件处理以得到衍射强度与倒置间距之间的二维衍射曲线,结果见图3。

图3 丹皮酚浓度为33mol%的脂质体在升温过程中的小角X光衍射图谱
3 讨论
根据McMullen等的方法,以吸热峰的峰顶温度(peak temperature)作为相变温度[5]。由图 2 可见,纯DPPC脂质体的DSC曲线显示了两个吸热峰,36℃左右的吸热峰为DPPC分子的前相变,由层状凝胶相转变为波动凝胶相(Lβto Pβ);42℃左右的吸热峰为DPPC分子的主相变,由波动凝胶相变为液晶相(Pβto Lα)。这一结果与文献报导的纯DPPC脂质体的相变温度一致[6]。当丹皮酚在脂质体中的浓度逐渐增大到15mol%时,DPPC分子的主相变温度逐渐降低,丹皮酚摩尔百分比分别为5mol%,15mol%时,DPPC分子的主相变温度分别为39℃,38℃。由于主相变反映的是DPPC分子疏水尾链的排列情况,所以这一结果说明,丹皮酚分子进入了DPPC双层膜的疏水区域,与DPPC分子的尾链发生了相互作用,降低了DPPC疏水尾链的有序性,增大了其流动性,故而主相变温度降低。图2表明,0.5℃/min的升温速率没有检测到5mol%和15mol%这两个样品的前相变信号,说明这两个样品没有前相变,只有主相变。为了确保这一结论的可靠性,本实验又以5℃/min的升温速率对这两个样品进行了快速升温实验,如图2中各自慢速升温曲线上方的短直线所示。结果表明,快速升温也没有检测到这两个样品的前相变。说明这两个浓度下丹皮酚的加入使DPPC双层膜在室温就已经是波动凝胶相了。文献也曾报导在DPPC双层膜中加入一些调节流动性的物质后前相变消失的例子,如在DPPC多层膜中加入一定浓度范围的豆固醇[6]、胆固醇[7]和吡柔比星[8]等分子后前相变消失。
当丹皮酚的摩尔百分比达到33mol%时,DPPC双层膜出现了3个吸热峰,如图中编号a,b,和c所示。这说明此时丹皮酚分子诱导DPPC双层膜发生了分相(phase separation)现象。此时双层膜中有两个相,分别是丹皮酚浓度很低的相(paeonol-poor phase)和丹皮酚浓度很大的相(paeonol-rich phase)。吸热峰a和吸热峰b的面积都很小,根据相图的杠杆原理,应该归属于丹皮酚浓度很低的相的吸热峰,分别对应该相的前相变和主相变,因为丹皮酚浓度很小的时候样品接近于纯DPPC,所以可以检测到前相变和主相变;吸热峰c的面积较大,应该归属于丹皮酚浓度很大的相的吸热峰,为主相变吸热峰,因为前文已述及丹皮酚浓度很大时检测不到前相变,只能检测到主相变,这3个吸热峰所代表的相变情况从同步辐射X光衍射实验结果得到验证。
图3中S值在0.15附近的衍射峰为第一级衍射峰(first order),s值在0.3左右的衍射峰为第二级衍射峰(second order)。第一级衍射峰除35℃所对应的曲线外都明显由两个峰组成,分别是s值较小的尖峰和s值较大的宽峰,这说明样品在35℃以下都分为两相,35℃时两相都转变为液晶相,故表现为一个峰,这与图2结果一致。尖峰的强度大,其峰位置在33℃ ~35℃之间有明显右移现象,符合磷脂双分子层主相变小角X光衍射谱峰的移动规律[9],说明该相由波动凝胶相变为液晶相(Pβto Lα),对应于图2中的峰c;宽峰的强度小,其峰位置在20℃ ~25℃和27℃ ~29℃之间分别有明显左移和右移现象,分别符合磷脂双分子层前相变和主相变小角X光衍射谱峰的移动规律[9],分别代表该相由层状凝胶相转变为波动凝胶相(Lβto Pβ)和由波动凝胶相转变为液晶相(Pβto Lα),分别对应于图2中的峰a和峰b。既然丹皮酚浓度很低的相可以检测到前相变,说明其浓度接近于0(即几乎为纯DPPC),这样富含丹皮酚的相中丹皮酚的浓度就应该接近于体系的浓度,即33mol%,也就是说丹皮酚/DPPC脂质体膜分相后富含丹皮酚的相态中丹皮酚和DPPC的摩尔数之比为1∶2,这样就可以将脂质体中丹皮酚和DPPC的作用机制解释为在DPPC双层膜中每2个DPPC分子中间插入1个丹皮酚分子,当然这一结论还需要进一步通过光谱等实验手段进行验证。
本实验以DPPC双层膜模拟生物膜,用DSC和同步辐射X光衍射两种方法研究了丹皮酚和生物膜相互作用后生物膜的热致相变情况。结果表明,与丹皮酚相互作用后,生物膜的主相变温度变化较大,说明丹皮酚与生物膜的疏水尾链发生了相互作用;结果还表明,较大浓度的丹皮酚可以诱导生物膜发生分相现象,且分相后富含丹皮酚的相态中丹皮酚和DPPC的摩尔数之比为1∶2,可以将脂质体中丹皮酚和DPPC的作用机制解释为在DPPC双层膜中每2个DPPC分子中间插入1个丹皮酚分子。
[1]姜洪芳,汪国华.丹皮酚复乳型凝胶的制备[J].中草药,2001,32(8):704.
[2]姜素芳,姚瑶,盛习峰,等.丹皮酚前体脂质体的制备及其特性[J].中国医院药学杂志,2008,26(6):413.
[3]Koynova R,Caffrey M.Phase and phase transitions of the phosphatidylcholine[J].Biochim Biophys Acta,1998,1376(1):91.
[4]Lichtenberger L M,Wang Z M,Romero J J,et al.Non-steroidal anti- inflammatory drugs(NSAIDs)associate with zwitterionic phospholipids:insight into the mechanism and reversal of NSAID - induced gastrointestinal injury[J].Nat Med,1995,1(2):154.
[5]McMullen T P W,McElhaney R N.New aspects of the interaction of cholesterol with dipalmitoylphosphatidylcholine bilayers as revealed by high - sensitivity differential scanning calorimetry[J].Biochim Biophys Acta,1995,1234(1):90.
[6]Wu Ruiguang,Chen Lin,Yu Zhiwu,et al.Phase diagram of stigmasterol-dipalmitoylphosphatidylcholine mixtures dispersed in excess water[J].Biochim Biophys,Acta,2006,1758(6):764.
[7]Vist M R,Davis J H.Phase equilibria of cholesterol/dipalmitoylphosphatidylcholine mixtures:2H nuclear magnetic resonance and differential scanning calorimetry[J].Biochemistry,1990,29(2):451.
[8]Cong Wenjuan,Liu Qingfei,Liang Qunlin,et al.Investigation on the Interactions between Pirarubicin and Phospholipids[J].Biophys chem,2009,143(3):154.
[9]Yu ZW,Quinn PJ.Phase Stability of Phosphatidylcholine in Dimethylsulfoxide solutions[J].Biophys J,1995,69(4):1456.
